几种非侵入性肝纤维化评分系统在肝硬化并食管胃底静脉曲张破裂出血组与非出血组间的比较
海 静,罗和生
武汉大学人民医院消化内科,湖北 武汉 430060
食管胃底静脉曲张是肝硬化门脉高压的典型表现,约50%的肝硬化患者合并食管胃底静脉曲张,其反映了肝硬化的严重程度,Child-Pugh级别越高,患者发生食管胃底静脉曲张几率越高[1]。与无食管胃底静脉曲张患者相比,食管胃底静脉曲张患者发生肝功能失代偿的风险和病死率均显著提高[2]。食管胃底静脉曲张患者进一步发展会出现食管胃静脉曲张破裂出血,临床上常常表现为突发大量呕血或柏油样便,严重者可导致出血性休克。食管胃底静脉曲张破裂出血的年发生率为5%~15%,6周的病死率可达20%,严重影响肝硬化患者的预后[1]。肝纤维化是肝硬化的基础病变,反映肝硬化的程度。通常,纤维化的评估需借助病理检查,但有创性制约了其在临床工作中的应用。因此,为了寻找非侵入性的评估工具,研究者们结合临床和血清学指标构建了多个用于预测肝纤维化水平的模型。天冬氨酸氨基转移酶血小板比值指数(aspartate transaminase and platelet ratio index,APRI)作为临床上评估肝纤维化程度的一种方式,已被推荐用于肝硬化的诊断[3]。γ-谷氨酰转肽酶血小板比值指数(r-gamma-glutamyl transpeptidase-to-platelet ratio,GPR)目前也被证实对慢性乙型病毒性肝炎纤维化有预测作用[4-5]。Attallah等[6]开发了FIB-5评分,该评分用于评估慢性丙型病毒性肝炎的纤维化程度。S-指数(S-index)是国内学者提出的一种用于预测纤维化程度的模型[7]。Williams等发现,在慢性病毒性肝炎患者中,天冬氨酸氨基转移酶谷丙转氨酶比值(aspartate transaminase-to-alanine transaminase ratio,AAR)的比率>1.0通常表明肝硬化[8]。随后的研究[9]及Chrostek等[10]研究发现,γ-谷氨酰基转肽酶的血小板比值(gamma-glutamyl 1 transpeptitiase-platelet ratio,GAPRI)对酒精性肝病纤维化程度的诊断水平与APRI、FIB-4类似。本研究旨在探讨上述非侵入性肝纤维化评分系统在肝硬化并食管胃底静脉曲张破裂出血组与非出血组间的差异。
1 资料与方法
1.1 研究对象选取2017年1月1日至2019年11月1日就诊于武汉大学人民医院的206例肝硬化并食管胃底静脉曲张患者为研究对象,并根据有无曲张静脉破裂出血分为出血组和非出血组。
1.2 研究方法
1.2.1 纳入标准:(1)所有患者均符合2019年中华医学会肝病学分会《肝硬化诊治指南》[3]中的诊断标准,并行胃镜检查明确存在食管胃底静脉曲张。其中出血组符合2019年中华医学会外科学分会脾及门静脉高压外科学组《肝硬化门静脉高压症食管、胃底静脉曲张破裂出血诊治专家共识》[1]中关于食管胃底静脉曲张破裂出血的推荐诊断标准:当内镜显示下列任一情况时,即可诊断食管胃底静脉曲张破裂出血:(1)静脉曲张有活动性出血;(2)静脉曲张上覆“白色乳头”;(3)静脉曲张上覆血凝块或无其他潜在出血原因的静脉曲张。
1.2.2 排除标准:(1)孤立性胃静脉曲张瘤破裂出血患者;(2)引起血小板异常的其他非肝脏疾病的患者;(3)肝癌及合并其他恶性肿瘤患者;(4)曾行脾切除或脾脏介入术的患者;(5)既往行门体分流术或经颈静脉肝内门体静脉分流术的患者;(6)近期进行过血液透析、腹膜透析、输血或应用血制品;(7)近期服用过影响机体凝血、生化的药物。
1.2.3 病历资料收集:包括年龄、性别、胃镜、血常规、血生化等结果。根据公式计算APRI、GPR、FIB-5、S-index、AAR、PAR、APR、GAPRI值。APRI[3]=[AST/ULN]/[PLT(×109L-1)]× 100,GPR[4]=[GGT/ULN]/[PLT( ×109L-1)];FIB-5[5]=0.3×ALB+0.05×PLT(×109L-1)-0.014×ALP+6×(AST/ALT)+14;S-index[6]=1 000×GGT/[PLT( ×109L-1) ×ALB2];AAR[7]=AST/ALT;GAPRI[10]=GGT/[PLT( ×109L-1)]×100。
1.3 统计学方法采用SPSS 25.0统计软件对数据进行统计分析,呈正态分布的计量资料以均数±标准差表示,其组间比较采用独立样本t检验,呈偏态分布的计量资料以中位数(下四分位数,上四分位数)表示,组间比较采用非参数秩和检验。计数资料以例数/%表示,其组间比较采用χ2检验。检验水准α=0.05,P<0.05为差异有统计学意义。
2 结果
2.1 基本临床资料本研究纳入研究对象共206例,男143例(69.4%),女63(30.6%)例,年龄(56.70±11.71)岁(25~81岁)。其中出血组共132例,男94例(71.2%),女38例(28.8%),年龄(56.1±12.437)岁,非出血组共74例,男49例(66.2%),女25例(33.8%),年龄(57.96±10.246)岁。两组患者中均以男性患者多见(>50%),但二者在性别及年龄方面差异无统计学意义(χ2=0.557,P=0.455;t=-1.095,P=0.275)。
2.2 基本实验室检查指标部分血清学指标水平在两组患者之间差异有统计学意义,分别为WBC、NEU%、NEU、RDW-CV、AST、GGT、ALP、ALB(P<0.05,见表1),其中出血组患者WBC、NEU%、NEU、RDW-CV水平明显高于非出血组(4.8350vs3.6050;75.3000vs61.2500;3.5700vs2.0900;0.1600vs0.1400),非出血组患者AST、GGT、ALP、ALB水平则明显高于出血组(40.00vs33.00;75.70vs33.50;101.20vs71.35;35.1408±5.9546vs31.8513±5.9426)。此外,PLT、RDW-SD、ALT水平在两组之间差异无统计学意义(P>0.05,见表1)。二元Logistic回归分析提示,NEU%是肝硬化并食管胃底静脉曲张患者发生曲张静脉破裂出血的独立危险因素,而ALB、ALP是其保护因素(见表2)。
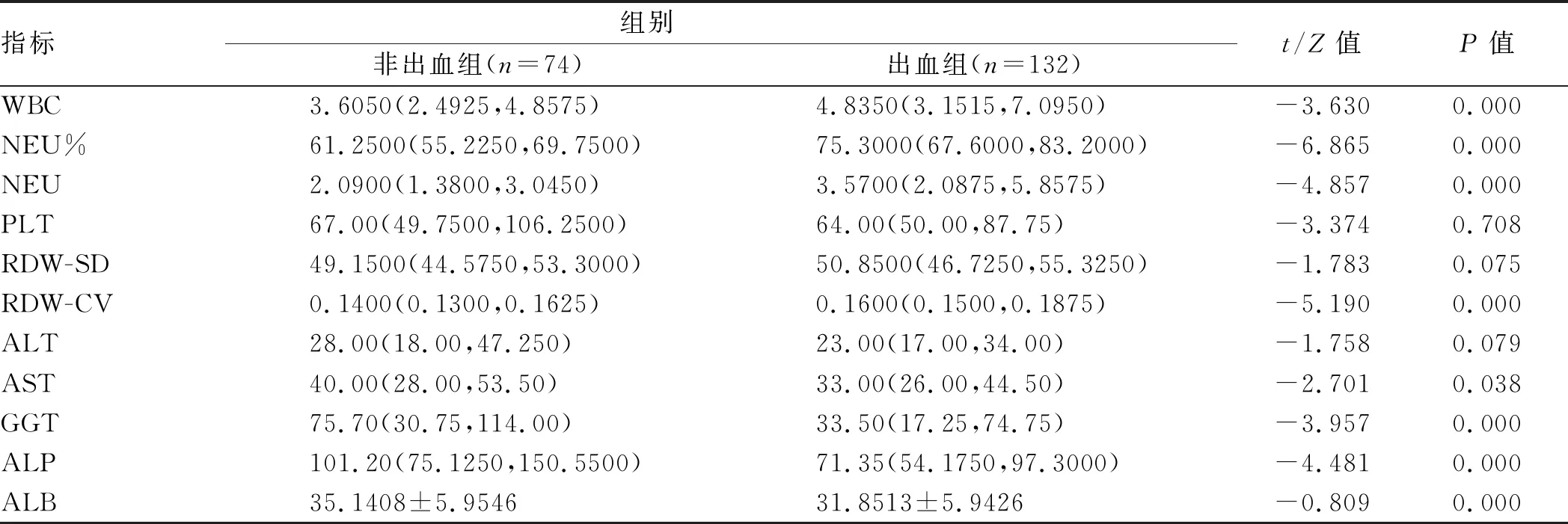
表1 出血组与非出血组各项指标单因素分析
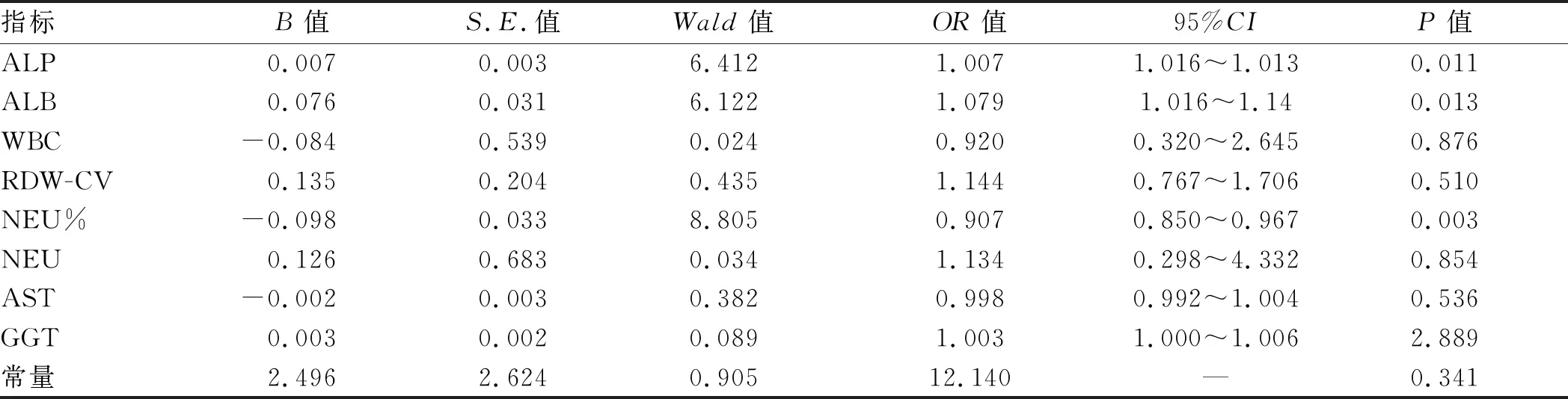
表2 二元Logistic回归分析
2.3 非侵入性肝纤维化评估指标与食管胃底静脉曲张非出血组患者相比较,出血组患者的S-index、GAPRI、GPR水平明显降低(0.5455vs0.7297;52.8925vs94.3134;0.0117vs0.0210),且上述指标在两组之中的差异有统计学意义(P<0.05);而APRI、FIB-5、AAR在两组之间差异无统计学意义(P>0.05,见表3)。

表3 出血组与非出血组非侵入性纤维化评分指标的比较
3 讨论
食管胃底静脉曲张破裂出血是临床常见的急症,是导致肝硬化患者死亡的常见原因。因此,如果能较早地预测肝硬化并食管胃底静脉曲张人群出血的风险,及时采取积极的干预措施,便有望大大降低此类人群的死亡率。当前的临床工作中,常通过胃镜检查明确肝硬化患者是否合并食管胃底静脉曲张及其曲张程度,有助于临床医师对患者出血风险的判断。遗憾的是,作为一种侵入性检查,操作时难免令患者出现一定程度的不适感,且可能存在麻醉意外,所以部分患者对胃镜接受度并不高,从而延误病情。因次,迫切需要更多的非侵入性检查协助临床医师预测肝硬化并食管胃底静脉曲张患者的出血风险。
近些年来,WHO推荐经济条件允许情况下首选FibroScan作为无创肝纤维化评估检测手段[11]。研究证明,FibroScan测得的肝脏硬度值与门静脉高压显著相关[12-13],可辅助诊断门静脉高压及判断静脉曲张破裂出血的风险[14-15]。但当患者出现腹水、黄疸、肝功能异常等并发症时,对FibroScan的检测结果造成较大干扰,且其检测成本较高,尚未大规模普及,在一定程度上局限了其在临床上的应用。为解决临床需求,寻找无创经济便捷的方法以预测食管胃底静脉曲张破裂出血的发生已成为了相对比较热门的方向。当前,已开发了数种基于血清组合的肝纤维化评分系统,用作评估肝脏纤维化水平的工具。但其是否能如FibroScan一样,在评估肝纤维化的同时具有预测食管胃底静脉曲张破裂出血的性能,需进一步探索。本研究重点探究了包括APRI、GPR、FIB-5、S-index、AAR、GAPRI在内的几种非侵入性肝纤维化评分系统在肝硬化并食管胃底静脉曲张破裂出血组与非出血组间的差异。单因素变量分析可知,出血组WBC、NEU、NEU%、RDE-CV水平均高于非出血组,但非出血组AST、GGT、ALP、ALB水平均高于出血组且差异有统计学意义。二元Logistic回归分析提示,NEU%是肝硬化食管胃底静脉曲张患者发生曲张静脉破裂出血的独立危险因素,而ALB、ALP是其保护因素,但因出血本身会造成血液浓缩影响上述指标水平,而本研究中出血组纳入的数据是出血后获得,因此以上述指标直接预测出血风险可能并不可靠,需要进一步经行前瞻性研究探索上述指标是否影响肝硬化并食管胃底静脉曲张的可能结局。对于APRI、GPR、FIB-5、S-index、AAR、GAPRI几种血清学组合模型的单因素变量分析得出出血组患者的S-index、GAPRI、GPR水平明显低于非出血组,且差异有统计学意义。本研究中APRI、AAR在两组之间差异无统计学意义,说明二者不具有预测食管胃底静脉曲张破裂出血的能力。Rockey等[16]的回顾性研究亦显示AAR、APRI对于出血原因是否为EVB所致不具有判断力。此外,Kraja等[17]研究也表明,AAR、APRI不具有预测肝硬化第1次食管胃底静脉曲张破裂出血的能力。但王帅等[18]的研究表明,APRI对食管胃底静脉曲张破裂出血有一定预测能力,且其与肝脏硬度值联合预测性能更高。这可能与研究中纳入的对象不同有关,本研究中纳入肝硬化并食管胃底静脉曲张患者并未单纯局限于病毒性肝炎后肝硬化患者,这说明APRI可能对病毒性肝炎后肝硬化EVB出血具有一定的预测能力,但对其他原因导致的肝硬化出现的EVB预测能力尚需进一步研究。最近的一项纳入了413个研究对象的回顾性研究提示在食管胃底静脉曲张破裂出血患者中,S-index显著高于无食管胃底静脉曲张破裂出血患者,但S-index预测EVB的能力较弱(AUC=0.56,OR=1.29)[19]。这与本研究的结果相悖,这可能与造成肝硬化的病因构成比相关,遗憾的是,本研究未收集造成患者肝硬化的病因。且本研究的样本量较小也可能影响研究结果。另外,尚缺乏PRI、GPR、FIB-5、GAPRI对肝硬化并食管胃静脉曲张破裂出血预测性能的相关报道。整体而言,关于包括APRI、PRI、GPR、FIB-5、S-index、AAR、GAPRI在内的非侵入性肝纤维化评分系统对食管胃底静脉曲张破裂出血预测性能研究的数据较为缺乏
总之,本研究结果提示,S-index、GAPRI、GPR水平较低的肝硬化并食管胃底静脉曲张患者可能易发生曲张静脉破裂出血,需引起临床医师的重视,而APRI、AAR值可能对曲张静脉是否发生破裂出血无影响。本研究还存在如下不足均可能影响研究结果:首先本研究为单中心回顾性研究,研究对象的纳入存在选择偏移,其次,本研究样本量较小,代表性欠佳,此外,本研究中涉及的几种肝纤维化评分模型可能对不同类型的肝硬化纤维化程度诊断灵敏性不一,本研究并未进一步探究上述指标在不同病因肝硬化导致的管胃底静脉曲张破裂出血出血组与非出血组间的差异。未来需进行多中心、大样本的研究来明确上述肝纤维化评估模型在两组之间的差异性。

