重症监护病房膈肌功能监测研究进展
王颖 王金荣
河北医科大学附属哈励逊国际和平医院重症医学科,衡水 053000
有创机械通气广泛应用于急慢性呼吸衰竭,但其引起的相关损伤,尤其是呼吸肌失用而导致的膈肌萎缩和功能障碍已成为重要问题,与脱机困难、机械通气时间延长、呼吸机相关并发症 (再插管、气管切开)和死亡有关[1-3]。目前已有多项床旁膈肌功能监测技术[4],如监测膈肌电活动 (electrical activity of the diaphragm,Edi)可以记录呼吸驱动的传输过程,超声检查可以直接观察膈肌运动,评估膈肌硬度和应变能力,以及正在研发的膈神经磁刺激技术,无需受试者配合便能够提供标准化测量,尤其适于ICU 配合不佳的患者。本综述将讨论与膈肌功能障碍相关的临床问题、膈肌功能监测的重要性以及最新研究进展。
1 膈肌功能生理学意义与监测方法
膈肌位于胸腹腔之间,吸气时膈肌下移,呼气时膈肌上升至原来位置,因膈肌收缩而增加的胸腔容积约占一次通气量的4/5,是最重要的吸气肌,但无法直接检查 (图1)。因此,除了研究目的外,近年来临床实践中很少进行膈肌功能监测。然而,随着膈肌超声和专用食管导管记录Edi等技术的出现,情况发生了变化。在介绍这些技术之前,首先讨论膈肌功能的含义和诊断膈肌功能障碍的参考方法。

图1 膈肌解剖示意图[5] A:胸壁、膈肌和膈神经示意图;B:膈神经与周围组织解剖毗邻关系示意图
1.1 膈肌增压能力 膈肌的生理功能是缩短和产生牵引力,虽然这个力不能直接测量,但膈肌产生压力的能力是可以测量的。当膈肌收缩时下降到腹部,同时增加腹腔压和降低胸腔压,产生跨膈压 (transdiaphragmatic pressure,Pdi)。最大Pdi,即用力吸气所产生的Pdi,是评估膈肌功能最符合生理的方法。然而,由于镇静或谵妄导致ICU 患者缺乏合作能力,通常不能产生最大吸气努力。为了克服这一问题,Watson等[6]通过监测膈肌对双侧膈神经磁刺激的反应代表Pdi(颤搐性Pdi)。因膈肌仅受膈神经支配,通过刺激膈神经可以达到检测膈肌功能的目的,刺激双侧膈神经产生的颤搐性Pdi被认为是评估膈肌收缩力的最好指标 (图2)。虽然颤搐性Pdi对磁刺激的反应不能代替最大Pdi,但优点是无需受试者配合做努力吸气动作,便能够提供标准化测量,尤其适用于ICU 等主观检查配合不佳的患者。颤搐性Pdi<-11 cm H2O (1 cm H2O=0.098 kPa)定义为膈肌功能障碍[5]。
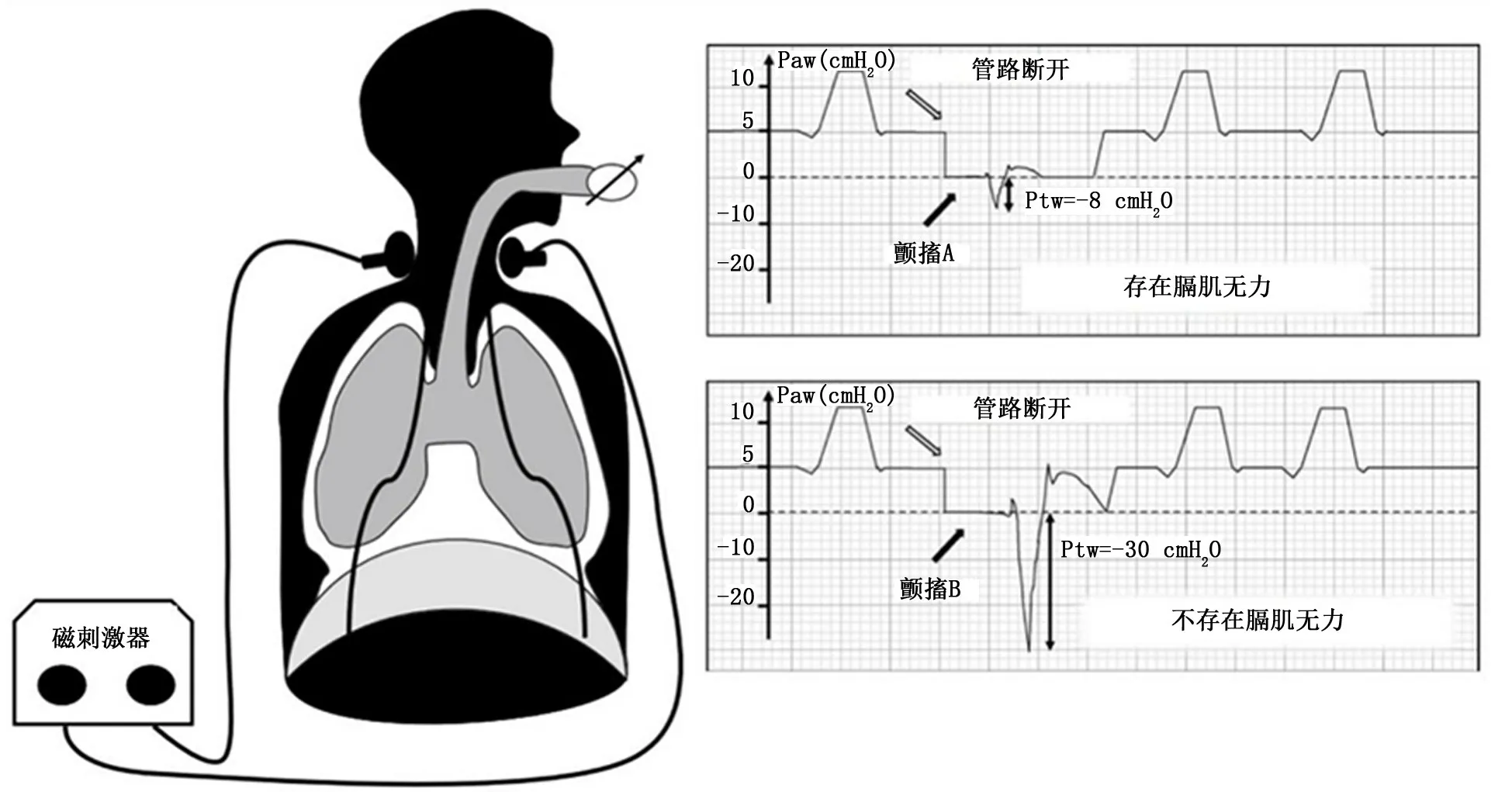
图2 压力支持通气患者应用膈神经刺激技术示意图[6]
1.2 膈肌超声检查 过去10年,膈肌超声在ICU 中应用越来越多,已经有数项针对成人和儿童的研究发表[7-9]。当膈肌收缩时,它会缩短、变厚、移位和变硬。超声可以测量膈肌厚度、增厚和移动度 (图3)。由于可行性的原因,膈肌超声主要经剑突下和肋间2个切面,选择右侧膈肌更容易获得数据。剑突下切面显示右侧膈肌边缘位移,位移测量值在观察者内和观察者间一致性较好。最大吸气量时,女性正常下限值>3.6 cm,男性>4.7 cm[11]。在健康患者中,膈肌位移与产生压力能力的指标之间存在中度相关性[12]。而在机械通气患者中,膈肌位移与产生压力的指标(跨膈压的压力-时间乘积、Pdi、颤搐压)相关性较差,但与脱机成功呈正相关 (位移越大,成功率越高)。
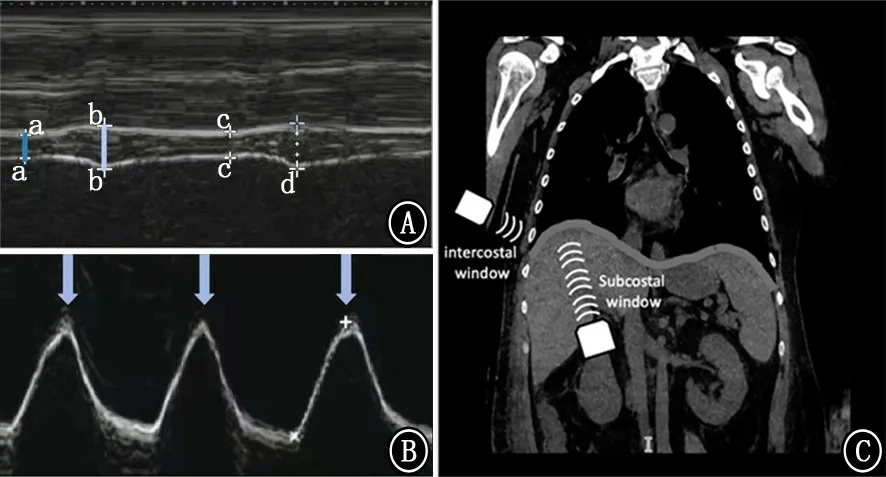
图3 经剑突下和肋间切面进行膈肌超声扫描[5,10] A:肋间切面测量吸气末 (a和c)和呼气末 (b和d)膈肌厚度;B:剑突下切面测量膈肌位移 (箭头示);C:超声探头扫查示意图
相比之下,膈肌厚度与产生压力能力或脱机结果均未发现有显著相关性[10]。膈肌超声检测到膈肌厚度减少,提示膈肌萎缩,但也有报道称膈肌厚度会增加,考虑与呼吸过度用力有关[2],尽管这一观察的意义尚不清楚。最近,肌萎缩性脊髓侧索硬化症患者组织学上的膈肌萎缩症与肺功能之间的关系, 得到了引人注目的结果。Guimarães-Costa等[13]未能证明压力产生能力的指标与膈肌萎缩的严重程度之间有任何显著关系。这些发现表明,萎缩只是膈肌功能障碍的标志之一。
吸气和呼气之间膈肌厚度的变化可以计算增厚分数,定义为吸气末和呼气末膈肌厚度差与呼气末膈肌厚度的比值,以百分比表示 (图3)。测量膈肌增厚分数比测量厚度重复性要差。增厚分数与膈肌功能之间存在中度但非线性相关,实际上膈肌收缩是由肌肉主动牵拉引起的的三维位移[4],因此,膈肌增厚分数与产生压力能力的指标之间仅为中等相关,范围从健康患者的r2=0.32[14]到机械通气患者的r=0.87[15]。这一广泛的范围表明,膈肌增厚分数在量化膈肌努力方面作用有限。值得注意的是,最近一项研究中,增厚分数评估膈肌力量的有效性受到了质疑,健康患者在逐步增加吸气负荷的情况下,从0到最大吸气压力的50%,增厚分数保持不变[16]。作者解释本研究操作者内部可重复性系数低,可能是增厚分数缺乏变化的原因。
在ICU 应尽可能在最低通气条件下测量膈肌增厚分数(和膈肌位移),理想情况下将持续气道正压设为零或通过T 管测量,以避免低估膈肌增厚分数和位移。机械通气患者的膈肌增厚分数低于29%与膈肌功能障碍有关,预测脱机成功 (自主呼吸试验成功和/或拔管成功)的截断值为25%~35%[7,17-19]。膈肌超声和膈神经刺激进行比较发现,2种方法都能准确预测脱机结果[17]。然而各研究结果并不一致,一项针对45例接受自主呼吸试验患者的研究发现,膈肌增厚分数无法预测脱机失败[20]。相比之下,其他作者发现在脱机试验失败的患者中,膈肌增厚分数较低[7]。另一项研究纳入了脱机试验成功的患者,结果显示拔管成功与未成功的患者在膈肌增厚或膈肌位移方面差异无统计学意义[21]。总之,这些发现强调了在脱机期间标准化使用膈肌超声的重要性。这个使用标准需要考虑测量时间 (脱机之前或试验期间)、目标人群 (脱机失败风险最高的)、呼吸机模式 (非辅助通气可以优先)和参数 (潮气量或最大吸气努力,取决于患者合作水平)。有作者建议将超声参数与呼吸模式结合起来,Spadaro等[22]观察到,在预测脱机结果时,膈肌位移与呼吸频率之比优于呼吸浅快指数、膈肌位移和最大吸气压。其他作者试图评估辅助/控制模式和自主呼吸试验之间的位移时间指数 (膈肌位移和吸气时间的乘积)的变化,以预测拔管结局。辅助控制模式和自主呼吸试验之间的位移时间指数下降幅度小于3.8%,预测拔管成功的灵敏度为79.2%,特异度为75%[22-23]。
另一项研究中,对慢性阻塞性肺疾病急性加重的患者使用急诊膈肌超声评估膈肌功能,预测无创通气失败的风险。膈肌增厚分数小于20%,无创通气失败的可能性更大(风险比=4.4,P<0.001),且与入住ICU、住院期间及90 d病死率显著相关,膈肌增厚分数与Pdi相关性好 (r=0.81,P=0.004)。膈肌增厚分数小于20%,在预测无创通气失败方面 (曲线下面积为0.84),比基线p H 值和无创通气早期p H 值和PaCO2变化更有优势[24]。
除了经典的超声衍生指标外,膈肌的纵向缩短 (应变)也可以通过斑点跟踪来测量[16],膈肌硬度可以通过剪切波弹性成像来测量[25]。在骨骼肌中,应变和等距收缩之间存在中到强的相关性[26]。应变与Pdi也有很强的相关性(r2=0.72,P<0.000 1)[16]。剪切波弹性成像是一种超声成像技术,无创测量剪切波速在目标组织中的传播,剪切波速与硬度指数 (剪切模量)直接相关[27]。由于肌肉剪切模量与活动肌力之间存在较强的线性关系,超声剪切波弹性成像提供了个体肌力变化的指标。在健康患者中,次最大吸气时口腔压和膈肌剪切模量之间存在很强的相关性 (r2>0.95)[25],在封闭气道等容吸气 (r=0.82)和吸气负荷通气 (r=0.70)时,Pdi和剪切模量之间均有很强的相关性[27]。膈肌应变和剪切模量在评估膈肌功能方面能够提供额外信息,但在ICU 患者中的研究尚未报道。
1.3 Edi Edi可以通过皮肤表面肌电图或食管多电极阵列来测量。表面肌电监测膈肌功能的主要优点是连续、无创的,但经常受到心电图或邻近肌肉活动的影响,受电源和电磁干扰。通过专用的鼻导管、食管多电极阵列可以方便地记录Edi,允许连续监测Edi[28-29](图4)。然而,Edi值很难解释,因为关于 “正常”值的数据非常有限。最近一项研究报告了健康患者在自主呼吸时,Edi峰值中位数范围较大 (5~30μV),但通常在15μV 左右[30]。

图4 心源性休克对Pdi和Edi的影响[29]
Edi可与呼吸模式相结合,以评估驱动 (Edi)转化为压力或潮气量 (tidal volume,VT)(神经机械耦联)的过程。Edi和Pdi之间有很强的相关性,尤其是在呼气末关闭期,这表明神经机械效率比 (ΔPdi/ΔEdi)可以用于评估吸气努力[31]。然而,神经机械效率比测量的可重复性最近受到了质疑,因为这些结果显示出明显的受试者间异质性[32]。这种较差的可重复性可能是主要限制,临床医师必须从中选择异质性最小的方法,来估计Edi的吸气肌肉力量[32]。
通过计算神经通气效率指数 (VT/Edi),也可以研究Edi向VT 的转化。VT/Edi比值可在早期预测自主呼吸试验通过与否。最后,人机呼吸贡献指数可以用来确定在总吸气VT 中患者和呼吸机各自的贡献,计算方法是无辅助通气时 (无压力支持)吸气VT/Edi比值与辅助通气 (有压力支持)时吸气VT/Edi比值进行除法计算。人机呼吸贡献指数越高,说明患者的贡献越大。不过使用此方法测得人机呼吸贡献指数的可靠性仍然很差,但使用辅助呼吸和非辅助呼吸的Edi匹配算法 (选择Edi相似的辅助呼吸和非辅助呼吸)后,可靠性显著提高[33]。
2 膈肌功能监测的重要性
2.1 膈肌功能障碍临床常见 Levine等[34]发表具有里程碑意义的一项研究,对14 例脑死亡患者 (膈肌无自主活动)进行膈肌活检发现,机械通气18~69 h后,膈肌纤维迅速萎缩,与膈肌蛋白水解增加相关。这一研究结果与动物试验及最新的超声研究结果一致,机械通气诱发的膈肌失用与膈肌萎缩和功能障碍有关[35]。除此之外,ICU 患者膈肌功能障碍还有其他几个危险因素 (如脓毒症、严重疾病),目前很难确定机械通气对膈肌功能障碍发生发展的具体贡献。另外ICU 膈肌功能障碍的发病率也非常高,脱机期间或病情稳定后获得的数据表明,发病率为23%~84%,超过2/3的机械通气患者在首次尝试脱机时就被诊断存在膈肌功能障碍[29]。
2.2 膈肌功能障碍与不良预后相关 首先,由于膈肌是平衡呼吸负荷/功能的主要决定因素,膈肌功能障碍可能会增加脱机失败的风险,进而延长机械通气时间。重要的是,膈肌功能是决定自主呼吸试验成败的主要因素,而不是决定能否拔管。其次,膈肌功能障碍与再次气管插管、气管切开、延长通气时间、术后并发症等有关,与ICU 病死率也密切相关[29,36-37]。以最大吸气压 (高值组>30 cm H2O,低值组≤30 cm H2O)为主要观察指标评估机械通气患者膈肌功能,2组1年病死率分别为7%和31%,校正后发现最大吸气压与1年病死率独立相关 (风险比4.41,95%CI:1.5~12.9,P=0.007)[38]。使用双颈前膈神经磁刺激技术评估膈肌功能发现,与非存活者相比,ICU 存活者颤搐刺激后气道压更高 (分别为9.7 cm H2O 和7.3 cm H2O,P=0.004)[39]。
2.3 膈肌-呼吸机交互作用 某些情况下,患者可能存在呼吸机抵抗,产生人-机不同步,可能与不适、呼吸困难和预后不良有关。对于临床医师来说,识别不同步并非易事。虽然可以根据气道压、容积和流速波形大体鉴别,但不够可靠和敏感。Soilemezi等[40]使用食道导管将胸膜压与气道压、流速波形变化之间的不匹配进行可视化,发现膈肌收缩在胸膜压变化中起着至关重要的作用,提示在关注呼吸模式的同时,监测膈肌功能有助于发现人-机不同步。
3 膈肌功能监测的适应证
考虑到辅助通气过度增加膈肌功能障碍的风险,辅助通气不足会加重肺损伤[41],膈肌功能监测旨在根据患者需求,呼吸机提供合适的辅助水平。已经提出一些保护肺部和减轻膈肌功能失用的策略,但需要临床验证后才能推广[42]。特别是,超声可与气道或食道压一起监测膈肌功能,以评估人-机同步性[40]。首先,接受深度镇静或神经肌肉阻断剂治疗的急性呼吸窘迫综合征患者,超声监测膈肌功能,可以发现隐匿不同步,但还需要不断改进技术,才能纳入临床决策系统。另外,在出现脱机困难和延迟的患者中,膈肌监测可能特别有用,可以帮助诊断可能影响脱机的膈肌功能障碍,它可以预测拔管失败,以实施适当的预防策略[10]。最后,对于需要延长脱机的患者,膈肌功能监测可用来评估吸气努力,以滴定呼吸机辅助水平。但这项技术应用于日常临床实践之前,需要得知吸气努力的正常范围。
4 结论
ICU 监测膈肌功能可以帮助医师更清楚地了解患者人-机之间的交互作用,参与呼吸机的设置决策过程,预测脱机失败和诊断膈肌功能障碍,对脱机困难和延迟者非常有用。ICU 未来膈肌监测的研究必须注重膈肌功能标志物与超声衍生指标、电活动之间的相关性,临床测量的重复性也必须得到改善,机械通气患者膈肌超声和电活动相关指南也应标准化。
利益冲突所有作者均声明不存在利益冲突

