催芽对生姜根茎细菌群落结构的影响
唐 婧,唐 明,孙媛媛,何馨竹,黄 科
(1. 贵州师范大学生命科学学院/贵州省植物生理与发育重点实验室,贵阳550001;2. 重庆文理学院园林与生命科学学院,重庆402160)
生姜(Zingiber officinale)是一种兼作蔬菜和药用植物的经济作物。生姜在我国山东、四川、重庆、贵州等地都有规模化、产业化种植栽培,是当地姜农主要收入来源。而生姜在种植上存在严重的土传姜瘟病,对产量影响十分严重,会造成姜农重大经济损失[1]。因此,研究提高生姜长势、抗性和产量对于生姜产业具有不可替代的重要作用及意义。催芽是生姜栽培管理技术中极其重要的一环,生姜催芽直接影响后续生姜长势状态,催生壮芽可以提高生姜产量20% 以上[2]。生姜催芽过程,生姜根茎的健康生长,新生芽强壮,是生姜后续栽培繁育的基础阶段,故需要从多角度提高和完善对生姜催生壮芽的认识。
植物微生物组与植物生长发育健康密切相关,地下根系微生物组在植物生长发育过程中更是不可忽视的重要部分[3],其一般分为根际、根表面和根内部3 个生态位[4]。有时,也将根表面和根内部微生物一起称为植物根内微生物。与根际微生物群落相比,根内微生物群落同样受地下生物和非生物因子的调控[5],但是根内微生物更有利于保护植物抵抗胁迫[6],且其组成与根际及外周土壤微生物组的组成及多样性差别巨大[7-8]。同时,现在研究认为,根内微生物群落极可能不是由根际微生物偶然入侵定殖形成的,而是由宿主植物自身的不同生理调节机制影响的[9-11]。植物根系微生物组与植物生长发育密切有关,可以参与调控植物生长与开花[12]、抗逆[13]、营养元素利用[14]等。而生姜催芽作为姜栽培繁育的基础,其根茎内部微生物组对于后续生姜生长发育具有不可替代的重要作用,但是对于这一部分的研究目前较少。因此,本研究通过高通量测序获取并分析健康生姜催芽过程中生姜根茎细菌群落的组成及变化,以期为生姜催生壮芽及后续生姜病害防治提供较为丰富的微生物群落理论依据。
1 材料与方法
1.1 样品采集
选择无病斑、无软症状的健康强壮生姜根茎块,用无菌蒸馏水清洗干净,然后用75% 乙醇表面消毒5min,再用无菌蒸馏水漂洗,无菌通风橱风干。然后,在25℃和75% 相对湿度的无菌基质中催芽培养。在培养0,15,30d时,各时间点分别采集15个样本,将其随机分为3组,每组5株样本。催芽15d,新发不定壮芽开始出现;催芽30d,壮芽形成,不定根生长。
1.2 宏基因组的提取
称取每组5 株生姜根茎各20g 混合,剪碎,用差速离心法收集菌群,再按OMEGA 细菌DNA 提取试剂盒D3350-01 试剂盒提取DNA。Bio-Tek 微孔板分光光度法测定宏基因组DNA 浓度和质量,然后-80°C 冰箱冻存DNA。
1.3 高通量测序及分类注释
提取宏基因组DNA 为模板,PCR 扩增16S rRNA 基因V3~V4区序列(341F: CCTAYGGGRBGCASCAG, 806R:GGACTACNNGGGTATCTAAT)[15]在美吉生物公司Illumina PE300测序平台测序。下机序列在QIIME 上分析,将相似性≥97% 的序列聚类成OTUs(operational taxonomic units)[16]。用RDP[17]算法基于Greengene 数据库(http://greengenes.secondgenome.com/)对16S rRNA细菌OTUs进行分类注释。
1.4 统计分析
在QIIME2 上基于OTUs 分类注释结果,计算生姜根茎细菌群落α-多样性[Shannon 指数、Simpson 指数、Chao1 指数、ACE 指数以及PD_whole_tree(phylogenetic diversity whole tree)],wilcox 检验α-多样性差异。基于Bray-Curtis 距离使用R 的vegan、ggplots 等进行PCoA(principal co-ordinates analysis 和置换多元方差分析(PERMANOVA)检验分析生姜催芽过程中细菌群落结构的差异[18]。使用R Deseq2中的LRT(log likelihood ratio)检验分析生姜催芽过程中细菌种群OTUs 丰度的差异[19]。基于WGCNA 的Pearson 相关系数构建细菌菌群的互作网络[20],然后利用Kendall相关系数分析生姜根系细菌种群与生姜催芽生长阶段之间相关性。根据细菌种群两两间的Pearson 相关系数以及Benjamini and Hochberg false discovery rate(FDR)矫正p值[21],筛选菌群间极显著相关关系(p<0.01),借助Cytoscape软件可视化细菌共存网络,进一步探究细菌群落的相互关系[22]。两两之间正相关代表两个细菌种群之间具有互利共增关系,而负相关则代表其之间存在竞争抑制关系。
2 结果与分析
2.1 稀释曲线
高通量测定催芽0,15,30d 后生姜根茎中细菌群落16S rRNA 基因V3~V4 区序列,平均序列数(clean reads)是(78711±3791)(Mean±SD),且3 个时期序列数量无显著性差异。序列按相似性≥97% 进行OTUs 聚类,利用OTUs数目与测序序列数量作稀释曲线,结果如图1。本研究对生姜根茎细菌群落测序深度能较好覆盖样品中绝大多数的微生物物种,满足后续研究需要。

图1 细菌群落16S rRNA V3~V4区稀释曲线Figure 1 Rarefaction curve of 16S rRNA V3-V4
2.2 催芽对生姜根茎细菌群落的影响
2.2.1 催芽对生姜根茎细菌群落多样性的影响 由表1可知,生姜根茎催芽15d和30d时,细菌群落α-多样性出现显著性上升,说明随着催芽时间的增加,生姜根茎的细菌群落丰富度和均匀度显著的升高;同时在30d时,细菌群落谱系多样性出现显著升高。
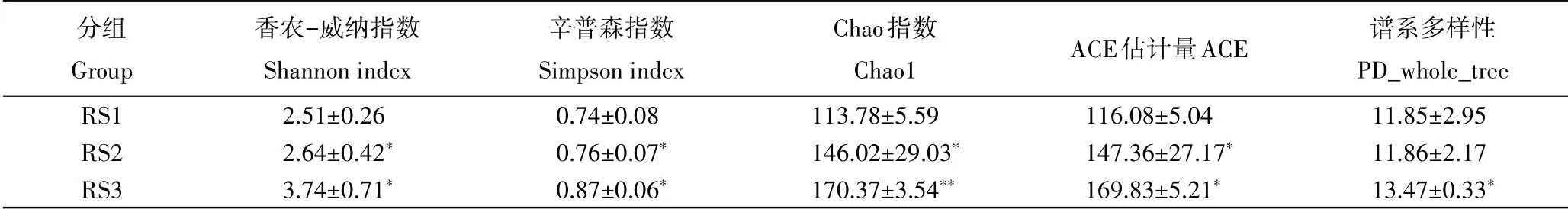
表1 生姜根茎催芽过程细菌群落α-多样性指数Table 1 The rhizome-bacterial α-diversity of Zingiber officinale in the germination process
进一步分析探讨催芽对生姜根茎细菌群落组成的差异,本研究以Bray-Curtis 距离进行主坐标分析(principal co-ordinates analysis, PCoA)(图2)。结果发现,催芽0,15,30d后,根茎细菌群落组成存在显著分离。进一步利用PERMANOVA检验分析,也发现催芽后根茎细菌群落组成呈极显著性差异(R2=0.426,p<0.01)。
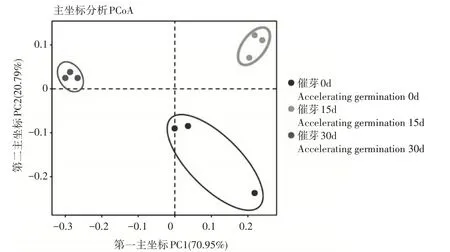
图2 主坐标分析催芽0,15,30d后生姜根茎微生物群落组成差异Figure 2 The PCoA of bacterial community between 0,15,30d group
2.2.2 催芽对生姜根茎细菌种群的影响 分析高通量测定催芽0,15,30d后生姜根茎中细菌群落16S V3~V4区序列,结果共聚类得出276个OTUs,整个催芽过程生姜根茎中共存有115个OTUs,0d和15d都存有29个单独存在的OTUs,而在30d 时有45 个OTUs 单独存在(图3a)。催芽30d 后,生姜根茎内单独富集的细菌种群数量最高,占全部OTUs 的16.3%;且催芽15~30d,生姜根茎内新富集31.1% 的OTUs。这一结果再次表明,在催芽后,生姜根茎内细菌种群数量增加,出芽后的生姜根茎内新富集到三分之一细菌种群。催芽过程中,持续存在的115 个OTUs 中,有36 个OTUs 相对多度发生显著变化(图3b)。其中,只有3 个OTUs 的相对多度在催芽后,15d 和30d 都持续显著下降;相对的有9 个OTUs 的相对多度持续显著上升。催芽0~30d,生姜根茎中大量细菌种群发生变化,且超过三分之一的OTUs 属于厚壁菌门(Firmicutes,43.1%),然后是变形菌门(Proteobacteria,25.9%)和 拟 杆 菌 门(Bacteroidetes,20.3%)。
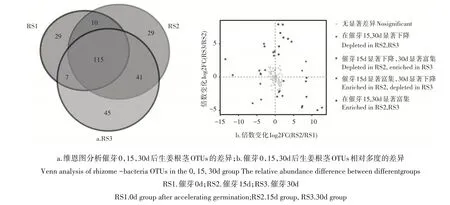
图3 催芽0,15,30d后生姜根茎细菌OTUs变化Figure 3 The composition difference of bacterial community between 0,15,30d groups
生姜催芽生长过程中,生姜根茎内有一部分细菌门的相对多度发生显著变化。生姜根茎内细菌菌群分布于10 种门,其中4 种门平均相对多度>1%,且它们的相对多度在催芽生长过程中变化显著(图4)。在催芽开始时,生姜根茎内优势菌群是Firmicutes(77.20±0.07)%, 蓝细菌门Cyanobacteria(14.63±0.01)%和Proteobacteria(8.01±0.06)%。而当生长到15d 时,Proteobacteria(92.98±0.08)%相对多度出现强烈升高,而Firmicutes(5.68±0.08)%和Cyanobacteria(0.83±0.002)%相对多度却发生显著性降低。催芽30d 后,Firmicutes(44.73±0.11)%和Cyanobacteria(1.63±0.01)%的相对多度又发生显著性升高,而Proteobacteria(43.21±0.08)%相对多度却显著下降;同时,拟杆菌门(Bacteroidetes)相对多度出现显著升高至(9.91±0.04)%。
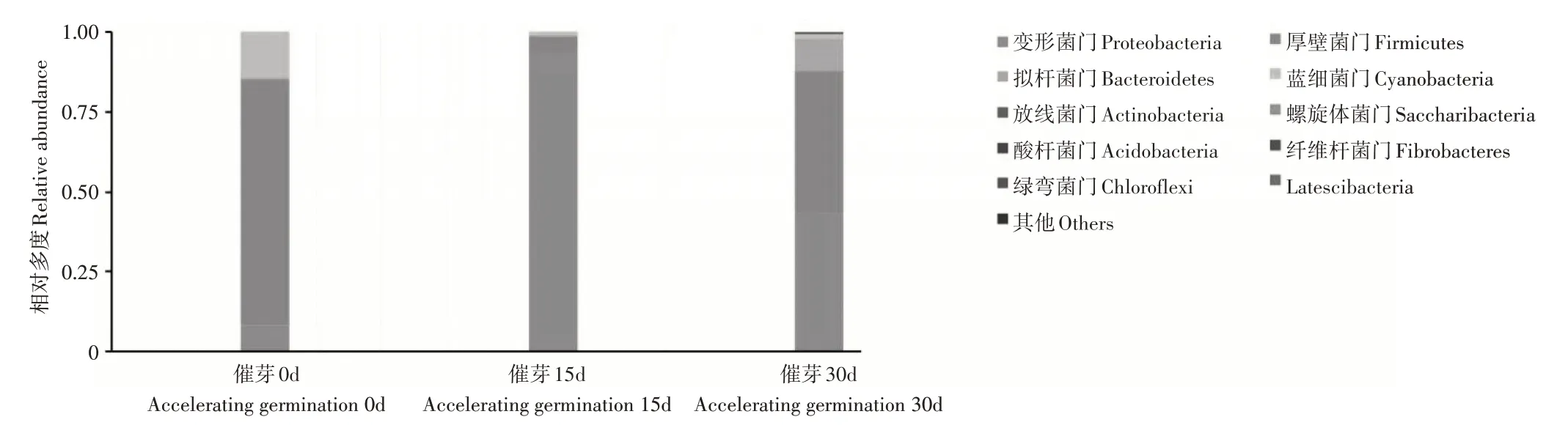
图4 催芽生长过程生姜根茎内10个细菌门相对多度Figure 4 The relative abundance of 10 phyla in the rhizome of Ginger affected by accelerating germination
2.3 催芽影响的根茎细菌网络
通过对高通量测序数据分析,结果发现在催芽生姜根茎中共含有10种门112种属的细菌种群。为进一步分析这些细菌属与生姜催芽生长之间的关系,利用Kendall相关系数分析,结果发现,生姜根茎的112种细菌属中有39 种属与生姜催芽生长密切相关(r>0.6,p<0.05)(图5)。39 种细菌属分别属于Proteobacteria,Firmicutes,Bacteroidetes 和放线菌门(Actinobacteria)4个门。基于两两细菌属间的Pearson 相关系数,进一步分析与生姜根茎催芽生长密切相关的39种细菌属之间的互作网络。由图5可知,与生姜催芽密切相关的39种细菌属构成两个互作网络:一个是28个节点353条互作边的高度紧密网络,且28个节点细菌丰度随着生姜催芽生长增高;另外一个是11个节点18条互作边的网络,且其中Ruminococcaceae,Christensenellaceae,假单胞菌属(Pseudomonas)和Ruminiclostridium丰度随着催芽生长下降。整个互作网络中,只有Ruminococcaceae与Mycobacterium(分枝杆菌属)、Pseudomonas与Coprococcus、Ruminococcaceae与Devosia(德沃斯氏菌属)3条负相关关系。
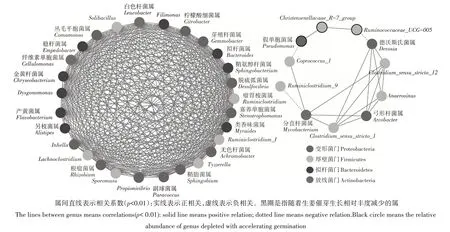
图5 催芽相关的生姜根茎细菌互作网络Figure 5 Correlation network analysis of rhizome bacteria by after accelerating germination
通过网络互作分析发现,有两个细菌网络与生姜催芽生长密切相关。其中,一个是另枝菌属(Alistipes),拟杆菌属(Bacteroides),柠檬酸杆菌属(Citrobacter),脱硫弧菌属(Desulfovibrio)等28 个细菌属构成一个高密度的稳定细菌互利共生网络,它们相互共生逐步富集于生姜催芽生长的根茎内;另一个共生竞争的互作网络中,Ruminococcaceae、Christensenellaceae、Pseudomonas和Ruminiclostridium极可能会受Devosia、Coprococcus和Mycobacterium等细菌种群所抑制,在生姜催芽生长的过程中,它们在生姜根茎内丰度逐步降低。
3 讨论与结论
植物根系微生物组参与植物生长的众多过程,与植物生长发育密切相关,有研究发现根内微生物参与促进植物生长发育、促进植物激素产生提高植物免疫力,促进植物氮、磷、钾等营养元素的获取[23-25]。在拟南芥根内微生物组形成中,有40% 的根内微生物是根系周边土壤微生物进入,剩余60% 则是宿主植物自身选择[26]。还有研究发现,多年生黄花亭荠根内细菌15% 的群落变异性由外周土壤决定,而外界环境和植物本身解释11% 的群落变异[27]。本研究通过高通量测序分析了生姜催芽后,根茎出芽生长0,15,30d 后根茎细菌群落结构。结果表明,在不接触土壤环境下,生姜根茎微生物群落结构及多样性与生姜催芽生长密切相关。随着生姜催芽生长,根内微生物多样性表现出显著性的升高。本研究进一步支持了植物根内微生物组群落与植物生长发育本身也具有密切关系,除土壤这一主要因素外,环境及植物生长本身也是根内微生物群落变化的另一重要因素。且在生姜根茎催芽生长的过程中,根茎微生物群落α-多样性显著升高,表明生姜根茎催芽生长过程中,有微生物定植于生姜根茎内,导致根茎微生物的种群丰富度和均一度增加。
本研究发现,在生姜根茎内优势细菌门为:Proteobacteria、Firmicutes、Cyanobacteria和Bacteroidetes。Proteobacteria 和Firmicutes 是植物根内主要优势菌群[28],但是不同植物根内微生物组成结构组成不同都有一定不同。植物根系代谢物与植物根系微生物的组成及功能密切相关[29],而生姜根茎内具有大量不同于马铃薯和拟兰芥的代谢产物。本研究发现,在生姜催芽生长过程中,催芽开始生长到15d时,Firmicutes 和Cyanobacteria 的相对多度显著性降低。而当催芽30d后,Firmicutes 和Cyanobacteria 的相对多度又发生显著性上升。推测认为这与Firmicutes 和Cyanobacteria具有还原硝酸盐和固碳的生物功能具有密切关系,它们对于生姜催芽生长时期的碳氮固定具有十分重要的意义[30-31],且现有研究也表明,植物根系分泌物也为根系微生物的生长提供丰富的碳源及营养[32]。同时宏基因组分析研究也表明植物生长发育根系微生物参与碳水化合物代谢和运输的基因变化显著[28]。
大量研究表明,植物根系的生长发育与植物根系微生物组密切相关。例如,水稻根系微生物组与水稻根系发育生长时间密切相关[30]。本研究发现,德沃斯氏菌属(Devosia)、纤维单孢菌属(Cellulomonas)、分枝杆菌属(Mycobacterium)、单胞菌属(Stenotrophomonas)、香味菌属(Myroides)、Leucobacter、根瘤菌属(Rhizobium)、瘤胃梭菌属(Ruminiclostridium)、Tyzzerella、Ruminiclostridium_9、假单胞菌属(Pseudomonas)、Ruminococcaceae、Alistipes等39种属细菌与生姜根茎催芽生长密切相关。Ruminococcaceae、Ruminiclostridium[33]和Cellulomonas[34]都能够产生多种纤维素酶,参与纤维素降解。Devosia属的物种有能力与植物共生以固定氮[35]。Sphingobacterium属中菌群分离于玉米根系,对于玉米生长具有明显促进作用[36]。Stenotrophomonas与植物生长和健康密切相关,且有利于植物[37]。植物生长过程中可以通过调节根系代谢物的成分选择或者激活某些根内有益菌的生长富集[38]。在生姜根茎催芽生长的过程中,Sphingobacterium属等植物根系有益菌也出明显富集现象,同时,细菌种群丰富与均匀度发生显著增加。生姜根茎内细菌表现出一种“复苏”和“增殖”的状态,积极响应生姜的生长。但是具体相关调控机制仍旧不清楚,需进一步研究。
综上所述,生姜根茎细菌群落与生姜催芽生长密切相关,对于生姜的健康生长也具有密不可分的作用;因此,需要详细研究根茎细菌群落与生姜发育生长代谢之间的关系,挖掘获取其中参与调控生姜生长发育的关键有益细菌种群,这为后续提高生姜绿色健康栽培生产提供理论依据。

