血浆copeptin、IGF-1 水平对动脉瘤性蛛网膜下腔出血患者预后的评估价值
吴高远,倪永丰,钱洪波,潘捷,殷骏,吴问亮
安庆市第一人民医院神经外科,安徽安庆246000
动脉瘤性蛛网膜下腔出血(aSAH)是蛛网膜下腔出血中最常见的类型,约占蛛网膜下腔出血总数的85%,多数aSAH 合并严重并发症,具有极高的致死率,10%~25%患者死于住院前,即便存活亦常遗留残疾[1]。aSAH 预后受神经损伤程度、血流动力学、脑血管稳态、血脑屏障是否完好、神经元恢复等多种因素影响。和肽素(copeptin)是内源性应激标志物,具有调节渗透压、血流动力学、体液稳态等作用。copeptin 在体内分布稳定,对心脑血管疾病诊断、病情评估有较高价值[2]。胰岛素样生长因子-1(IGF-1)是生长激素关键调节因子,具有维持神经元存活和轴突生长功能,在神经内分泌调节中发挥重要作用。IGF-1 缺乏可能参与脑出血后垂体功能障碍进程[3]。本研究拟探讨copeptin、IGF-1在aSAH 预后预测中的价值,以期为临床aSAH 患者风险评估、预后判断提供参考。
1 资料与方法
1.1 临床资料 选择 2018 年 1 月—2020 年 1 月我院神经外科收治的142例aSAH 患者。纳入标准:①剧烈头痛、脑膜刺激征阳性,颅脑CT 和MRI 提示与动脉瘤相关的出血灶;②符合2015 版《中国蛛网膜下腔出血诊治指南》中的诊断标准[4];③首次诊断aSAH,既往无脑出血病史。排除标准:①颅脑外伤、高血压导致的脑出血;②烟雾病、动静脉畸形、假性动脉瘤;③入院48 h 内死亡患者或发生脑疝患者。本研究获得我院伦理委员会批准,入组前均告知患者或其家属本研究目的和内容,均表示同意,签署同意书,研究期间严格遵循伦理学原则,保障患者隐私和安全。
1.2 临床资料收集 收集患者性别、年龄、体质量指数、吸烟史、饮酒史、基础疾病、血压、动脉瘤直径、Hunt-Hess 分级[5]、改良 Fisher 分级[6]、世界神经外科医师联盟委员会的蛛网膜下腔出血(WFNS)分级[7]、治疗方式、机械通气、有无瞳孔扩张、并发症等信息。
1.3 血浆copeptin、IGF-1检测 所有患者入组后24~48 h采集清晨静脉血5 mL,经离心(4 ℃,3 000 r/min离心15 min,离心半径10 cm)后取血浆保存于-80 ℃超低温冰箱(Thermo Fisher 公司)待检。取出样品快速解冻血浆样品,ALISEI 全自动酶标仪(意大利SEAC公司)采用酶联免疫吸附试验检测血浆copeptin、IGF-1,试剂盒购自武汉博士德生物工程有限公司。
1.4 随访 发病后3 个月采用改良Rankin 量表(mRS)评价患者预后情况,mRS 评分≤2 分为预后良好组 44 例,mRS 评分>2 分为预后不良组[8]98 例。
1.5 统计学方法 采用SPSS25.0 统计软件。计量资料符合正态分布以表示,组间比较采用t检验。计数资料、等级资料以率(%)表示,比较采用χ2检验。采用Logistic 逐步回归分析aSAH 患者预后的危险因素。应用受试者工作特征(ROC)曲线进行诊断效能分析,以曲线下面积(AUC)为主要判断指标。P<0.05为差异有统计学意义。
2 结果
2.1 两组临床资料比较 预后不良组年龄(67.19±6.34)岁,体质量指数(25.06 ± 3.03)kg/m2,收缩压(156.35± 8.34)mmHg,舒张压(76.33± 4.39)mmHg;预后良好组年龄(63.73 ± 6.73)岁,体质量指数(25.42 ± 3.11)kg/m2,收缩压(145.47 ± 6.92)mmHg,舒张压(75.42±4.02)mmHg。预后不良组年龄、收缩压高于预后良好组(P均<0.05),女性、合并糖尿病、机械通气、瞳孔扩张、保守治疗、WFNS 分级Ⅲ~Ⅳ级、Hunt-Hess 分级Ⅲ~Ⅴ级、改良Fisher 分级Ⅲ~Ⅳ级、迟发性脑缺血、脑出血、脑血管痉挛比例高于预后良好组(P均<0.05)。两组体质量指数、舒张压、吸烟史、饮酒史,合并高血压、高脂血症、冠心病以及动脉瘤直径比较均无统计学差异(P均>0.05),见表1。

表1 两组临床资料比较[例(%)]
2.2 不同预后患者血浆copeptin、IGF-1水平比较 预后不良组、预后良好组血浆copeptin 水平分别为(1.96 ± 0.35)、(0.85 ± 0.21)ng/mL,IGF-1 水平分别为(2.02 ± 0.21)、(3.51 ± 0.37)ng/mL,两组比较,P均<0.01。
2.3 影响aSAH 患者预后的多元Logistic 回归分析 以aSAH预后为因变量,以单因素分析中有统计学差异的变量为自变量:预后(Y):0=良好,1=不良;年龄(X1:1 为<65 岁,2 为≥65 岁)、性别(X2:1=男,2=女)、收缩压(X3:1为<150 mmHg,2为≥150 mmHg)、合并糖尿病(X4:1=否,2=是)、机械通气(X5:1=否,2=是)、瞳孔扩张(X6:1=否,2=是)、治疗方式(X7:1=血管介入/开颅动脉瘤夹闭术,2=保守治疗)、WFNS分级(X8:1=Ⅰ~Ⅱ级,2=Ⅲ~Ⅳ级)、Hunt-Hess分级(X9:1=Ⅰ~Ⅱ级,2=Ⅲ~Ⅴ级)、改良Fisher 分级Ⅲ~Ⅳ级(X10:1=Ⅰ~Ⅱ级,2=Ⅲ~Ⅳ级)、迟发性脑缺血(X11:1=否,2=是)、脑出血(X12:1=否,2=是)、脑血管痉挛(X13:1=否,2=是)。代入Logistic回归方程。结果显示,WFNS 分级Ⅲ~Ⅳ级、并发脑血管痉挛、高copeptin、低 IGF-1 是 aSAH 预后不良的危险因素(P均<0.01),见表2。进一步校正WFNS分级、脑血管痉挛后,copeptin(OR=1.625,95%CI:1.504~1.905,P<0.01)、IGF-1(OR=1.823,95%CI:1.653~2.035,P<0.01)与aSAH患者预后相关(P均<0.01)。
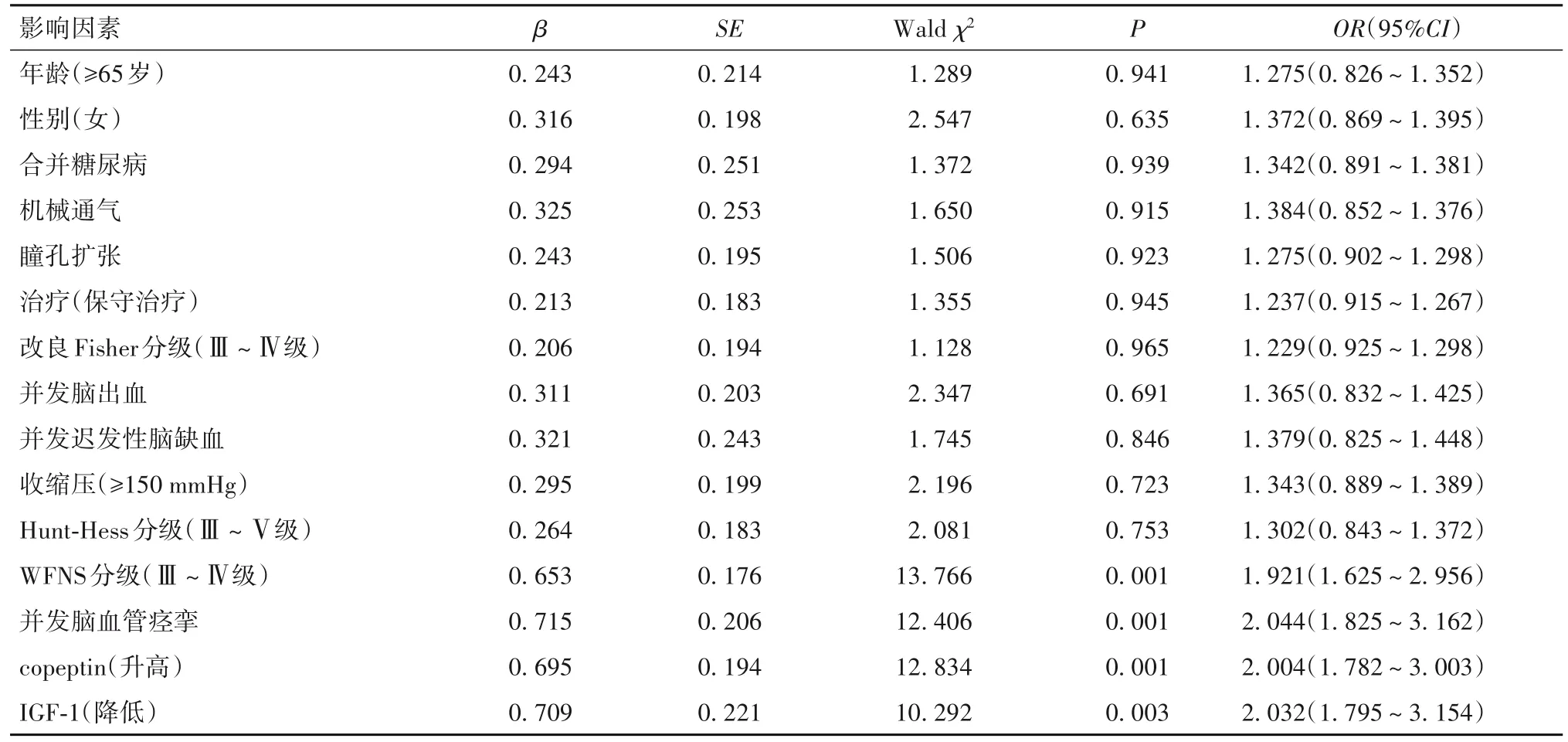
表2 影响aSAH预后的多元Logistic回归分析
2.4 血浆 copeptin、IGF-1 水平对 aSAH 患者预后预测的价值分析 ROC 曲线分析血浆copeptin、IGF-1水平预测aSAH 患者预后的AUC分别为0.739、0.770,copeptin、IGF-1 联合预测 aSAH 预后不良的AUC为 0.905,高于单独 copeptin、IGF-1(Z分别为2.536、2.264,P均<0.05)。血浆 copeptin、IGF-1 及二者联合预测aSAH 预后不良的最佳截断值、灵敏度、特异度、约登指数见表3。

表3 血浆copeptin、IGF-1水平预测aSAH患者预后的效能分析
3 讨论
aSAH是临床常见的出血性脑血管疾病,好发于女性,可能与激素水平有关。aSAH发病还与年龄有关,随着年龄增加其发病率呈增长趋势[1]。aSAH 对神经系统功能以及多个器官均产生严重影响。aSAH病因、发病机制复杂,临床症状不一,病情进展快,病死率高。评估aSAH 预后有助于早期发现危险因素,采取有效措施,降低患者病死率和神经功能恶化。WFNS评分、Hunt-Hess分级、改良Fisher分级易于临床医师掌握,但缺乏客观充足的影像学证据以及生物学指标,在aSAH 预后评估中存在一定局限性。因此,寻找与aSAH 预后密切相关的分子机制有重要意义。
copeptin 是精氨酸加压素(AVP)前体C-末端糖基化多肽,AVP 由垂体后叶释放,具有升高血压、收缩血管、抗利尿循环等作用,参与脑血管稳态维持。AVP 半衰期短,其临床应用受限,copeptin 具有和AVP 相同病理生理作用,比AVP 更稳定,逐渐成为AVP 的替代生物学指标。copeptin 已被证实与急性ST段抬高心肌梗死[9]、冠心病、冠脉病变严重程度[10]等密切相关。血浆copeptin 水平在脑梗死、颅内出血和蛛网膜下腔出血患者中明显升高,参与脑血管疾病患者神经受损、不良临床结局过程[2]。本研究发现,copeptin 水平与aSAH 患者发病3 个月后预后有关,高copeptin 水平预示更高的致残和死亡风险,说明copeptin 水平越高,神经受损越严重,预后越差。ZHENG等[11]认为,copeptin是aSAH患者临床结局强有力的预测因子,预测效能超过NSE、S100B 等神经损伤相关指标。copeptin 参与aSAH 预后的机制尚不明确,可能机制:aSAH后脑组织缺血缺氧,血流动力学异常,copeptin 作为神经内分泌应答的一部分生成增加,通过激活下丘脑—垂体—肾上腺轴促使肾上腺皮质激素释放,调节渗透压,维持血流动力学稳定[12]。
IGF-1 是一种分泌型小肽生长因子,参与机体生长、组织修复、碳水化合物、蛋白质和脂质代谢等多种生理和病理生理过程,与糖尿病、高血压等慢性疾病发病有关[13]。近期研究显示,约12.1%创伤性脑损伤和 aSAH 患者血浆 IGF-1 水平明显下降[14],提示IGF-1 缺失与aSAH 发病可能存在密切联系。IGF-1 是否能为aSAH 预后评估提供有效信息尚不清楚。本研究多因素分析结果显示,低IGF-1 水平是aSAH 患者发病3 个月后神经功能恶化的危险因素,说明IGF-1 缺失可能与aSAH 神经功能恶化和不良预后有关。IGF-1 参与aSAH 患者病情进展的机制:aSAH可导致垂体功能障碍,影响生长激素分泌,IGF-1 作为生长激素调节蛋白其表达也出现下降,IGF-1 活性降低影响神经元生长,促使神经细胞凋亡、坏死,导致神经退行性病变和神经功能的恶化[15]。IGF-1 缺乏可引起脑血管壁病理重塑,导致管壁肥厚,弹性降低,IGF-1 水平下降可能促进了脑出血的发生。动物研究显示,重组IGF-1 制剂可降低p-GSK3蛋白和促分裂原激活的蛋白激酶表达,增加紧密连接相关蛋白occludin 和claudin-5 表达,减少脑出血小鼠脑水肿,降低血脑屏障通透性,改善神经行为[16]。
本研究ROC 曲线分析结果显示,血浆copeptin、IGF-1 预测 aSAH 患者预后的AUC为 0.739、0.770,提示copeptin、IGF-1 可作为一种新的生物标志物评价aSAH患者预后。copeptin、IGF-1联合提高了预测aSAH患者预后不良的效能,说明copeptin升高、IGF-1降低的aSAH 患者发病3 个月内神经功能恶化的风险更大,对预后不良具有提示作用。本研究多因素回归分析结果显示,脑血管痉挛、WFNS 分级Ⅳ~Ⅴ级是aSAH 患者预后不良的危险因素之一,脑血管痉挛是aSAH 常见的严重并发症,是aSAH 患者致残和死亡的原因之一。WFNS 分级Ⅳ~Ⅴ级预示较高的延迟性脑缺血风险,是aSAH 术后72 h 延迟性脑缺血有效预测因子[17]。
综上所述,血浆copeptin、IGF-1 水平升高与aSAH 患者预后不良密切相关,可作为aSAH 预后评估的潜在生物学指标,copeptin、IGF-1联合检测可提高aSAH患者预后预测效能。

