茶菊病毒检测与脱除技术研究
吴 茜 蔡晓霖 管志勇 朱 波 易 利 郑永生 邓邦清 蒋甲福,*
(1 南京农业大学园艺学院/农业农村部景观设计重点实验室,江苏 南京 210095;2 麻城市菊花协会,湖北 麻城 438300)
菊花(ChrysanthemummorifoliumRamat.)为菊科菊属多年生宿根草本植物,原产于中国,栽培历史已达3 000多年,在古代亦被称为鞠、黄花、节花、金蕊、寿客等。菊花具有广泛的用途,除了有极高的观赏价值外,清香甘甜的茶用菊还具有较好的食用和药用价值[1]。近年来随着茶用菊产业的发展,各地茶用菊种植面积不断扩大,加之菊农长期分散留种、缺乏优选种株的习惯,长期扦插繁殖方式使感染的病毒在种株上不断积累,导致各地茶用菊出现了明显的品质劣变、产量降低等种性退化的现象,制约了茶用菊产业的发展。
目前世界上已报道的能够侵染菊花的(类)病毒大约有20余种,而在中国地区报道过的菊花(类)病毒有8种,分别为菊花B病毒(ChrysanthemumvirusB,CVB)、黄瓜花叶病毒(Cucumbbermosaicvirus,CMV)、烟草花叶病毒(Tomatoaspermyvirus,TAV)、番茄不孕病毒(Tomatoaspermyvirus,TAV)、马铃薯X病毒(PotatovirusX,PVX)、马铃薯Y病毒(PotatovirusY,PVY)6种病毒和菊花矮化类病毒(Chrysanthemumstuntviroid,CSVd)、菊花褪绿斑驳类病毒(Chrysanthemumchloriticmottleviroid,CChMVd)2种类病毒[2],其中相当一部分的菊花病毒病属于检疫性病害,会大面积扩散传播。因此,对我国茶用菊感染病毒状况的了解尤为重要。运用快速有效的检测方法确定茶用菊感染的病毒种类,并对染病植株进行脱毒,使其得到复壮,改善种性退化问题,是解决菊花病毒侵染造成产量和品质低下的关键。
福白菊原产地为湖北省麻城市福田河镇、黄土岗镇等地,已有300余年的种植历史[3],因其花瓣白净、汤色清亮、芳香甘甜,被誉为茶用菊中的上品。福白菊在麻城常年种植面积达5万亩,年产量5 000 t以上,产值突破2亿元,给当地种植农户带来了可观的经济效益[3]。近年,福白菊产区已出现普遍的种性退化现象,而福白菊脱毒工作及福白菊脱毒苗在生产上的使用鲜见报道。
植物组织培养技术不仅可用于品种脱毒,还可以在短期内扩繁获得大量无性系植株[4],近年来越来越多地应用于菊花快繁[5]。其中,茎尖培养作为植物首选的脱毒技术常与化学药剂、高温或低温处理结合用于种苗脱毒[6]。茎尖再生效率直接影响脱毒的效率。激素的种类与浓度对外植体形成愈伤组织和芽的诱导效果不同,激素配比不当可能会引起愈伤组织褐化、不定芽玻璃化、脱毒苗生根困难等问题[5],而细胞分裂素和生长素是植物组织培养中较常用的激素,这两种激素在调控植物组织分裂分化中起着协同作用[7]。
本研究旨在筛查茶用菊品种的染毒情况,并在前期工作[8-9]基础上优化培养基中不同的激素组合配比,以分析对福白菊茎尖培养脱毒再生效果的影响,同时分析和比较福白菊脱毒苗和非脱毒苗在遗传稳定性、产量和品质等方面的表现,以期为在生产上推行以福白菊等为代表的茶用菊脱毒苗提供科学依据和理论基础。
1 材料与方法
1.1 试验材料
供试材料为南京农业大学中国菊花种质资源保存中心收集保存的24个常见茶用菊品种,取样地点为南京农业大学江宁湖熟菊花基地。
表1 供试茶用菊品种
1.2 试验方法
1.2.1 巢式PCR病毒检测 根据GenBank记录的中国地区侵染菊花的8种(类)病毒基因序列,即菊花B病毒(CVB)、马铃薯X病毒(PVX)、马铃薯Y病毒(PVY)、黄瓜花叶病毒(CMV)、烟草花叶病毒(TMV)、番茄不孕病毒(TAV)6种病毒,以及菊花矮化类病毒(CSVd)、菊花褪绿斑驳类病毒(CChMVd)2种类病毒,利用Primer Premier 5.0软件分别对其设计巢式PCR引物各2对。参照Coy等[10]建立的方法进行巢式PCR病毒检测,目的条带切胶送至南京擎科生物科技有限公司测序。
1.2.2 茎尖培养的最适培养基筛选 以MS培养基为基本培养基,设置5组不同激素配方,在每种激素配方上各接种15个福白菊茎尖(重复2次),统计茎尖出愈率,筛选最适合茎尖生长的激素配方。激素配方为:6-苄基腺嘌呤(6-benzylaminopurine,6-BA,0 mg·L-1)+萘乙酸(1-naphthaleneacetic acid,NAA,0 mg·L-1);6-BA(1.0 mg·L-1)+NAA(0.1 mg·L-1);6-BA(1.0 mg·L-1)+NAA(0.5 mg·L-1);6-BA(2.0 mg·L-1)+NAA(0.1 mg·L-1);6-BA(2.0 mg·L-1)+NAA(0.5 mg·L-1)。
1.2.3 低温处理结合利巴韦林脱毒 参照文献[8-9,11],在筛选出来的最适茎尖生长的培养基中添加利巴韦林至终浓度为10 mg·L-1。将4℃低温处理3个月的福白菊无菌组培苗在M60体视显微镜(德国Leica公司)下剥取大小为0.3~0.5 mm并茎尖分生组织,置于添加10 mg·L-1利巴韦林的培养基中,于组培室培养(组培室光照时间为16 h·d-1,光强为36 μmol·m-2·s-1)。
1.2.4 脱毒苗脱毒效果检测及扩繁 当福白菊脱毒苗生长高度达到5~7 cm后取1~2片叶用于提取RNA,并进行脱毒效果检测。总RNA的提取按照日本TaKaRa公司提供的RNAiso Plus试剂盒说明书进行,cDNA的合成参照试剂盒(PrimeScriptTM1st Strand cDNA Synthesis Kit, 日本TaKaRa公司)的说明书进行;将巢式PCR验证脱毒成功的脱毒苗进行扩繁,切取1~2 cm嫩梢接入MS生根培养基中,在温度25℃、光照强度36 μmol·m-2·s-1条件下培养15~20 d后可长出新根。
1.2.5 脱毒苗遗传稳定性分析 分别随机选取3株脱毒苗及未经脱毒处理的组培苗作为遗传稳定性检测材料,参照吴洋洋等[12]的方法利用相关序列扩增多态性标记系统(sequence related amplified polymorphism,SRAP)进行遗传稳定性分析。
1.2.6 脱毒苗与非脱毒苗生长指标、产量与品质分析 分别以脱毒种株和非脱毒种株为扦插采穗母本,4月下旬扦插,扦插苗生根后,5月上旬定植,株距7 cm。参照于云霞等[13]的方法测定形态指标。
株高:用卷尺测量茎基部至顶端的垂直高度,记录数据(单位:cm);
冠幅:用卷尺测量整个植株的冠幅,记录数据(单位:cm);
单叶鲜重:用PL602-L电子天平(美国METTLER TOLEDO公司)测量株高25 cm处单个叶片的鲜重,记录数据(单位:g);
单叶面积:用Perfection V750 Pro根系扫描仪(日本Epson公司)测量单个叶片的叶面积,记录数据(单位:mm2);
叶绿素含量:用FMS2便携式叶绿素荧光仪 (英国Hansatech公司)测定植株上、中、下3个部分叶片的叶绿素含量,计算取平均值,记录数据(单位:SPAD);
单株花数:随机选3株,采用人工计数的方式,分别计数单个植株一、二、三茬花数,累加计算平均数,记录数据(单位:个);
单株产量:用PL602-L电子天平(美国METTLER TOLEDO公司)分别称量单个植株一、二、三茬花的鲜重,累加,记录数据(单位:g)。
总黄酮含量:参照舒俊生等[14]建立乙醇超声波提取总黄酮方法,选用Lambda 25紫外分光光度计(美国PE公司)测定其含量。
绿原酸、木樨草苷及3,5-O-双咖啡酰基奎宁酸(又称异绿原酸A)的提取与含量测定:参考2015年版《中华人民共和国药典》中的测定方法,选用超高效液相色谱法(ultra performance liquid chromatography,UPLC)(Infinity 1260,美国Agilent公司)进行测定。
1.3 数据统计与分析
采用齐军山等[15]的方法进行数据统计与分析。试验数据采用Microsoft Office Excel 2013进行统计与整理,检测数据满足正态分布及方差齐性后进行单因素ANOVA方差分析和差异性显著分析(P<0.05)。
2 结果与分析
2.1 茶用菊病毒病害调查
利用巢式PCR对24种茶用菊染病情况进行调查,结果表明茶用菊感染了CVB、TAV、CSVd和CChMVd这4种(类)病毒,而另外4种病毒PVX、PVY、CMV、TMV未检测到条带。在这24种茶用菊中,感染率最高的为CSVd,感染率高达100%,其次是TAV,其感染率为91.67%,CVB的感染率为87.50%,CChMVd的感染率为66.67%(表2、图1)。
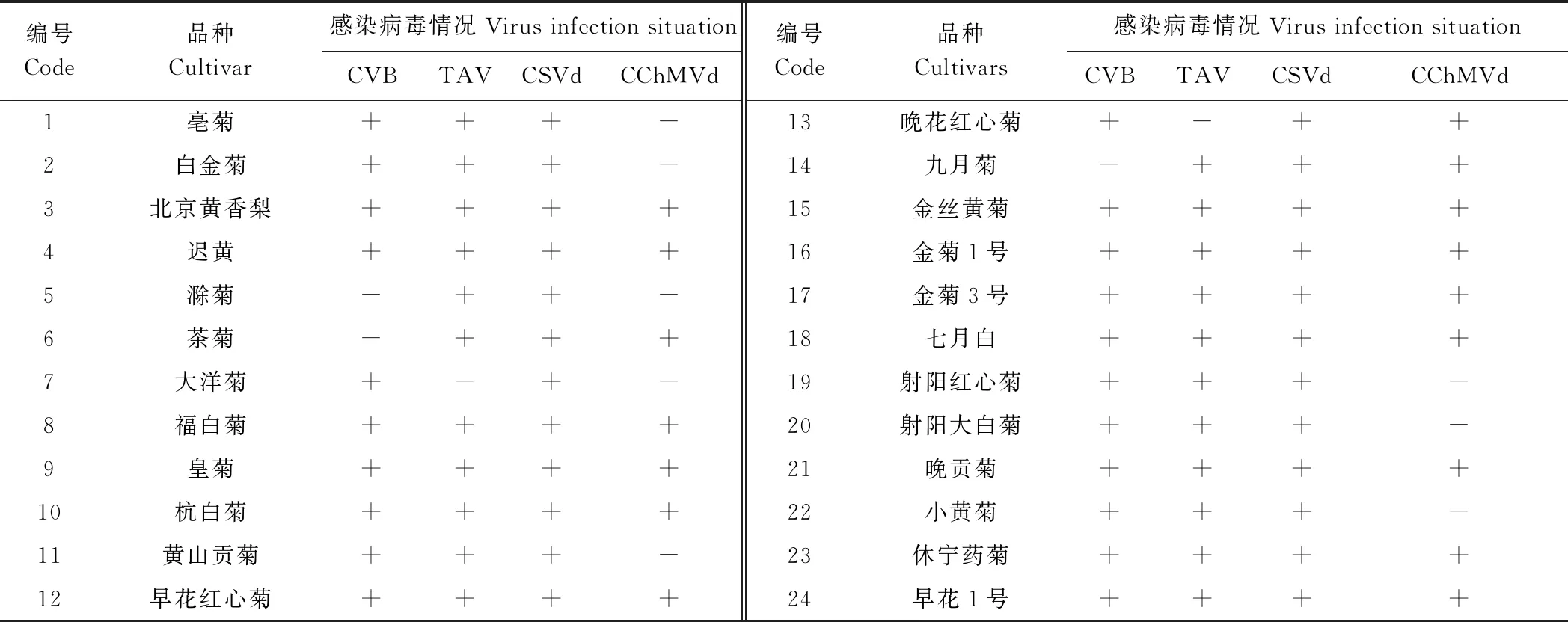
表2 供试茶用菊样品染病情况
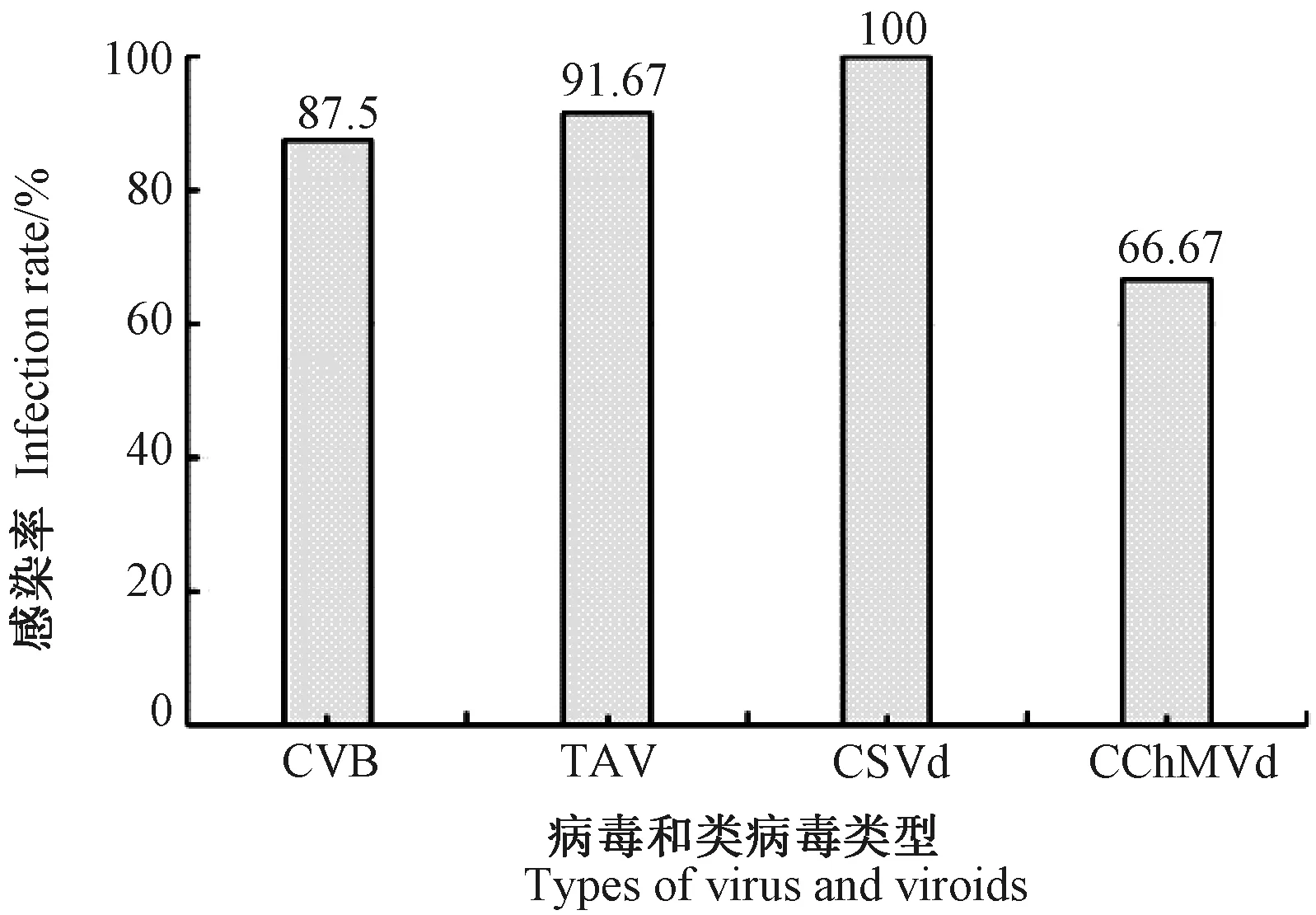
图1 感染病毒情况统计
2.2 福白菊的病毒病害表型考察及单株病毒检测
产区田间种植的福白菊出现了产量降低、品质劣变等种性退化现象(图2),福白菊单株取样的病毒检测发现CSVd、CVB 2种引物能够扩增出明显的目的条带,而其他6种病毒引物均无目的条带。CSVd、CVB巢式PCR第二轮产物大小分别为163、381 bp(图3)。将目的条带割胶纯化,送至南京擎科生物科技有限公司测序,测序结果用BLAST软件进行序列同源性分析,结果表明,CVB的扩增片段与GenBank中对应序列(EU499736.1)的核苷酸序列同源性达到91%,CSVd的扩增片段与对应序列AB279771.1的核苷酸序列同源性为100%,确定福白菊感染了CSVd。

注:a:健康植株;b:感病植株。
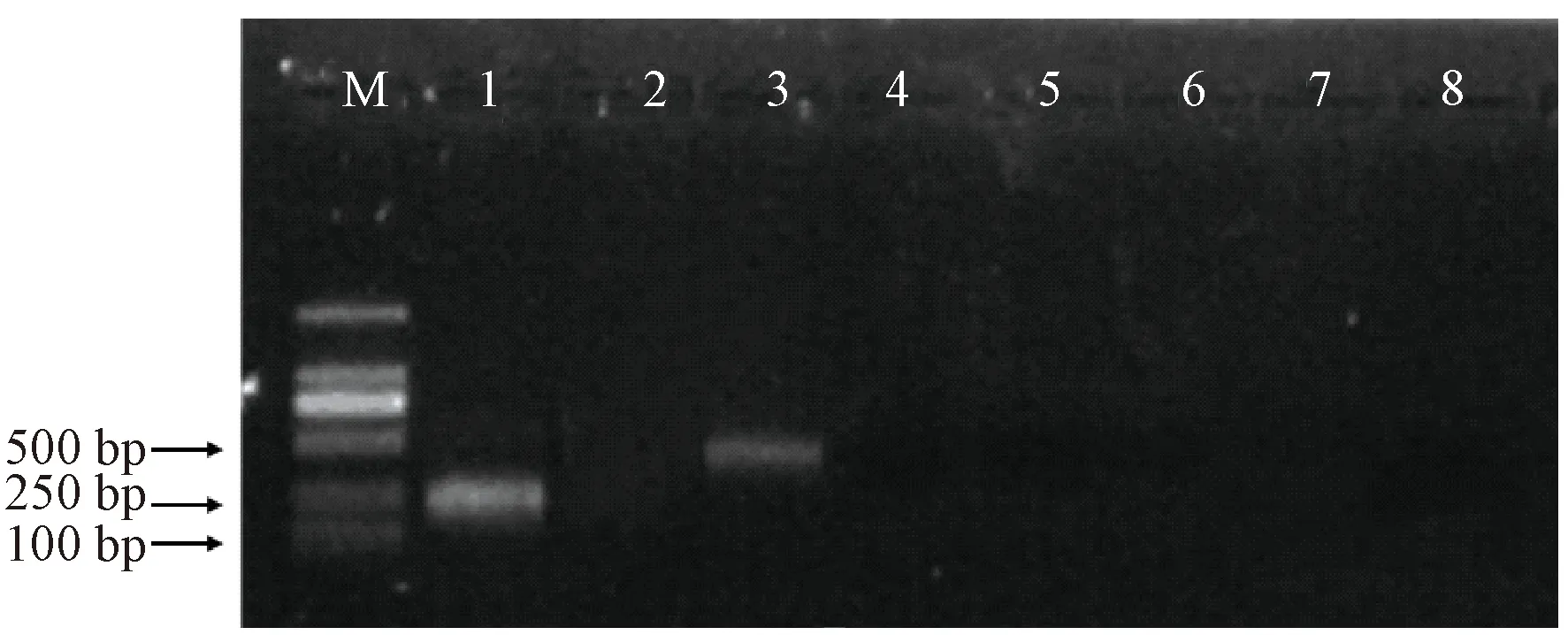
Note: M: Marker DL 2 000. 1~8: CSVd、CChMVd、CVB、TAV、PVY、PVX、TMV、CMV.
2.3 福白菊茎尖最适培养基的确定及脱毒培养
由表3可知,不同浓度、比例的植物激素(6-BA/NAA)对福白菊茎尖的诱导效率不同。当6-BA浓度为1.0 mg·L-1、NAA浓度为0.1 mg·L-1时,福白菊的茎尖诱导存活率最高,达到了60%,未添加植物激素的MS培养基上的茎尖生长较为缓慢且长势较弱;当6-BA/NAA 为2.0/0.1或2.0/0.5时,部分茎尖形成的愈伤组织分化较慢,且培养后期出现玻璃化、褐化等现象,幼苗较瘦弱,生长状况明显弱于其他浓度比例处理的幼苗(图4)。本试验处理中福白菊茎尖分生组织诱导培养最适宜的激素配比为6-BA/NAA为1.0/0.1 mg·L-1。
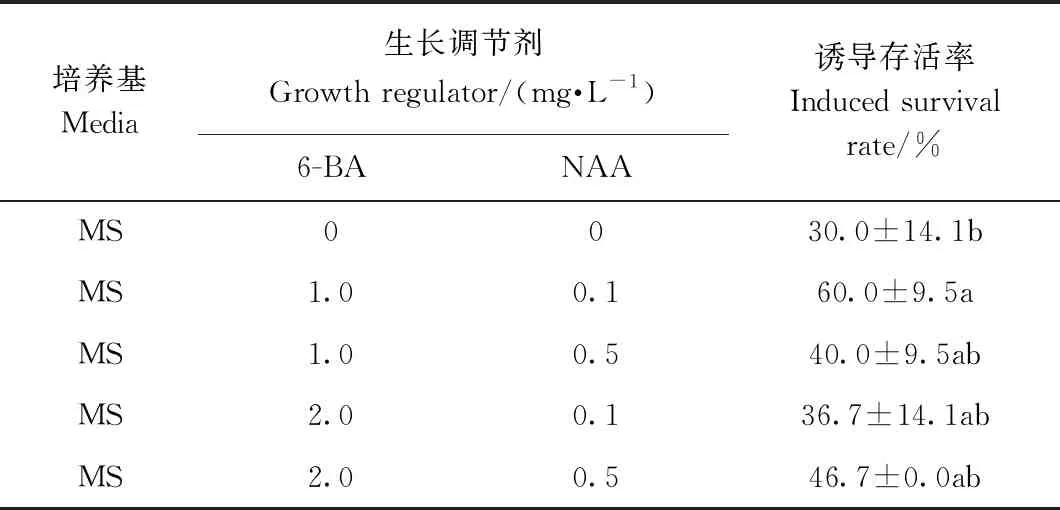
表3 福白菊茎尖在不同浓度植物激素下的诱导存活率

图4 不同浓度植物激素诱导福白菊茎尖的生长过程
基于激素配比筛选结果,用解剖针剥取4℃低温培养3个月的福白菊组培苗0.3~0.5 mm的茎尖分生组织,接种至利巴韦林终浓度为10 mg·L-1的MS + 6-BA/NAA(1.0/0.1 mg·L-1)培养基中。图5为福白菊茎尖分生组织培养1、7、14 d不同阶段的生长状态,当带1~2片叶原基的茎尖分生组织(图5-a)接种到培养基中一周后转绿,逐渐形成膨大的叶原基(图5-b);茎尖接种14 d后,叶原基生长形成带有芽点的嫩芽(图5-c),并在后期继续生长逐渐分化成苗。

注:a: 茎尖分生组织(1 d);b: 初始形成的小芽(7 d);c: 茎尖分化成苗(14 d)。
2.4 脱毒效果检测及脱毒苗的遗传稳定性分析
运用巢式PCR方法对福白菊的脱毒效果进行检测,结果如图6所示。电泳图上无特异性条带则说明脱毒成功,有条带则说明未脱毒成功(反应产物则呈现阳性反应)。结果显示,1号、2号福白菊组培苗成功脱除CSVd和CVB。
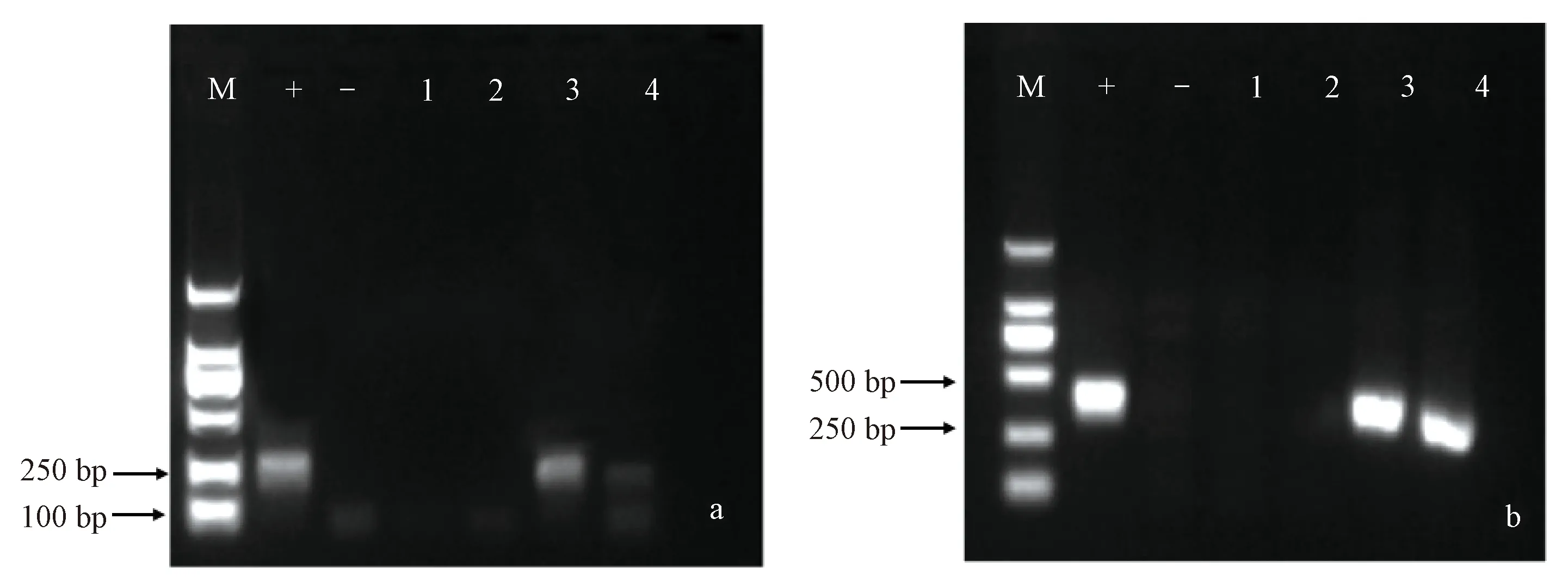
注:a: M: Marker. +: 阳性对照;-: 阴性对照;1和2:CSVd脱毒成功;3和4:CSVd脱毒未成功。b:M: Marker. +: 阳性对照;-: 阴性对照;1和2:CVB脱毒成功;3和4:CVB脱毒未成功。
前期通过预试验,筛选到16对多态性良好、条带清晰的SRAP引物组合。利用筛选到的引物对福白菊脱毒苗及未脱毒苗进行SRAP-PCR扩增,由图7可知,脱毒苗在DNA水平上未检测到遗传变异,表明4℃低温处理及利巴韦林的添加对福白菊的遗传稳定性无影响。
2.5 福白菊脱毒苗与非脱毒苗产量和品质的比较
由表4可知,来自福白菊脱毒种株的生产苗(以下简称脱毒苗)大田表现为株高略矮,冠幅较大;脱毒苗较非脱毒苗大田表现为更加矮壮,不易倒伏,且脱毒苗的单叶鲜重和单叶面积、叶绿素含量较非脱毒苗都有显著提高。叶面积及叶绿素含量的增加有助于脱毒苗提高光合效率,积累更多光合作用产物。就产量而言,脱毒苗的平均单株花数较多,平均单株产量较组培苗高14.47%(表5),其估算亩产量也显著高于未脱毒苗;在内含物的含量上,脱毒苗的总黄酮含量达199.67 mg·g-1,而绿原酸和木犀草苷含量较未脱毒苗也有显著提高(表6)。
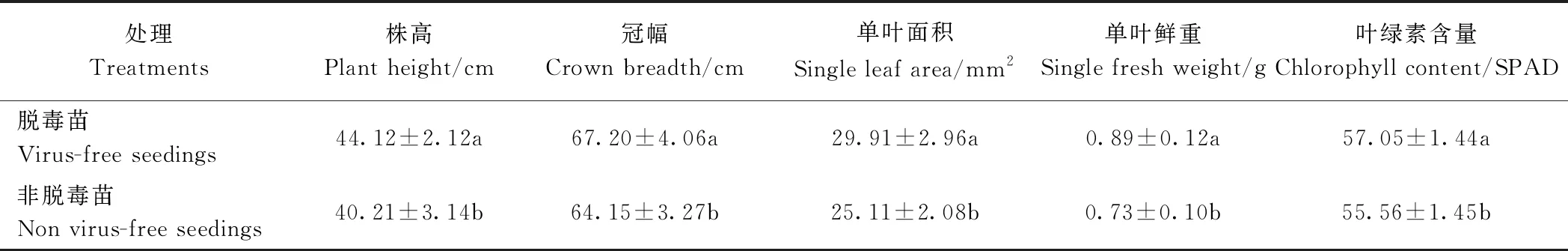
表4 不同种苗对福白菊生长的影响

表5 不同种苗对产量的影响

表6 不同种苗植株内含物的含量
3 讨论
菊花作为我国传统名花有较高的观赏价值和经济价值,但在菊花生产中病毒病害十分严重,已造成严重危害[16-17]。检测植物病毒的方法有酶联免疫吸附法(enzyme linked immunosorbent assay,ELISA)、环介导等温扩增技术[18-19]等。随着聚合酶链式反应的发展,巢式PCR也逐步应用到植物病毒检测领域。本研究通过巢式PCR检测方法调查了田间茶用菊病毒病害的感染情况,检测出了TAV和CVB 2种病毒,以及CChMVd和CSVd 2种类病毒,而其他4种病毒PVX、PVY、TMV、CMV未检出,可能由于病毒系统间存在交叉保护作用或干涉作用,即当植物被一种病毒侵染,则其同类或近缘病毒就不再感染[20]。本研究确定了茶用菊病毒病害的主要病毒种类,所用巢式PCR方法,灵敏、快速、有效,可以作为田间病毒病害早期诊断以及动态检测病毒感染、防控病毒的首选方法。通过巢式PCR及后续的BLAST序列比对确定了福白菊感染了CSVd类病毒和CVB病毒,并在南京农业大学菊花课题组前期工作的基础上确定诱导茎尖培养最适合的6-BA和NAA浓度分别为1和0.1 mg·L-1,诱导存活率较文献[8-9]的研究结果高6.7个百分点,优化了脱毒效率。
研究表明,在组织培养诱导愈伤组织分化出不定芽的过程中植株容易产生无性系变异[21],而保持脱毒对象的优良种性直接决定了脱毒种苗能否进行商业推广。SRAP标记是一种基于PCR的新型分子标记技术,具有简便、高效、高共显性、重复性好等优点,利用SRAP分子标记技术能够快速对脱毒苗和非脱毒苗之间遗传位点的差异进行高分辨率的鉴别比较[22]。本研究利用前期筛选的16对SRAP引物对福白菊脱毒苗和未脱毒处理组培苗进行SRAP-PCR扩增,未出现任何大小、亮度有差异的条带,表明脱毒处理对福白菊的遗传稳定性未产生影响。
由病毒侵染引起的植物病害在全球范围内造成极大的损失[23],且单一植株可能同时被多种病毒侵染[24],导致植株产量、质量的下降,脱毒技术的出现改善了无性繁殖产生的病毒侵染问题[25]。有文献报道脱毒处理可以显著提高植物的产量,脱毒的怀菊株系YD5J6与非脱毒的株系相比增产25.17%[26];脱毒后的滁菊单株产量较非脱毒苗高24.0%[8-9]。周颖媛[27]在怀菊的大田试验结果也表明脱毒株系的单株鲜重、单株花数及单株分蘖数均有所增加,其中脱毒株系与其对照株系相比,亩产增加16.4%。本试验中,福白菊脱毒苗在单叶鲜重、单叶面积、叶绿素含量均优于非脱毒苗,脱毒苗单株产量较非脱毒苗高14.47%,表明福白菊脱毒后种源得到复壮,叶绿素水平上升即光合机构的基础优于非脱毒苗,是其产量提高的原因之一。本试验中,单株着花量及估算亩产量也得到脱毒苗推广区大田数据的支持。
经过脱毒处理之后,药用植物中有效成分的含量也得到了改善和提高。研究表明,脱毒后的怀地黄中的药用成分梓醇含量较非脱毒苗提高32.90%[28];脱毒后亳菊的总黄酮、绿原酸等含量都有显著提升[29];杭白菊脱毒苗中的绿原酸含量高于药典中规定的0.2%[30]。本试验结果表明,福白菊脱毒苗的总黄酮、绿原酸、木犀草苷3种花朵活性成分均高于非脱毒苗。
4 结论
本研究调查了24个茶用菊感染病毒情况,确定了感染较为普遍的4种优势病毒和类病毒,结果表明,所用检测方法巢式PCR 灵敏高效,可应用于之后的菊花病毒病害诊断,为这菊花病毒病的检测奠定了基础。对感染病毒病严重的福白菊进行了脱毒处理,明确了其茎尖诱导最适培养基,优化了脱毒效率。茶菊病毒检测和病毒脱除操作规程如下:
1)对田间疑似感染病毒的茶用菊使用病毒检测引物进行PCR确定感染病毒种类;2)对感染病毒植株进行外植体消毒获得无菌组培苗,并4℃低温培养3个月;3)在体视显微镜下剥取茎尖长度为0.3~0.5 mm的茎尖分生组织,置于含有1.0 mg·L-16-BA、0.1 mg·L-1NAA、10 mg·L-1利巴韦林的培养基中培养;4)对脱毒苗再次进行病毒检测,将脱毒成功的单株进行扩繁;5)待脱毒苗生根后炼苗,移栽大田。
通过对脱毒苗和非脱毒苗一些生长指标(株高、冠幅、产量、鲜重等)以及内含物(绿原酸、总黄酮、木犀草苷等)的测定,证明脱毒苗的品质、产量都有一定的提高,说明用脱毒种株的种苗进行生产可以达到高产和优质的双重目的。

