“黄芪-莪术”药对通过PTEN与p-AKT对人乳腺癌细胞增殖的影响
邓樱 唐润伟 卫菊 乐枫 刘云龙 钱耀明


摘要 目的:探讨“黄芪-莪术”药对通过PTEN与p-AKT对人乳腺癌细胞(MDA-MB-231)增殖的作用机制。方法:将MDA-MB-231细胞进行“黄芪-莪术”药对(药对组)、顺铂(顺铂组)、“黄芪-莪术”药对联合顺铂(药对+顺铂组)治疗,并设置空白对照组。MTT法检测细胞增殖,RT-qPCR检测PTEN与p-AKT的mRNA表达水平,Western Blotting检测p-AKT蛋白表达水平。结果:与空白对照组比较,药对组PTEN mRNA表达水平上升,OD值与p-AKT蛋白表达水平下降(P<0.05),p-AKT mRNA蛋白表达水平变化差异无统计学意义(P>0.05);顺铂组OD值与PTEN mRNA表达水平下降(P<0.05),p-AKT mRNA与蛋白表达水平变化差异无统计学意义(P>0.05);而药对+顺铂组在药对治疗的基础上能进一步抑制MDA-MB-231细胞增殖,促进PTEN mRNA的表达,抑制p-AKT mRNA与蛋白表达水平。结论:“黄芪-莪术”药对抑制MDA-MB-231细胞增殖的机制可能通过上调PTEN基因而直接抑制AKT蛋白水平。
关键词 黄芪;莪术;药对;MDA-MB-231;增殖;PTEN;p-AKT;乳腺癌
Abstract Objective:To explore the effects mechanism of “Radix Astragali seu Hedysari-Rhizoma Curcumae” on the proliferation of MDA-MB-231 cells through PTEN and p-AKT.Methods:MDA-MB-231 cells were treated with “Radix Astragali seu Hedysari-Rhizoma Curcumae” drug pair(drug pair group),cisplatin(cisplatin group),“Radix Astragali seu Hedysari-Rhizoma Curcumae” drug pair combined with cisplatin(drug pair+cisplatin group),and blank control group was set.Then,MTT method was used to detect cell proliferation,RT-qPCR was used to detect PTEN and p-AKT mRNA expression levels,and Western blot was used to detect p-AKT protein expression levels.Results:Compared with the blank control group,the PTEN mRNA expression level of the drug-pair group increased,the OD value and p-AKT protein expression level decreased(P<0.05),the p-AKT mRNA protein expression level did not change significantly(P>0.05); the OD value and PTEN mRNA expression level of the cisplatin group decreased(P<0.05),and the expression levels of p-AKT mRNA and protein did not change significantly(P>0.05); while the drug pair+cisplatin group could further improve on the basis of drug pair treatment Inhibit MDA-MB-231 cell proliferation,promote PTEN mRNA expression,and inhibit p-AKT mRNA and protein expression levels.Conclusion:The mechanism of “Radix Astragali seu Hedysari-Rhizoma Curcumae” drug on inhibiting MDA-MB-231 cell proliferation may directly inhibit AKT protein level by up-regulating PTEN gene.
Keywords Radix Astragali seu Hedysari; Rhizoma Curcumae,Herb-partners; MDA-MB-231; Proliferation; PTEN; p-AKT; Breast cancer
中圖分类号:R273;R285.5文献标识码:Adoi:10.3969/j.issn.1673-7202.2021.11.013
乳腺癌是仅次于肺癌的第二大常见恶性肿瘤,是导致癌症死亡的第五大常见原因[1-2]。其中,三阴性乳腺癌是高转移性异质性乳腺癌,在乳腺癌中占10%~20%,其治疗已逐渐成为乳腺癌研究领域的热点和难点问题。
化疗、放疗、内分泌治疗等常用于抑制肿瘤生长,减少乳腺癌复发。顺铂是目前最广泛使用、临床疗效显著的化疗药物和抗癌剂[3],但部分患者进行化疗后会受到不良反应的困扰或对药物产生一定耐药性[4]。有研究表明,多种自然疗法对癌症有效,寻找具有生物活性的天然产物可能为乳腺癌治疗提供另一种策略[5]。
益气活血中药黄芪-莪术的配伍是临床常用抗腫瘤组合[6]。有报道发现黄芪-莪术配伍能够抑制肿瘤的生长和转移[7]。黄芪-莪术抗肿瘤作用很大程度上是通过抑制细胞凋亡的基因蛋白表达下调,促进细胞凋亡的活性因子增强而实现的[8]。
在多种肿瘤抑制途径中,PTEN作为肿瘤抑制基因,主要通过PI3K/AKT通路发挥其抑癌功能[9]。有研究发现,激活PTEN能抑制p-AKT蛋白表达,进而抑制膀胱癌细胞的增殖、迁移和侵袭,促进细胞凋亡[10],且PTEN能通过p-AKT对乳腺癌产生影响[11]。
为阐明黄芪-莪术的抗乳腺癌效果,用黄芪-莪术对MDA-MB-231细胞进行干预处理,检测MDA-MB-231细胞的增殖及PTEN和p-AKT表达情况,为乳腺癌的治疗提供可能的理论依据。
1 材料与方法
1.1 材料
1.1.1 细胞 MDA-MB-231细胞(ATCC中心,美国,批号:HTB-26),将细胞培养于DMEM培养基,添加10%胎牛血清(FBS)与1%青-链霉素,于37 ℃、5% CO2恒温培养箱中培养,每2天换液1次。
1.1.2 药物 按照临床最常用剂量:黄芪30 g、莪术15 g,将中药液熬制浓缩为500 mL。将浓缩中药液放于真空冷冻干燥机-50 ℃预冻5 h;-20 ℃低温升华干燥14 h;30 ℃解析干燥10 h后于-20 ℃环境中密封保存。使用时,1 mL超纯水溶解1 g冻干粉,混匀后高温高压消毒灭菌,4 ℃下保存。
1.1.3 试剂及仪器 顺铂(Hospira公司,澳大利亚,批号:H20090521);辣根过氧化物酶(苏州亚科科技股份有限公司,批号:L0001)、GAPDH(Jackson Immuno Research公司,美国,批号:AP0063);qPCR引物(RiboBio公司,批号:siB07112111271-1-5,siB101025113730-1-5,siG000026330A-1-5);p-AKT(Abcam公司,英国,批号:ab8805);DMEM培养基(Gibco,美国,批号:11995065);FBS(Gibco,美国,批号:10270-106);TRIzol试剂盒(Invitrogen公司,美国,批号:15596026);高容量cDNA RT试剂盒(Applied Biosystems公司,美国,批号:4368814);BCA试剂盒(武汉博士德公司,批号:AR0197);电子精密天平(Sartorius公司,德国,型号:GL8201-1SCN);BIO-TEK Elx800酶标仪(BIO-TEK公司,美国,型号:ELx800);BioPhotometer D30核酸蛋白测定仪(Eppendorf公司,德国,型号:D30);SYBR Green PCR mix(Applied Biosystems公司,美国,批号:4367659);显影仪(Healthcare公司,瑞典,型号:AI680)。
1.2 方法
1.2.1 分组与模型制备 取对数生长期的MDA-MB-231细胞,制备单细胞悬液,调整MDA-MB-231细胞浓度为5×104个/mL,96孔板每孔接种1×104个细胞,接种2 d后细胞生长基本融合。将培养的细胞分为药对组、顺铂组、药对+顺铂组以及空白对照组。
1.2.2 干预方法 药对组加入浓度为25%的“黄芪-莪术”冻干粉、顺铂组加入30 μg/mL顺铂、药对+顺铂组加入25%的“黄芪-莪术”冻干粉+30 μg/mL顺铂,空白对照组不添加任何药物。
1.2.3 检测指标与方法
1.2.3.1 MTT法检测MDA-MB-231细胞增殖 取上述各组MDA-MB-231细胞,同时设置调零孔(无细胞,仅含培养液)和阴性对照孔(含细胞和培养液)。于药物作用2 d后,弃上清液,每孔加入含10%FBS的DMEM培养液100 μL和MTT溶液20 μL,放于37 ℃、5% CO2培养箱孵育4 h后,弃上清液,每孔加入DMSO 150 μL,微量振荡15 min。应用BIO-TEK Elx800酶标仪,于波长490 nm处测得每孔的光密度值。
1.2.3.2 RT-qPCR检测 使用TRIzol试剂盒从MDA-MB-231细胞中提取总RNA,核酸蛋白测定仪测量260 nm和280 nm下OD比值及RNA水平,OD260 nm/OD280 nm比值在1.8~2.0之间说明RNA纯度较高。使用高容量cDNA RT试剂盒逆转录成cDNA。在qPCR中,用SYBR Green PCR mix扩增cDNA样本,检测p-AKT和PTEN的表达水平。使用GAPDH为内参。引物序列见表1。
1.2.3.3 Western Blotting法测定蛋白表达 用含有蛋白酶和磷酸酶抑制剂的RIPA缓冲液裂解MDA-MB-231细胞15 min,BCA试剂盒测定蛋白浓度。用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离相同数量的蛋白质,转移到聚偏氟乙烯(PVDF)膜上。恒流100 mA过夜,PVDF转膜,PBST漂洗,5%脱脂奶粉封闭1 h。加入一抗p-AKT(1∶1 000稀释)、GAPDH(1∶2 000稀释)室温下轻摇孵育1 h,辣根过氧化物酶标记的二抗(1∶500稀释)室温孵育1 h,PBST漂洗后浸洗3次,10 min/次。使用Odyssey双色红外荧光扫描成像系统获得图片,运用Quantity One图像分析软件测得条带灰度值,将各目的条带与内参条带比值后,比较各组间差异。
1.3 统计学方法 采用SPSS 21.0统计软件进行数据分析,计量资料用均值±标准差(±s)表示,服从正态分布的计量资料2组比较采用独立样本t检验。多组间的数据分析采用单因素方差分析,两两比较采用LSD-t。以P<0.05为差异有统计学意义。
2 结果
2.1 MDA-MB-231细胞形态观察 给药2 d后,显微镜下观察MDA-MB-231细胞形态变化,发现空白对照组细胞排列紧密,数量较多,形态正常;药对组可见细胞形态不规则,细胞膜不完整;顺铂组可见细胞数量减少,有回缩,折光增强,细胞膜不完整;药对+顺铂组可见细胞胞质回缩,有空泡,并伴有较多飘漂浮死细胞。见图1。说明“黄芪-莪术”药对能促进MDA-MB-231细胞凋亡,且作用效果与顺铂相似。
2.2 MDA-MB-231细胞增殖情况 MTT法检测药物干预2 d后MDA-MB-231细胞增殖水平,发现与空白对照组比较,药对组、顺铂组、药对+顺铂组OD值均下降(均P<0.01);与药对组比较,顺铂组、药对+顺铂组OD值均下降(均P<0.01);与顺铂组比较,药对+顺铂组OD值下降(P<0.05)。说明顺铂与“黄芪-莪术”药对都能抑制MDA-MB-231细胞增殖,且顺铂较“黄芪-莪术”药对对乳腺癌细胞增殖的抑制效果更为显著,而二者联合使用时能更大程度上抑制MDA-MB-231細胞的增殖。见表2。说明“黄芪-莪术”药对能抑制MDA-MB-231细胞生长,其抑制程度较顺铂轻。
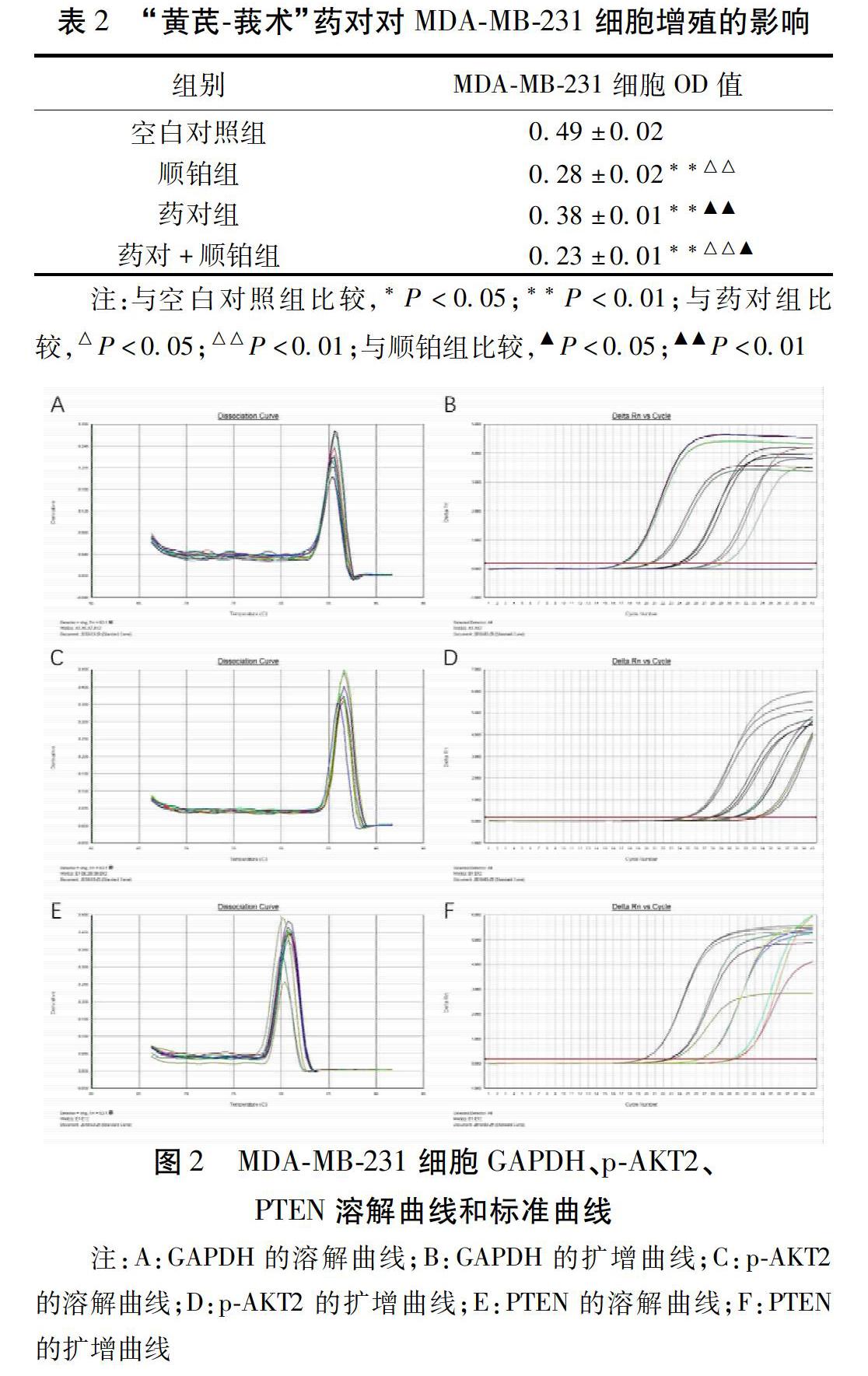
2.3 GAPDH、p-AKT2、PTEN溶解曲线及标准曲线 绘制MDA-MB-231细胞GAPDH、p-AKT2、PTEN溶解曲线,发现都为单峰,未见杂峰信号,说明GAPDH、p-AKT2、PTEN的逆转录PCR参数选择适当,产物特异性好;绘制扩增曲线发现扩增曲线光滑,呈标准的S形且拐点清晰。见图2。为后续RT-qPCR检测MDA-MB-231细胞p-AKT2、PTEN的mRNA水平打下基础。
2.4 MDA-MB-231细胞p-AKT2、PTEN的mRNA表达水平 各组细胞药物干预2 d后,RT-qPCR检测发现各组MDA-MB-231细胞中p-AKT2表达水平变化差异无统计学意义(P>0.05)。与空白对照组比较,药对组、顺铂组和药对+顺铂组的PTEN的mRNA表达水平都上升(均P<0.05);与药对组比较,顺铂组PTEN表达水平下降(P<0.05),而药对+顺铂组PTEN表达水平差异无统计学意义(P>0.05);与顺铂组比较,药对+顺铂组TEN的mRNA表达水平上升(P<0.05)。说明顺铂与“黄芪-莪术”药对对MDA-MB-231细胞p-AKT2的mRNA表达水平无影响,而药对能增加MDA-MB-231细胞PTEN的mRNA表达。见表2。
2.5 MDA-MB-231细胞p-AKT2的蛋白表达水平 药物治疗2 d后,Western Blotting检测各组MDA-MB-231细胞中p-AKT2蛋白表达水平,发现与空白对照组比较,药对组和药对+顺铂组p-AKT2蛋白表达水平都上升(均P<0.01),而顺铂组p-AKT2蛋白表达水平变化差异无统计学意义(P>0.05);与药对组比较,顺铂组p-AKT2蛋白表达水平上升(P<0.01),而药对+顺铂组p-AKT2蛋白表达水平下降(P<0.01);与顺铂组比较,药对+顺铂组p-AKT2蛋白表达水平下降(P<0.01)。说明“黄芪-莪术”药对能抑制MDA-MB-231细胞p-AKT2蛋白表达水平,而顺铂对MDA-MB-231细胞p-AKT2蛋白表达水平无影响。见表3,图3。
3 讨论
乳腺癌是女性最常见的恶性肿瘤,其发病率位居女性恶性肿瘤谱榜首,并且近年来我国女性乳腺癌的发病情况日趋低龄化[12]。化疗、放疗、内分泌治疗等常用于清除残留肿瘤细胞,抑制肿瘤生长,减少乳腺癌复发[13]。中医学上,乳腺癌患者有正虚邪实的证候特点。正虚以气虚病机为本,同时常常兼有邪实,其中以血瘀者为多,因此,对此类患者的中医治疗以益气活血化瘀为主,以降低复发风险、提高治愈率。
在过去的几十年里,研究人员探索了许多有临床价值的草药的生物学特性,通过长期的临床观察及分析,发现黄芪含有多种生物活性化合物,包括多糖、类黄酮和皂苷等,具有利尿、引流脓肿的作用[14-15]。黄芪味甘,性微温,入肺脾经,具有健脾益气之功效,既能使脾气健运,痰浊得消,又能行气活血,使瘀血自消,达到预防乳腺癌复发及转移的作用。在临床上,黄芪作为扶正代表药物,用于治疗各种癌症,有报道发现其能增强厄洛替尼对三阴性乳腺癌异种移植的抗肿瘤作用[16]。在中医临证中还常选配莪术,其性温,味辛、苦,归肝脾经,具有行气破血,消积止痛之功,常用于癥瘕痞块的治疗。有研究证实莪术可以直接抑制肿瘤增殖相关蛋白的合成[17],与黄芪合用,能在祛邪的同时而不伤正,对肿瘤治疗产生积极作用。
通过探讨“黄芪-莪术”药对联合顺铂对MDA-MB-231细胞的增殖作用,发现顺铂或者“黄芪-莪术”药对都能抑制MDA-MB-231细胞增殖,而“黄芪-莪术”药对与顺铂联用能进一步抑制MDA-MB-231细胞增殖,说明“黄芪-莪术”药对能够抑制乳腺癌的发生。
研究表明恶性肿瘤的发生发展是多因素多步骤的过程,其与细胞信号通路发生异常改变、细胞接受异常增殖分化信号等密切相关[18]。因此,研究与乳腺癌发生发展相关的信号通路及其作用机制,对抑制乳腺癌细胞增殖至关重要[19]。PTEN是具有双重特异磷酸酶活性的肿瘤抑制基因,其蛋白质产物位于细胞质,主要参与促进细胞凋亡、抑制细胞生长、调节细胞周期、抑制肿瘤细胞黏附及转移等作用,在多种肿瘤组织中均检测到PTEN蛋白的表达缺失[15]。AKT属于原癌基因,其C末端和N末端有2个催化位点[20],能被磷酸化,其磷酸产物为p-AKT,可以抑制肿瘤的凋亡[9],PTEN可能通过p-AKT发挥其抑制肿瘤作用[11]。
本研究表明,“黄芪-莪术”药对能促进MDA-MB-231细胞PTEN mRNA的表达,抑制p-AKT蛋白表达,但对p-AKT的mRNA表达水平无影响。在增加了顺铂对MDA-MB-231细胞的干预实验后,发现顺铂抑制PTEN mRNA的表达,并且对AKT mRNA与蛋白表达水平都无影响;而联合“黄芪-莪术与顺铂治疗发现其能促进MDA-MB-231细胞PTEN mRNA的表达,抑制AKT mRNA与蛋白表达。上述增殖实验,说明“黄芪-莪术”药对抑制MDA-MB-231细胞增殖的机制可能主要是通过上调PTEN基因而直接抑制AKT蛋白水平。
综上所述,本研究发现“黄芪-莪术”药对抑制MDA-MB-231细胞增殖的机制与PTEN及p-AKT蛋白水平相关,其能通过上调PTEN及下调p-AKT的表达抑制MDA-MB-231细胞增殖,揭示了“黄芪-莪术”药对对三阴性乳腺癌的作用机制。
参考文献
[1]Zhong M,He X,Lei K.Survival of Patients with First and Metachronous Second Primary Breast Cancer or Lung Cancer Malignancy:Comparisons Using the SEER Database[J].Adv Ther,2020,37(5):2236-2245.
[2]Valencia OM,Samuel SE,Viscusi RK,et al.The Role of Genetic Testing in Patients With Breast Cancer:A Review[J].JAMA Surg,2017,152(6):589-594.
[3]Okon E,Luszczki JJ,Kukula-Koch W,et al.Synergistic or Additive Pharmacological Interactions between Magnoflorine and Cisplatin in Human Cancer Cells of Different Histological Origin[J].Int J Mol Sci,2020,21(8):2848-2457.
[4]Zhou R,Chen H,Chen J,et al.Extract from Astragalus membranaceus inhibit breast cancer cells proliferation via PI3K/AKT/mTOR signaling pathway[J].BMC Complement Altern Med,2018,18(1):83.
[5]Okon E,Kukula-Koch W,Jarzab A,et al.Advances in Chemistry and Bioactivity of Magnoflorine and Magnoflorine-Containing Extracts[J].Int J Mol Sci,2020,21(4):1330.
[6]許成勇,徐冉,王毓国,等.不同剂量配比黄芪-莪术抑制Lewis肺癌生长转移及其对TGF-β1、HIF-1α表达的影响[J].北京中医药,2018,37(11):66-69.
[7]尹刚,唐德才,戴建国,等.黄芪、莪术配伍对人卵巢癌HO-8910原位移植瘤组织中MMP2和VEGF表达的影响[J].南京中医药大学学报,2014,30(1):53-56.
[8]任艳珍,索玉平,李晓旭,等.莪术对人宫颈癌Hela细胞增殖及免疫功能的影响[J].山西医药杂志,2015,44(8):23-25.
[9]Zhang S,Wang J,Yao T,et al.LncRNA ZFAS1/miR-589 regulates the PTEN/PI3K/AKT signal pathway in the proliferation,invasion and migration of breast cancer cells[J].Cytotechnology,2020,72(3):415-425.
[10]Liu Y,Lin F,Chen Y,et al.Cryptotanshinone Inhibites Bladder Cancer Cell Proliferation and Promotes Apoptosis via the PTEN/PI3K/AKT Pathway[J].J Cancer,2020,11(2):488-499.
[11]Nasimian A,Farzaneh P,Tamanoi F,et al.Cytosolic and mitochondrial ROS production resulted in apoptosis induction in breast cancer cells treated with Crocin:The role of FOXO3a,PTEN and AKT signaling[J].Biochem Pharmacol,2020,7:177-194.
[12]Ghoncheh M,Pournamdar Z,Salehiniya H.Incidence and Mortality and Epidemiology of Breast Cancer in the World[J].Asian Pac J Cancer Prev,2016,17(S3):43-46.
[13]Zhou D,Ouyang Q,Liu L,et al.Chemotherapy Modulates Endocrine Therapy-Related Resistance Mutations in Metastatic Breast Cancer[J].Transl Oncol,2019,12(5):764-774.
[14]Zhang K,Pugliese M,Pugliese A,et al.Biological active ingredients of traditional Chinese herb Astragalus membranaceus on treatment of diabetes:a systematic review[J].Mini Rev Med Chem,2015,15(4):315-329.
[15]Auyeung KK,Han QB,Ko JK.Astragalus membranaceus:A Review of its Protection Against Inflammation and Gastrointestinal Cancers[J].Am J Chin Med,2016,44(1):1-22.
[16]李浩渤,陈勇,陈宇.莪术水提物通过上调notch1诱导口腔癌细胞凋亡[J].中国老年学杂志,2018,38(16):3999-4001.
[17]Zhou R,Xu L,Ye M,et al.Formononetin inhibits migration and invasion of MDA-MB-231 and 4T1 breast cancer cells by suppressing MMP-2 and MMP-9 through PI3K/AKT signaling pathways[J].Horm Metab Res,2014,46(11):753-760.
[18]Guerrero-Zotano A,Mayer IA,Arteaga CL.PI3K/AKT/mTOR:role in breast cancer progression,drug resistance,and treatment[J].Cancer Metastasis Rev,2016,35(4):515-524.
[19]张刚,李中,林晓萌,等.乳腺癌组织中PTEN、p-AKT蛋白表达变化及相关性分析[J].山东医药,2014,54(19):48-49.
[20]张刚,李中,林晓萌,等.乳腺组织中PTEN表达及其与PI3 K/Akt信号通路的关系[J].临床与实验病理学杂志,2015,31(9):1037-1039.
(2020-08-27收稿 责任编辑:吴珊,徐颖)

