硫酸盐还原菌介导针铁矿表面硫的转化及镉固定脱毒效应
童辉,乔江涛,周继梅, ,雷琴凯,陈曼佳*,刘承帅,
1.广东省科学院生态环境与土壤研究所/华南土壤污染控制与修复国家地方联合工程研究中心/广东省农业环境综合治理重点实验室,广东 广州 510650;2.中国科学院地球化学研究所/环境地球化学国家重点实验室,贵州 贵阳 550001;3.广东工业大学环境科学与工程学院,广东 广州 510006
随着经济、工农业的快速发展,矿产资源的大量开发,以及各种化学产品、农药及化肥的广泛使用,重金属污染物通过各种途径进入土壤环境,造成严重污染。当前农田土壤环境重金属污染问题,尤其是镉污染日益严重(曾希柏等,2013)。而过高的镉含量会引起土壤生物学特性的逐渐变异,导致土壤质量下降;同时土壤中镉的生物迁移性和毒性较强,容易被作物吸收积累,并通过食物链的传递进入人体,危害人类健康(Franz et al.,2008)。如何消除土壤中重金属镉污染成为亟待解决的重要科学问题。
重金属一旦进入土壤就会被土壤中的各种组分吸附,很难再迁移至其他介质中。镉类化合物毒性很大,镉污染治理只能通过改变其存在的方式和转移位置,而不能消除毒性(肖春文等,2013)。土壤中微生物呼吸代谢的生理特征使其在重金属转化过程中具有天然的优势(de Mora et al.,2005),微生物修复已成为重金属的重要转化途径。其中,硫酸盐还原菌(Sulfate reducing bacteria,SRB)作为一种土壤中普遍存在的厌氧微生物,对生物地球化学过程起着重要的作用,其介导的硫酸盐还原作用促进镉的转化脱毒的研究已成为土壤环境领域的研究热点(Pagnanelli et al.,2010;Shan et al.,2019)。
研究表明,SRB作用下的硫酸盐还原过程是硫生物地球化学循环中的关键步骤(Wu et al.,2013),更是土壤重金属固定脱毒的驱动力(贾欠欠等,2019)。硫酸盐还原过程中,SRB能够以有机物如乳酸、甲苯、石油烃等为电子供体,以硫酸盐为末端电子受体,在SRB相关功能酶的催化作用下,对有机物进行氧化降解,而硫酸盐则被还原成硫化氢(式 1。Barton et al.,2009;Wu et al.,2013)。还原生成的 S2−可以与金属离子形成硫化物,从而对重金属起到稳定、脱毒的效果(式2。Tebo et al.,1998;Pagnanelli et al.,2010;范文宏等,2008)。目前,关于 SRB作用下的重金属污染修复的研究被应用到重金属污染的工业废水、矿山废水、沉积物和土壤环境中(Pagnanelli et al.,2010;江峰等,2018;孙丽娟等,2018)。在镉污染土壤中,SRB的存在可以促进S2−的生成,与Cd(II)形成沉淀,达到镉污染固定脱毒的效果(范文宏等,2008;Tan et al.,2018)。不同污染程度土壤中镉的地球化学形态分布的研究表明,可交换态是土壤中镉主要的存在形态,在SRB作用下,硫酸盐被还原成S2−与可交换态镉以及土壤的铁锰矿物形成稳定的沉淀物,镉从不稳定的可交换态转化成更加稳定的铁锰氧化物结合态,可交换态镉的去除率可达60%—80%(Tan et al.,2018;范文宏等,2008)。
SRB对于重金属污染的转化脱毒已引起广泛关注和重视,SRB作用下重金属的转化脱毒主要在于SRB还原生成的S2−所能形成的沉积物及其稳定性。该过程受到共存微生物和土壤理化性质等因素影响(Park et al.,2008;Peng et al.,2018)。例如,华南红壤区域的土壤中含有大量的铁氧化物,而氧化铁是土壤中重要的活性物质(赵其国,2002)。有研究表明,Fe(II)能刺激SRB的活性,土壤中Fe(II)物种增加,SRB的代谢活动更为旺盛,生长高峰期延长进而提高硫酸盐的还原速率和硫化物的累积量(赵阳国等,2007),如果Fe(II)物种的浓度过低,SRB的生长则会受到一定程度的限制(Marchal et al.,2001)。此外,Fe(II)物种也能通过与 S2−结合,影响硫酸盐还原的过程(Gonzalez-Silva et al.,2009)。
然而,关于 Fe(II)物种和铁氧化物共存的情况下,SRB介导的重金属还原行为还缺乏深入的研究。因此,本研究以土壤中常见的针铁矿为研究对象,以镉为金属目标物,通过实验室模拟试验研究厌氧条件SRB作用下,镉转化脱毒过程中硫、镉的形态变化,探索SRB介导的硫酸盐还原过程对重金属镉转化脱毒的作用机制,为深入理解稻田土壤中重金属的环境行为,以及研发高效的重金属脱毒技术提供重要的科学依据。
1 材料与方法
1.1 针铁矿的制备
根据已有的文献报道合成针铁矿(Schwertmann et al.,2000),具体操作流程如下:配制 50 mL 1.0 mol·L−1的 Fe(NO3)3溶液和 90 mL 5.0 mol·L−1的KOH溶液;在充分搅拌情况下将KOH溶液快速加入到Fe(NO3)3溶液中,并迅速把混合溶液稀释到1 L;然后将稀释的溶液在70 ℃水浴中恒温反应60 h,在反应过程中,间歇性搅拌反应液3—5次;水浴反应之后得到黄褐色沉淀,将上清液去除,收集固体沉淀,并用超纯水进行清洗5次,直至洗涤液的pH为中性;然后把洗涤后的沉淀置于70 ℃烘箱中过夜烘干,最后用玛瑙研钵研磨得到针铁矿粉末(α-FeOOH)。
1.2 菌种来源和活化
本试验采用的硫酸盐还原菌为 Desulfovibrio vulgaris Hildenborough(DSM644),购于德国微生物菌种保藏中心(DSMZ)。采用其推荐的培养基厌氧培养微生物,具体培养基配方如下:2 g NH4Cl,2 g MgSO4·7H2O,4 g Na2SO4,0.5 g K2HPO4,1 g 酵母菌,6 mL乳酸钠(60%)以及1 mL微量元素,最终定容到 1 L。通过计算可知,此硫酸根还原培养基中硫酸根的含量为 36.27 mmol·L−1,pH 为 7.0。
菌体在上述液体培养基置于 30℃恒温培养箱中培养 16 h,于 4 ℃ 8000 r·min−1条件下离心 10 min,用灭菌超纯水洗涤重悬浮,重复3次,最终用培养基配成约1010cell·mL−1的菌悬液待用。
1.3 实验设计
厌氧培养实验开始前,所有待使用的器具和溶液均需严格的灭菌。器具、超纯水和培养基采用标准的高压灭菌流程进行灭菌,其他试剂采用0.22 μm滤头过滤灭菌。除特别说明外,本实验均在厌氧手套箱中进行(Bactron II,Shellab,美国),厌氧箱中氧气浓度保持在1ppm以下。本实验所用到的所有溶液均经高纯度N2(99.99%)曝气灭菌,再转移至厌氧箱内使用。实验分别设计化学对照处理:T1针铁矿+FeCl2+CdCl2;生物处理:T2:针铁矿+SRB,T3:针铁矿+FeCl2+SRB;T4:针铁矿+CdCl2+SRB;T5:针铁矿+FeCl2+CdCl2+SRB。反应体系在25 mL的西林瓶中进行,溶液总体积为20 mL,内含1.2所述的基础培养基20 mL,2 g·L−1针铁矿、2.5 mmol·L−1FeCl2、2.5 mmol·L−1CdCl2以及约 108cell·mL−1的硫酸盐还原菌DSM644。
反应进行到设定的时间点,在厌氧箱中取样。首先取适量的样品用 0.5 mol·L−1HCl浸提 90 min,离心10 min,用针头过滤器(0.22 μm)过滤上清液并收集,用于活性物种(为溶解态和吸附态物种之和)含量分析(Fredrickson et al.,1996),而固体继续用同体积的浓 HCl(约 11.2 mol·L−1)进行溶解,待固体完全溶解之后进一步过滤收集液体,用于结构态物质含量分析(王春等,2020)。上述两种液体样品进一步用于后续Fe和Cd物种的浓度分析。另取适量的样品,进行固液分离,收集固体,用于后续矿物结构表征分析。每个样品设置3个重复,文中所示数据均为数据平均值。
1.4 测试与表征方法
体系中 SO42−浓度采用 DIONEX 公司的 Ion Chromatography System(ICS-90)离子色谱测定。流动相为 8.0 mmol·L−1Na2CO3和 1.0 mmol·L−1NaHCO3,同时采用 0.05 mmol·L−1的 H2SO4作为抑制器再生液,流速为 1.0 mL·min−1,进样量为 20 μL。Fe(II)物质的检测采用邻菲罗啉比色法(王春等,2020),取适量样品一次加入,依次加入50 μL 0.1 mol·L−1氟化铵,200 μL 1 g·L−1邻菲罗啉和 200 μL 5 mol·L−1醋酸缓冲溶液,充分混匀之后显色15 min,上机检测。分析仪器为紫外可见分光光度计(TU-1800,北京普析通用)。采用电感耦合等离子发射光谱仪(ICP-MS,PerkinElmer NexION 300X,USA)测定溶液中Cd的含量。矿物晶体结构以及形貌分别采用X’Pert Pro MPD X射线衍射仪(XRD)和电镜扫描仪(SEM)进行分析(Hua et al.,2018)。同时,采用X-射线光电子能谱仪(XPS)分析矿物表面元素化学形态。扫描光谱由 Thermo fisher Scientific K-Alpha分析仪通过 100 eV的光子能量提供,通过电子能量为30 eV的模型化合物获取窄的XPS扫描峰。
2 结果与讨论
2.1 硫酸盐还原动力学
反应体系中硫酸盐还原动力学如图1所示。在化学灭菌对照处理(T1)中,SO42−浓度基本没发生变化,说明在没有SRB作用下,体系中的SO42−不能被还原转化。在单独SRB作用(T2)下,硫酸盐的转化率可达 66.34%;在外加 2.5 mmol·L−1FeCl2(T3)时,SO42−的还原效果最好,其转化率高达70.61%。有研究认为,Fe(II)对硫酸盐还原过程具有重要作用,当 Fe(II)添加量在 1.78—7.14 mmol·L−1时,微生物活性增加,硫酸盐还原速率加快(赵阳国等,2007)。这说明本研究中外加高浓度的Fe(II)加速了硫酸盐还原过程。然而,重金属Cd的存在抑制了硫酸盐的还原过程,在外加CdCl2体系(T4)中硫酸盐的转化率下降到57.23%;同时外加FeCl2和CdCl2(T5)时,硫酸盐的转化率则为62.21%。这可能是由于Cd(II)的存在对SRB还原SO42−有一定的抑制作用(Gonzalez-Silva et al.,2009)。此外,在所有生物处理下,SRB的存在促使所有处理中的SO42−快速下降,在反应的后期SO42−的还原速率相比较反应初期有所降低,说明随着反应的进行,还原产物H2S不断积累,并可能通过以未解离酸的方式进入细胞膜,与细胞色素中的 Fe或其他含金属的化学物结合,进一步抑制了SRB在厌氧密闭体系中对 SO42−的继续还原(Sánchez-Andrea et al.,2014)。
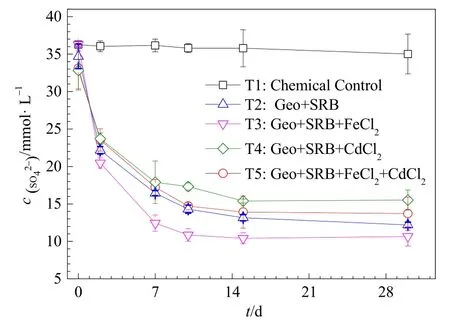
图1 不同反应体系中SO42−还原动力学Fig.1 The kinetic of SO42− reduction under different conditions
2.2 游离态Fe(II)浓度变化
Fe元素会对硫酸盐还原过程产生一定的促进或者抑制作用,因此,本研究测定了体系中游离态Fe(II)的含量变化,其结果如图2所示。由图可知,在灭菌的化学对照处理中(T1),体系游离态Fe(II)含量与初始添加的 Fe(II)的浓度基本保持一致,没发生变化;这说明在化学过程中,体系没有Fe(II)的生成。在SRB作用下(T2),游离态Fe(II)含量较快上升,后呈现缓慢增加的趋势,在反应30 d时可生成 2.17 mmol·L−1Fe(II)。添加 2.5 mmol·L−1FeCl2时(T3),反应的前10天游离态的Fe(II)快速增长,后呈现缓慢增加的趋势,最终浓度可高达 5.66 mmol·L−1。然而,CdCl2的存在(T4和 T5)抑制了游离态Fe(II)的生成;相对于未加CdCl2的处理,体系中游离态Fe(II)的含量下降了 10%左右。这些结果与上面硫酸盐过还原的促进或者抑制规律是相一致的,即外加高浓度FeCl2有利于SRB的生长,促进体系游离态 Fe(II)的生成;而 CdCl2的存在则呈现相反的趋势。
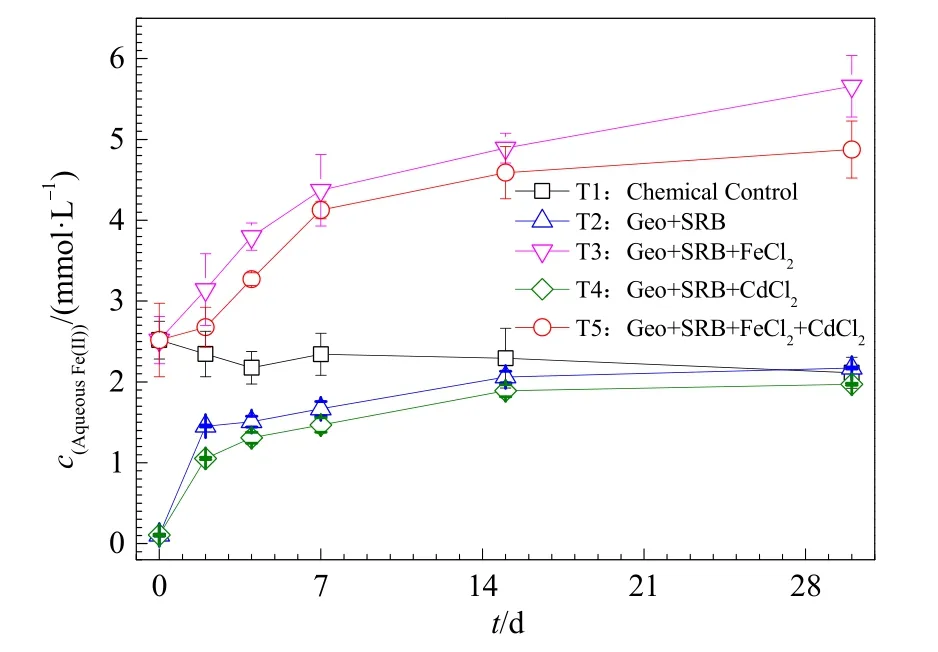
图2 不同反应体系中Fe(II)浓度变化Fig.2 The concentration of aqueous Fe(II) under different conditions
2.3 硫酸盐还原过程中Cd的环境行为
为探究 SRB介导针铁矿表面硫酸盐还原过程中 Cd(II)的赋存状态,本研究同时测定反应过程中游离态和残渣态Cd(II)浓度变化(图3)。在化学对照处理中(T1),体系游离态Cd(II)浓度没有发生显著变化;在反应30 d后,仅10.23%被吸附固定在针铁矿矿物中。这说明在化学作用下,基本没有Cd被固定,90%左右的 Cd以游离态的形式存在体系当中。然而,在SRB的作用下(T4),体系中游离态 Cd(II)浓度随着反应进行呈现快速的下降趋势,在反应 30 d后,其浓度可下降 1.52 mmol·L−1;相对应的,体系中残渣态的 Cd(II)浓度随着反应进行呈现快速的上升趋势,在反应30 d后,其浓度可上升到0.83 mmol·L−1。前人研究指出,在SRB作用下,SO42−可被还原生成S2−与Cd(II)结合形成CdS沉淀(Tan et al.,2018;范文宏等,2008),因此,在本研究中,随着反应进行,游离态 Cd(II)含量降低,残渣态Cd含量上升;反应30 d之后,体系中Cd的去除率可达到50.65%。相类似的,同时添加FeCl2和CdCl2处理中(T5),体系中游离态和结构态Cd(II)浓度随着反应进行分别呈现快速的下降和上升的趋势。相较于不添加FeCl2的处理而言(T4),FeCl2的存在(T5)可提高体系中Cd的固定去除效果;在反应30 d之后,66.89%的游离态Cd(II)可被固定。这与硫酸盐还原动力学趋势是一致的,FeCl2的存在,加速了SRB的硫酸盐还原过程,从而生成更多的S2−与Cd(II)形成 CdS沉淀。此外,S2−的大量生成也促使FeS的生成,而近期研究表明,纳米FeS可与Cd(II)反应,减少土壤中16.6%—40.1%的Cd含量(Liu et al.,2020)。因此,外加FeCl2可促进硫酸盐还原菌和针铁矿交互作用下重金属Cd的固定脱毒。
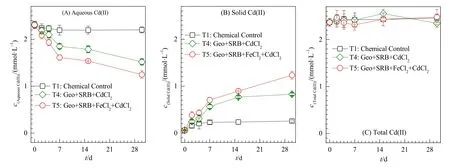
图3 硫酸盐还原过程中游离态、结构态和总Cd(II)浓度变化动力学Fig.3 The concentrations of (a) extracted,(b) solid,and (c) total Cd(II) during microbial sulfate reduction over 30 d
2.4 矿物结构组成变化分析
为进一步确认Cd(II)在SRB作用下的赋存状态以及过程中针铁矿物相转变状态,本研究采用SEM、XRD和XPS等手段,对SRB和FeCl2共同作用下(T5),反应前和反应30 d的固体形貌和结构进行表征,获取体系中铁氧化物结构变化过程以及Cd在固体物种中的赋存形式。由SEM结果(图4)可知,反应前固体形貌呈现针状;在反应之后,固体表面出现几十纳米大小的球状固体,通过与文献对比,为CdS的形貌。XRD图谱(数据未显示)也表明,反应前后矿物图谱中的衍射峰均为针铁矿的特征衍射峰,且具有较高的结晶度,但相对与原始样品而言,反应后晶格参数和晶胞体积都有所改变,且出现CdS的特征衍射锋。XPS结果(图5)显示,反应前,S 2p的峰位在主要位于168.6 eV,表明了反应前S元素主要以 S6+的形式存在;而在反应30 d之后,S 2p的高斯峰位,分别位于161.6、163.1 eV,S元素主要以S2−的形式存在。同时,在反应30 d后,在411.3、404.9 eV出现两个典型的峰位,分别归属于CdS中的Cd2+3 d3/2和Cd2+3 d5/2(Guo et al.,2018),与 Smith et al.(2018)等学者对CdS的XPS分析结果基本相符。以上矿物相貌和结构组成分析均表明游离态 Cd(II)与 S2−结合形成CdS吸附或固定到矿物结构中。

图4 反应前后固体矿物的形貌表征Fig.4 SEM image of solid sample before and after reaction
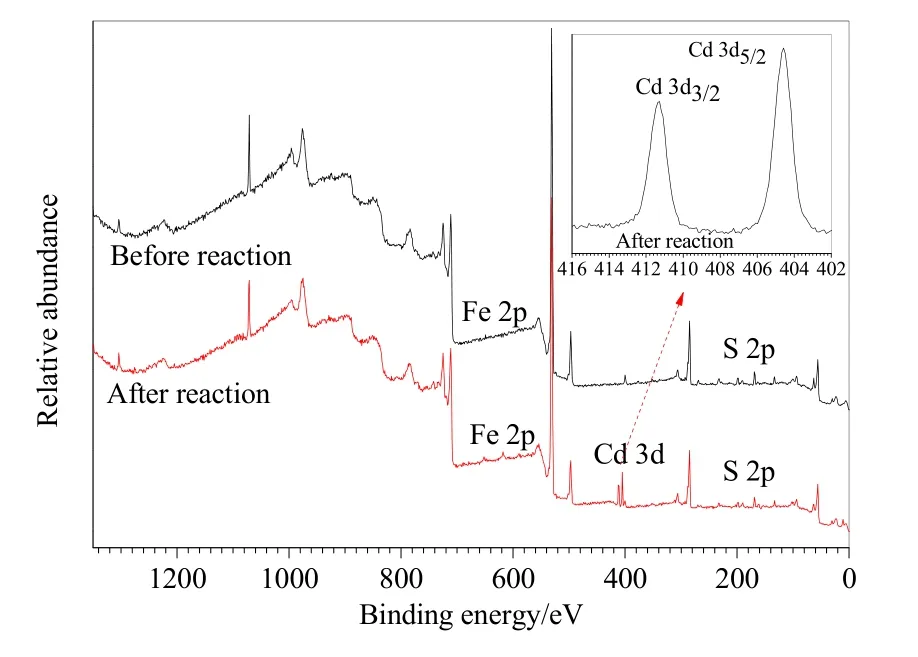
图5 反应前后固体矿物XPS分析图谱Fig.5 XPS spectra solid sample before and after reaction 30 days
2.5 环境意义分析
利用硫酸盐还原菌(SRB)在厌氧条件下将SO42−还原成 H2S,S2−再与游离态重金属 Cd(II)结合形成CdS沉淀,去除/钝化土壤中的Cd污染已成为最具有应用前景和备受关注的重金属Cd污染处理方法(Shan et al.,2019;江峰等,2018;董净等,2019)。然而,土壤中含有丰富的高活性铁氧化物,在厌氧硫酸盐还原过程中,可能同时发生异化铁还原过程。硫酸盐和铁氧化物的共同存在,既可能对SRB产生竞争性利用,也可能存在相互促进的作用,进一步影响SRB作用下Cd的固定行为;关于这方面内容仍缺乏深入的研究。因此,开展SRB和铁氧化物交互作用下重金属Cd固定去除效应的研究具有重要的环境意义。在本研究中,SRB能还原SO42−生成 S2−与 Cd2+结合生成 CdS沉淀,外加的FeCl2可促进SRB的活性,加速硫酸盐还原过程,进一步促进 Cd2+的固定脱毒;同时,反应过程中产生的FeS对S2−与Cd2+反应也有一定的促进作用。这说明了外加铁氧化物或Fe(II)物种能够加速SRB介导硫酸盐还原过程中,增强游离态重金属Cd的固定作用,降低土壤重金属污染风险。但针对多种微生物和多种电子受体(铁氧化物、硫酸盐、硝酸盐、有机质等)的实际土壤环境中,SRB介导的硫酸盐还原过程可能还受到多种因素的影响,后期仍需结合实际环境,开展相关工作。比如通过添加碳源,以提高含有SRB菌团土壤的微生物活性,或者通过添加生物菌剂,促进富含铁氧化物的红壤中硫酸盐氧化还原过程等方式实现Cd的固定。预期为土壤重金属修复和治理提供新的研究思路和数据支撑。
3 结论
本文通过研究 SRB作用下针铁矿界面硫酸盐的还原及 Cd固定脱毒动力学,解析 SRB/针铁矿/Fe(II)物种交互作用下硫酸盐还原耦合 Cd钝化固定的生物地球化学机制。结果发现,在化学对照处理体系中并未发生硫酸盐还原过程,且Cd2+含量基本没有发生变化;在 SRB和针铁矿共同作用下,SRB菌能同时还原 Fe(III)和硫酸根,生成 Fe2+和S2−,形成FeS沉淀,且50.65%的游离态Cd2+可被固定到矿物中;外加FeCl2可刺激SRB的活性,加速S2−的生成,促使体系中的S2−与Cd2+发生反应形成CdS沉淀,从而实现固化脱毒的效果。本研究发现的 Fe(II)物种加速 SRB还原硫酸盐过程耦合Cd(II)固定脱毒的环境行为机制,可为土壤Cd污染原位控制提供了重要的理论依据。

