应用TLC-CMS 技术检测核桃青皮中多酚类化合物
杜京旗,李雪芬,杨卫民
(吕梁林果植物化学省市共建山西省重点实验室培育基地,山西省特色植物功能成分工程研究中心,吕梁学院,山西吕梁 033001)
核桃(Juglans regin L.) 系胡桃科核桃属植物[1]。核桃青皮富含胡桃醌、多酚、黄酮、色素、多糖等多种生物活性成分,具有抗肿瘤、抗氧化、抑菌、消炎等多种保健功能[2]。
水解类植物单宁结构式见图1,缩合类植物单宁结构式见图2。
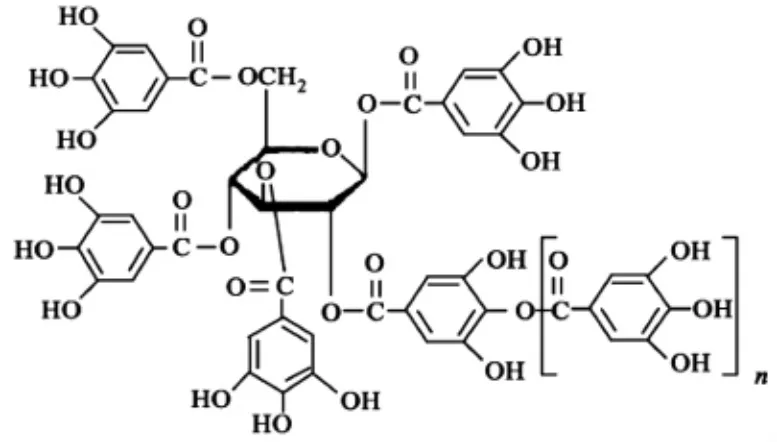
图1 水解类植物单宁结构式
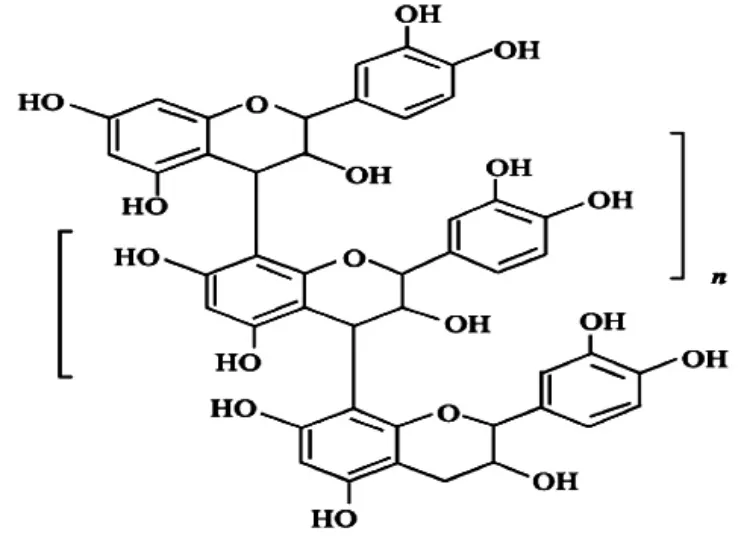
图2 缩合类植物单宁结构式
植物多酚是一类广泛存在于植物皮、木、根、叶及果实中的多羟基酚类化合物,是指分子结构中有若干个酚性羟基的植物成分的总称,包括水解单宁(Hydrolytictannin,HT,酸酯类多酚) 和缩合单宁(Condensedtannin,CT,黄烷醇类多酚或原花色素),其酚羟基结构中的邻位酚羟基很容易被氧化成醌类结构,消耗环境中的氧,同时对活性氧等自由基具有很强的捕捉能力,这使多酚具有较强的抗氧化性和清除自由基的能力[3-4]。大量研究表明,植物多酚具有抗菌、抗氧化、抗癌和抗心血管疾病等疗效,目前在食品、药品和化妆品等行业普遍应用[5-7]。近年来,核桃多酚对肿瘤细胞的抑制作用引起了人们极大的兴趣,使其逐渐成为该领域的研究热点,其机制可能涉及抑制肿瘤细胞的增殖、诱导肿瘤细胞凋亡及细胞因子的产生等,目前研究主要集中在核桃仁、核桃壳及核桃青皮多酚的抗肿瘤效应[8-10]。核桃仁和核桃叶多酚能有效降低血糖,在降血糖天然药物成分的研发中具有重要意义。研究发现核桃仁乙醇提取物具有较好的α - 葡萄糖苷酶抑制活性,对糖尿病有一定的防治作用[8]。核桃青皮中含有丰富的 5 - 羟基-1,4- 萘醌、山奈酚、槲皮素等酚类物质,其抗菌及抗肿瘤效果显著。
目前植物多酚的提取方法有萃取法[11]、超临界流体萃取(SCF) 法[12]、超声波浸提法[13]、微波浸提法[14]等。分离纯化的方法主要采用沉淀分离、超滤和层析分离法等[15]。植物多酚作为一类储量十分丰富、具有较强生物活性的天然化合物,对人类的健康起着重要的作用。进行植物多酚提取分离及检测方法的研究,开发安全、高效的天然抗氧化剂,以及能防治肿瘤、心脑血管等疾病的多酚保健食品,可以创造出较高的经济效益。试验以75%的甲醇为提取剂,多级萃取法结合微波超声波组合萃取仪辅助处理后从核桃青皮中获得多酚类化合物提取物,用TLC-CMS 等技术对其进行检测和表征。应用Plate ExpressTM 技术可直接从TLC 薄层板上获取质谱图,其优点是不经过样品前处理,可快速从复杂混合物中获得目标物分子质量信息,并对其进行鉴定。
1 材料与方法
1.1 材料、试剂及主要仪器
材料:核桃青皮、叶、枝条,采集于吕梁当地。
试剂:甲醇、石油醚、氯仿、苯、甲苯、丙酮、甲酸、冰乙酸、乙酸乙酯、盐酸、山奈酚、环己烷。
主要仪器:ALB-224 型电子天平,赛多利斯科学仪器有限公司产品;XH-300B 型微波-超声波组合合成/萃取仪,北京祥鹄科技发展有限公司产品;KH-3000Plus 型薄层色谱仪,上海科哲生化科技有限公司产品;Expressions 质谱仪和Plate ExpressTLC-质谱接口,美国Advion 公司产品;Tensor-11 型傅里叶红外光谱仪,德国布鲁克公司产品。
1.2 核桃青皮中多酚类化合物提取
按料液比1∶30 进行浸提(加75%甲醇),用超声波微波萃取仪分3 个阶段提取,每阶段10 min,共30 min。在超声波恒定的条件下,设置温度为45,50,55 ℃;超声功率为800,850,900 W;微波功率为100,200,300 MHz;超声频率为50 kHz,模式15∶10,电机转速900 r/min。
提取液以转速4 000 r/min 离心10 min,3 次,合并上清液,在65 ℃下浓缩至1/4 体积时为止。2%盐酸调pH 值至2~3,用等量的石油醚除杂,3 次,再用等量的氯仿萃取3 次,浓缩后用色谱醇定容至10 mL。
1.3 薄层色谱分离纯化
用内径<1 mm 的管口平整的毛细管在活化硅胶板上进行点样,展开剂湿润展开缸20 min 左右,将已点样的薄层板放入展开缸中,当展开剂上升到薄层板的前沿(离前端5~10 mm) 时取出,将薄层板平放晾干后于薄层成像系统中观察[16]。并计算Rf 值。
1.4 红外光谱检测
将仪器和软件打开使其处于工作状态,测量单通道背景光谱,然后将样品用毛细管点样至光学台的金刚石上,再进行单通道样品光谱的测量。然后将检测出来的光谱转换成倒峰,选择单峰检索标出每一个特征峰,分析并保存图谱[17]。每一个样品测量后,都需要进行谱图处理,如进行气氛补偿,可消除 CO2、H2O 的干扰。
1.5 质谱分析
1.5.1 标准品的质谱检测
用色谱甲醇和超纯水作为流动相。将仪器和软件打开使其处于工作状态,用微量进样器吸取10 μL的山奈酚标准品溶液插入到进样口处,打到load 档开始进样,进完样后打回到inject 档。点开界面对谱图进行分析,并保存。
1.5.2 待测液的质谱检测
流动相与待测标准品的流动相相同。将仪器和软件处于工作状态,把待测品薄层板置于TLC-质谱接口上,使激光对准圈出的山奈酚标准品斑点中心处。用软件操作进行取样,30 s 后获得质谱图,通过界面对谱图进行分析,并保存。
1.6 熔点、旋光度分析
物质的熔点(melting point),即在一定压力下,纯物质的固态和液态呈平衡时的温度。用熔点仪对提取的物质熔点进行检测。使用熔点仪时,首先将提取的样液放入蒸发皿中,在电热板上蒸发结晶成为固体,然后将固体放入一端封口的毛细管中,插入熔点仪中,按照下图调节适当的电压来升温,当固体变为固液平衡的状态时温度计显示的温度即为该物质的熔点。
2 结果与分析
2.1 核桃青皮提取率
核桃青皮多酚类和醌类的总提取率见表1。
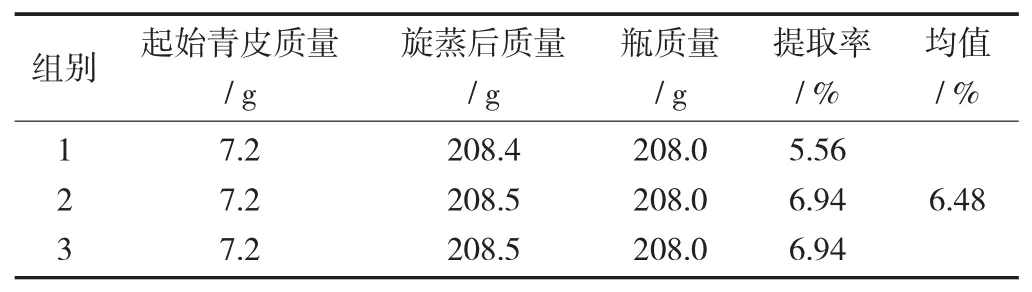
表1 核桃青皮多酚类和醌类的总提取率
2.2 薄层色谱分离纯化
核桃青皮氯仿相TLC 成像图见图3,核桃青皮、嫩叶、陈叶和嫩枝氯仿相TLC 成像图见图4,核桃不同部位氯仿相与标准品的TLC 成像图见图5。
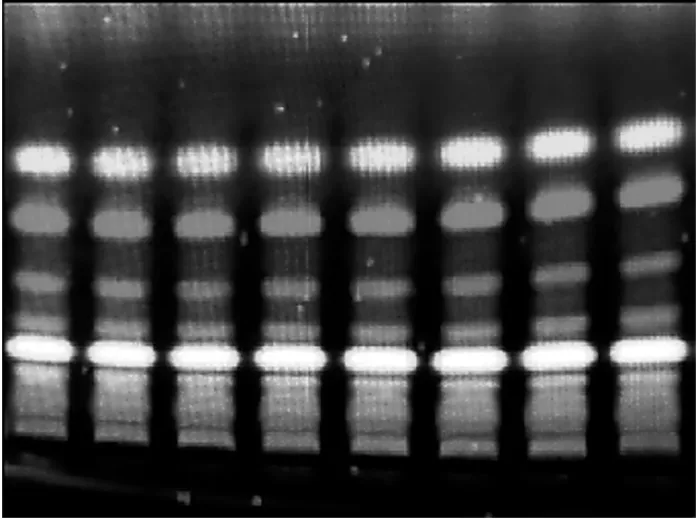
图3 核桃青皮氯仿相TLC 成像图

图4 核桃青皮、嫩叶、陈叶和嫩枝氯仿相TLC 成像图
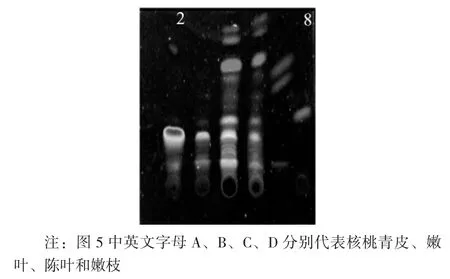
图5 核桃不同部位氯仿相与标准品的TLC 成像图
由图4 可以看出,在甲醇,氯仿,苯,石油醚(1∶10∶1∶3,V/V) 下,核桃青皮氯仿相展开效果良好,色谱斑点图像清晰,斑点之间距离适中,无拖尾现象发生。查阅文献分析可知,核桃青皮氯仿相中有酚类物质和醌类物质。
从图5 可以看出,在甲醇、氯仿、苯、石油醚(1∶10∶1∶3,V/V) 下,核桃不同部位氯仿相全部展开。通过对比可知,核桃青皮和新叶中酚类和醌类物质比较丰富,旧叶和嫩枝中成分较少。
核桃陈叶和嫩叶氯仿相显色前TLC 成像图见图6,核桃陈叶和嫩叶氯仿相显色后TLC 成像图见图7。
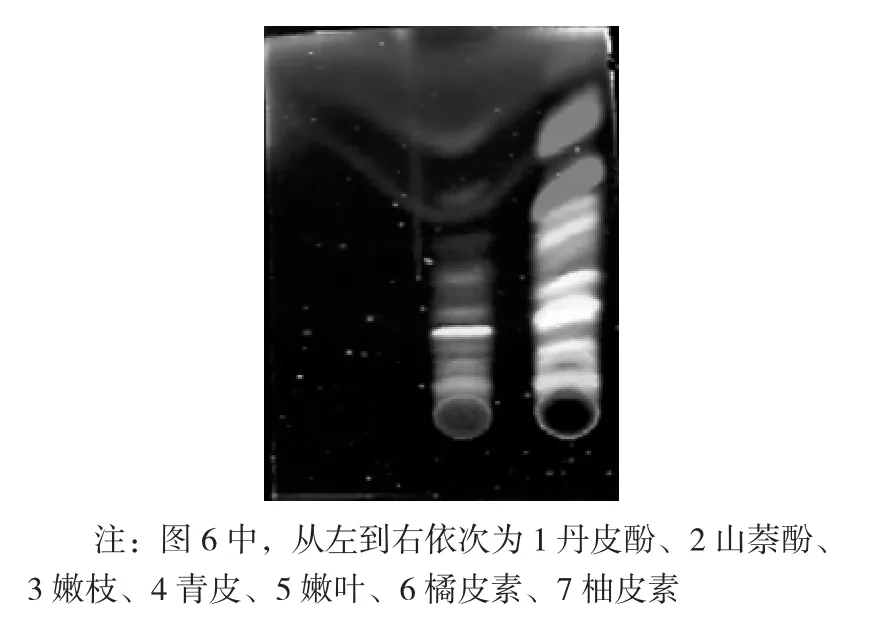
图6 核桃陈叶和嫩叶氯仿相显色前TLC 成像图
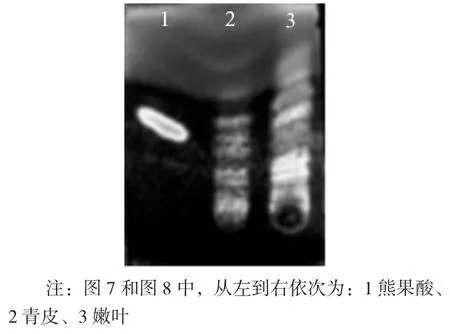
图7 核桃陈叶和嫩叶氯仿相显色后TLC 成像图
从图6 可以看出,以甲苯∶丙酮(5∶1,V/V)为展开剂,核桃不同部位氯仿相完全展开,效果各异,但色谱斑点较为清晰。可初步确定核桃嫩枝、青皮、嫩叶、氯仿相中含有与山奈酚、橘皮素和柚皮素极性大致相同的物质。
从图7 和图8 可以看出,核桃陈叶、嫩叶和熊果酸在甲苯∶丙酮(5∶1,V/V) 下完全展开、色谱斑点较为清晰,但显色前未见熊果酸的色谱斑点,用10%硫酸乙醇显色后各部分色谱斑点清晰。样液与熊果酸相同的位置有条带,可初步断定核桃叶中含有与熊果酸极性大致相同的物质。
从图6、图7 和图8 可以看出,核桃不同部位含有与山萘酚、橘皮素、柚皮素和熊果酸极性相近的物质,但要获得准确结果需要通过对其质谱图和红外光谱图进行分析。
下面以山萘酚对照品为例进行分析。
2.3 核桃青皮中多酚类物质的质谱检测与分析
将所提取的样品与标准品对照看是否有相同的碎片,若有相同碎片,即可初步断定所提取的物质为多酚类物质。
山奈酚标准品质谱图见图8。

图8 山奈酚标准品质谱图
从图8 可以看出,山奈酚标准品的荷质比为229,有55,129,143,这几个碎片。与相关文献山奈酚的质谱图有相同的碎片峰,不同的是山奈酚的相对分子质量为286。原因可能是,质谱分析中会出现碎片丢失现象,标准品用甲醇溶解,含有羟基较多,打碎片的过程中很有可能出现羟基丢失。而多酚类化合物也含有羟基,羟基丢失造成相对分子质量减少。
核桃青皮色谱斑点A 的质谱图见图9。
抠取图5 中色谱斑点A,进行质谱检测。从图9可以看出,色谱斑点A 质荷比为229,与山奈酚标准品都有55,129,143 碎片峰,基本可以断定斑点A 是山奈酚。
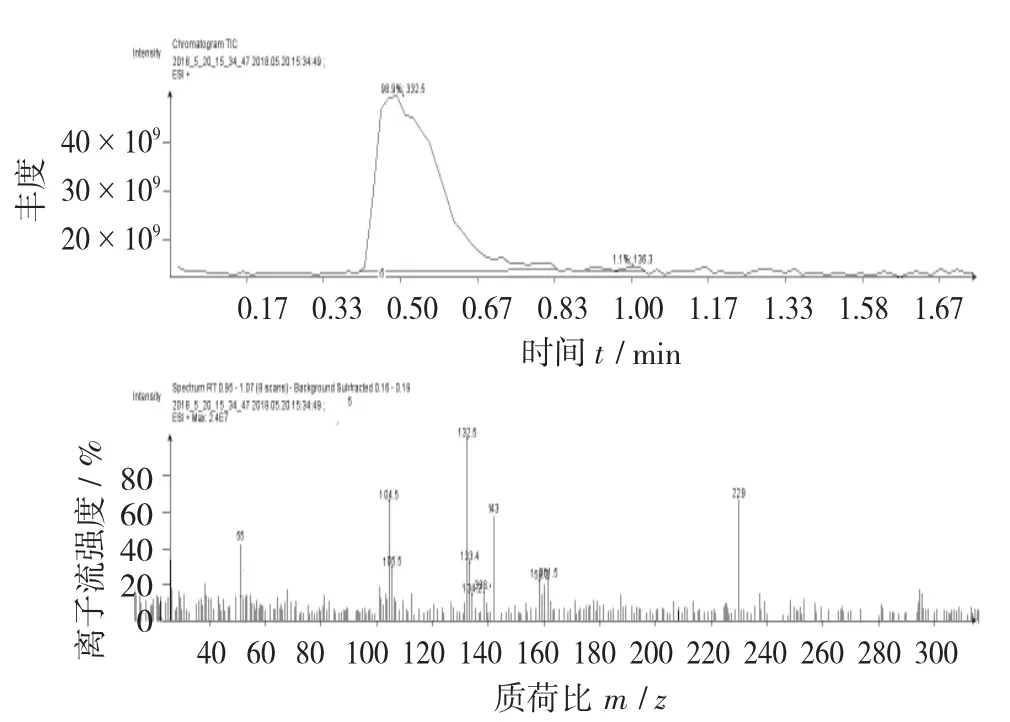
图9 核桃青皮色谱斑点A 的质谱图
核桃青皮色谱斑点B 的质谱图见图10。
抠取图5 中色谱斑点B,进行质谱检测。从图10 可以看出,色谱斑点B 质荷比为333,与山奈酚标准品均出现129,143,229 的碎片峰,与山奈酚标准品的质荷比229 相差4,可以基本得出斑点B 也为多酚类物质。
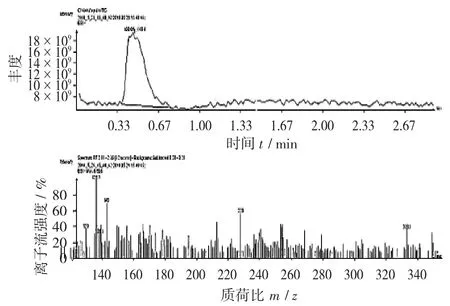
图10 核桃青皮色谱斑点B 的质谱图
核桃青皮色谱斑点A 和B 均具有多酚类物质的分子离子峰,且碎片峰也基本一致。
2.4 核桃青皮中多酚类物质的红外光谱检测与分析
经查阅文献可知,“酚醇羟基易缔合,3 300 cm-1处有强峰”。苯环在1 500~1 800 cm-1处有强吸收峰,羟基(O-H) 在3 000~3 800 cm-1处有强吸收峰,羰基(-C=O-)在1 000~1 600 cm-1处会出现峰。因此,多酚类化合物的红外出峰的位置在3 000~3 600 cm-1,1 000~1 800 cm-1之间会出峰。
山奈酚标准品红外光谱图(固态) 见图11。
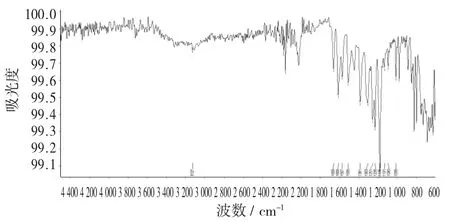
图11 山奈酚标准品红外光谱图(固态)
从图11 可以看出,山奈酚对照品固体红外光谱检测发现,在3 127 cm-1和1 175 cm-1两处出现了强峰,这之间还出现了一些小峰,与文献查阅结果一致。
山奈酚标准品红外光谱图(液态) 见图12。
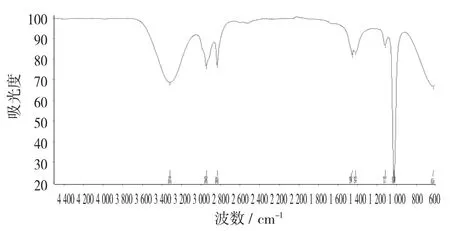
图12 山奈酚标准品红外光谱图(液态)
从图12 可以看出,山奈酚标准品(1 mg/mL)红外检测发现,在3 301,2 326,2 326,1 636,1 604 cm-1处出现强峰,在查阅文献的范围内,由于标准品的溶剂是色谱醇。因此,羟基峰更为明显一些。
核桃青皮斑点A 红外光谱图见图13。
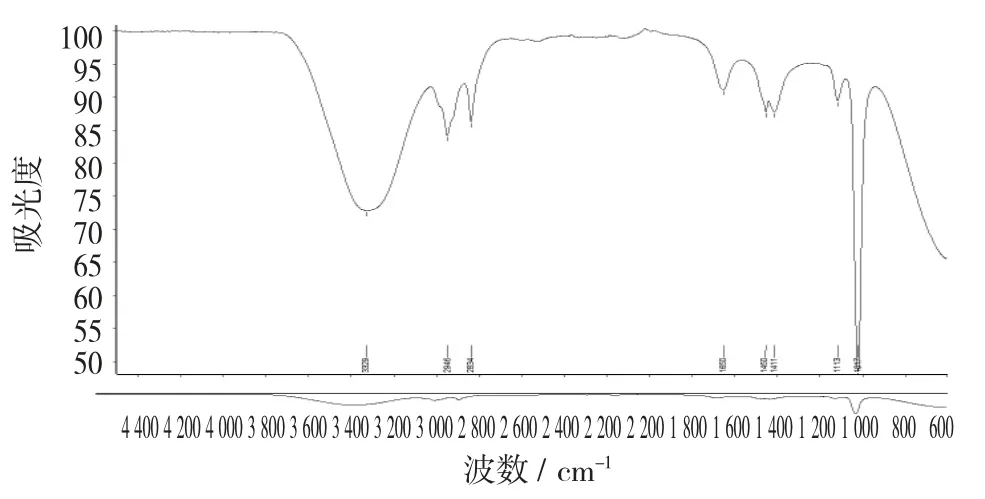
图13 核桃青皮斑点A 红外光谱图
将从薄层板上刮下斑点A 用色谱醇溶解、过滤、定容到3 mL。
从图13 可以看出,与山奈酚标准品比对,斑点A 的光谱图几乎相同的位置出现强峰,说明与山奈酚标准品所含官能团一致,初步断定该物质是山奈酚。
核桃青皮斑点B 红外光谱图见图14。
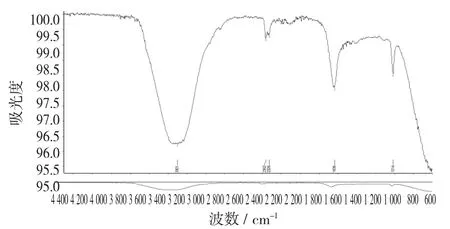
图14 核桃青皮斑点B 红外光谱图
将从薄层板上刮下斑点B 用色谱醇溶解、过滤、定容到3 mL。
从图14 可以看出,斑点B 与山奈酚标准品出现强峰的位置基本相同,说明与山奈酚标准品所含官能团基本一致,可初步断定斑点B 是与山奈酚结构相似的多酚类化合物。
综上所述,核桃青皮氯仿相中含有苯环、羟基、羰基等多酚类化合物含有的官能团,结合质谱检测结果,可以确定提取的物质为多酚类化合物。
2.5 核桃青皮中多酚类物质含量测定
山奈酚标准品光谱扫描图见图15。
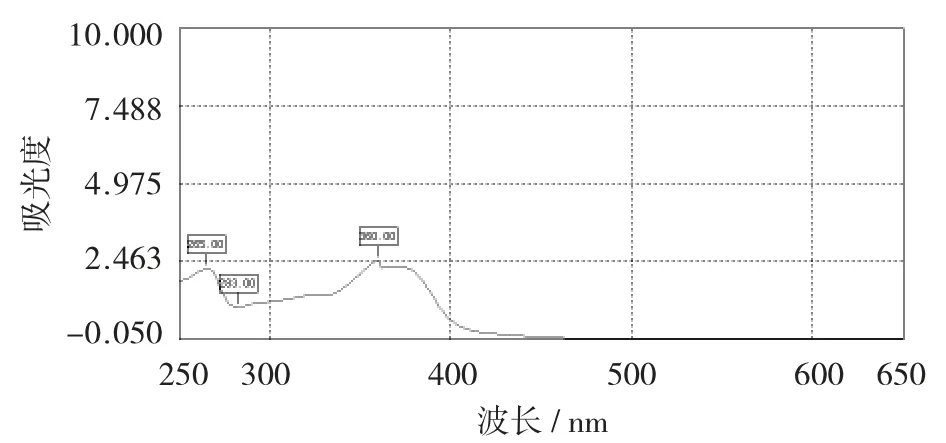
图15 山奈酚标准品光谱扫描图
从图15 可以看出,在0.02 mg/mL 下对山奈酚标准品进行光谱扫描,于波长360 nm 处出现了最大吸收峰。
配制0.01 mg/mL 山奈酚标准品标准溶液,稀释为质量浓度梯度为 0.02,0.025,0.03,0.035,0.04 mg/mL,根据其吸光度绘制标准曲线。
山奈酚标准品标准曲线及含量见图16。
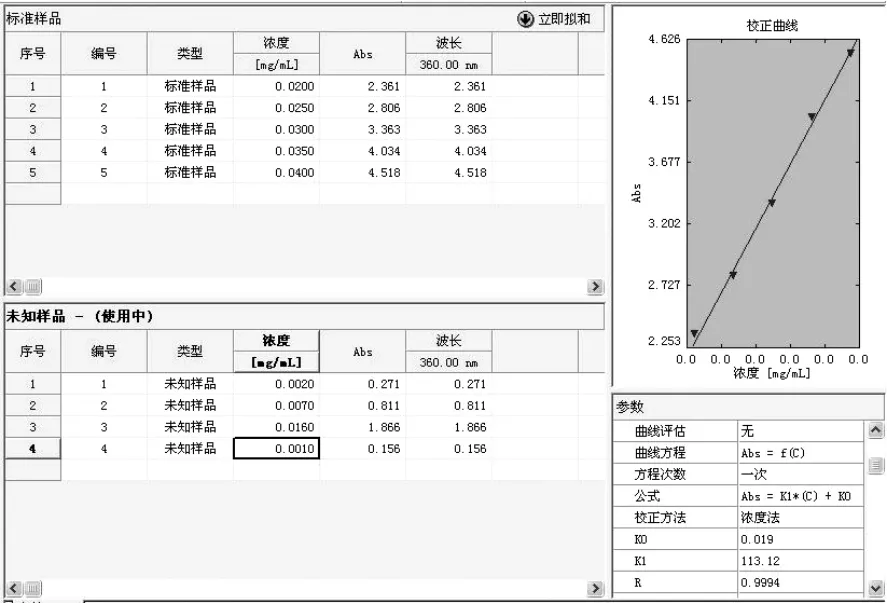
图16 山奈酚标准品标准曲线及含量
图16 为山奈酚标准品的标准曲线图,即Abs=113.12c+0.019 (R=0.999 4)。
将核桃青皮色谱斑点A 和B 溶解、过滤,用色谱醇定容到3 mL 后进行浓度的测量,结果显示,从7.2 g 核桃青皮中提取该物质0.06 mg。
核桃青皮中山奈酚含量见表2。

表2 核桃青皮中山奈酚含量
2.6 熔点、旋光度结果分析
经薄层分析后,确定出多酚类物质的荧光斑点,用色谱醇溶解后成为样液,将样液进入全自动旋光仪中进行旋光度和比旋光度的测定。将样液蒸发结晶,再进入熔点仪测熔点。
核桃青皮中山奈酚的熔点见表3,核桃青皮中山奈酚的旋光度见表4。
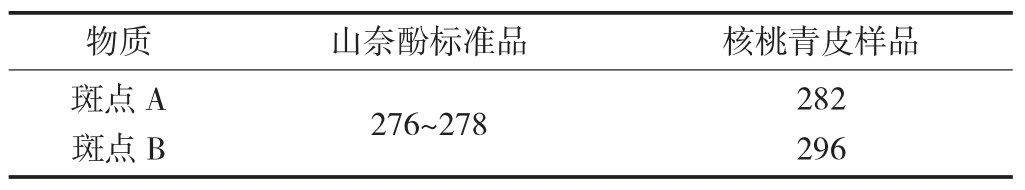
表3 核桃青皮中山奈酚的熔点 ℃
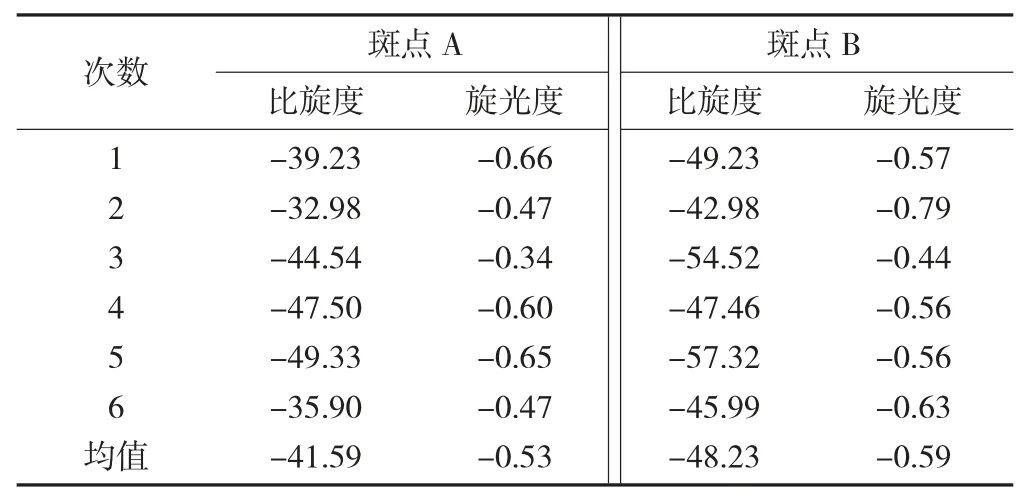
表4 核桃青皮中山奈酚的旋光度
3 结论
以75%甲醇作提取剂,料液比1∶30,用超声波微波萃取仪分3 个阶段提取,每阶段10 min,共30 min。在超声波恒定的条件下,设置温度为45,50,55 ℃;超声功率为800,850,900 W;微波功率为100,200,300 MHz;超声波频率为50 kHz,模式15∶10,电机转速900 r/min。多级萃取后获得氯仿相,多酚类和醌类总提取率为6.48%。
在甲醇∶氯仿∶苯∶石油醚 (1∶10∶1∶3,V/V)下,核桃青皮、嫩叶、陈叶和嫩枝展开效果良好,色谱斑点图像清晰,无拖尾现象发生。与标准品比对发现,核桃不同部位中含有与山萘酚、橘皮素、柚皮素和熊果酸极性相近的物质。
质谱检测发现,核桃青皮色谱斑点A 和B 的质谱图与山奈酚标准品的图形几乎一致,分子离子峰基本相同,且出现的离子碎片峰很接近;斑点A 和B 的红外光谱图与山奈酚标准品几乎在相同的位置出现强峰,说明核桃青皮氯仿相中含有苯环、羟基、羰基等多酚类化合物的官能团;斑点A 和B 的熔点(282 ℃;296 ℃) 在山奈酚标准品的276~278 ℃范围内或附近,旋光度和比旋度分别为-0.53 和-59;-41.59 和 -59.00 范围内。
经多次尝试,确定核桃叶和枝最合适的展开剂为:乙酸乙酯∶甲苯∶甲酸=10∶8∶1(0.5 mL 冰乙酸可在一定程度上防止拖尾)。
TLC 对不同物化特性的溶剂体系和多样性的操作条件,具有较强的适应性,为从复杂的天然产物粗制品中提取不同特性(如不同极性) 的有效成分提供了有利条件。TLC 在核桃青皮生物活性物质分离纯化中具有操作简便、容易掌握、回收率高、重现性好、分离效率高、分离量较大等特点,且能够获得较高的提取率[18-19]。因此,TLC 有望在标准品的制备、天然产物化学成分研究及新药研发等领域得到更广泛的应用。
TLC 从核桃青皮中制备多酚类物质需要做进一步的表征分析。傅里叶红外光谱仪可以准确分析有机物中的官能团,多酚类物质的酚羟基在3 000~3 500 cm-1处有强吸收峰,提取物含有酚羟基,是多酚类化合物。质谱仪可以直接检测其相对分子质量,与标准品的质谱图进行比对,可确定提取物为多酚类化合物。试验过程中,红外检测出现的问题比较多。例如,样品中出现了和甲醇相似的特征峰,分析其原因可能是由于定容时甲醇的量过大;样品中所提物质的含量较少等原因。
如果不是纯的物质,熔点差异就会比较大。核桃青皮中含有丰富的多酚类化合物,所以与单一标准品的熔点差异比较大;同类物质虽然含有相同的官能团,但是由于结构有较大的差异,其旋光度也会有所不同。
Plate ExpressTM 技术可直接从TLC 薄层板上获取质谱图,其优点是不经过样品前处理,可快速从复杂混合物中获得目标物分子质量信息,并对其进行鉴定。

