基于化学模式分析的前胡栽培群体质量特征研究
徐 广,谭秋生,郭 瑀,罗 敏,邓才富,任星宇
重庆市药物种植研究所 中药材生产质量控制研究中心,南川 408435
中药前胡为伞形科植物白花前胡PeucedanumprasrupterumDunn.的干燥根,具有降气化痰、疏散风热等功效。临床多用于外感风热、痰热喘咳、风热咳嗽等症[1]。现代研究表明,前胡主要的药理作用为钙通道阻滞、降血压、抗心律、平喘、抗癌等[2-4],其主要药用活性成分为白花前胡甲素、白花前胡乙素等香豆素化合物[5,6]。传统前胡药材主要源于野生资源,随着生物医药产业的发展,市场对前胡药材的需求急剧增加,野生药材已不能满足现有市场需求,近年来,在安徽、重庆等地已有大范围人工种植[7]。栽培品增加的同时,药材品质出现良莠不齐、差异极大,多数药材指标成分含量不达标[8-12],影响治疗效果。
项目团队在前胡质量提升栽培技术研究过程中,调查发现各地栽培品质量差异极大,特开展了群体质量特征的研究,通过采挖同一栽培小区的样品,建立HPLC指纹图谱,采用测定双指标成分含量与聚类分析、PCA等分析方法相结合全面地评价前胡的质量差异性,分析其栽培群体质量特征,对于前胡的质量构成特征和资源利用有重要意义,同时为前胡药材的品质评价和良种选育提供理论基础。
1 材料与仪器
1.1 仪器
岛津LC-20AT高效液相色谱仪:包括LC solution色谱管理处理软件、CTO-20A柱温箱、SIL-20A自动进样器、SPD-M20A二极管阵列检测器、日本岛津Shim-pack VP-ODS色谱柱(4.6 mm×0.5 μm×250 mm)、CBM-20Alite系统控制器;METTLER AL104型电子天平(梅特勒-托利多仪器(上海)有限公司);CPA225D型电子天平(赛多利斯科学仪器(北京)有限公司);Molecular标准智能型纯水机(上海摩勒科学仪器有限公司),KQ-1000DE型数控超声波清洗器(昆山市超声仪器有限公司);DHG电热恒温鼓风干燥箱(上海龙跃仪器有限公司)。
1.2 材料
前胡样品均采自重庆市药物种植研究所位于重庆市南川区三泉镇槐坪种植基地,由项目团队自己种植管理,经重庆市药物种植研究所邓才富研究员鉴定为P.praerupterumDunn.正品白花前胡。试验材料分两组采样,一组进行单株采样,挖取完整植株,剔除个体量过小的植株,剪取商品部位,去除泥沙清洗干净,40 ℃烘干,切片粉碎过60目,依次编号S1~S18;一组进行混合取样20株,不分大小,剪取商品部位,去除泥沙清洗干净, 40 ℃烘干,切片、粉碎过60目,编号S19。所有样品保存于重庆市药物种植研究所质量控制研究中心样品保管室。
1.3 试剂
甲醇(色谱纯,批号20190901)、三氯甲烷(分析纯,批号20120702)均购自重庆川东化工(集团)有限公司;水:为临用现制的超纯水;白花前胡甲素(批号111711-201904)、白花前胡乙素对照品(批号111904-201804)均购自中国食品药品检定研究院。
2 方法与结果
2.1 对照品溶液制备
精密称取白花前胡甲素、白花前胡乙素对照品适量,加甲醇制成每1 mL各含白花前胡甲素73.0 μg、白花前胡乙素79.8 μg的混合溶液,即得。
2.2 供试品溶液制备
取前胡样品粉末(过60目)约0.5 g,精密称定,置250 mL具塞锥形瓶中,精密加入三氯甲烷25 mL,密塞,称定重量,超声处理(功率400 W,频率40 kHz)15分钟,放冷,再称定重量,用三氯甲烷补足减失的重量,摇匀,滤过;精密量取续滤液5 mL,蒸干,残渣加甲醇溶解并转移至25 mL量瓶中,加甲醇至刻度,摇匀,用0.45 μm微孔滤膜滤过,即得。
2.3 色谱条件
采用Shim-pack VP-ODS色谱柱(4.6 mm×0.5 μm×250 mm),以甲醇-水(75∶25)为流动相,洗脱时间40 min,流速1 mL/min,检测波长为321 nm,柱温25 ℃,进样量10 μL。
2.4 方法学考察
2.4.1 精密度试验
精密称取样品,按供试品溶液制备法制备,连续进样6次,测定,计算。白花前胡甲素和乙素峰面积的RSD分别为1.29%、0.69%。
2.4.2 重复性试验
精密称取同一样品,按供试品溶液制备法制备6份,测定,计算。白花前胡甲素和乙素峰面积的RSD分别为0.26%、0.43%。
2.4.3 稳定性试验
精密称取样品,按供试品溶液制备法制备,分别在0、3、7、13、24 h进样5次,白花前胡甲素和乙素峰面积的RSD分别为0.15%、0.09%。
2.4.4 线性试验
对照品溶液分别进样2.0、5.0、8.0、10.0、12.0、15.0、18.0 μL,以进样量为X,峰面积为Y进行线性方程计算,白花前胡甲素线性方程为y= 339 815x-44 889,R2=0.995 5;白花前胡乙素线性方程为y=273 907x-33 865,R2=0.995 5。具有良好的线性关系。
2.4.5 加样回收试验
精密称取已知含量的前胡样品适量,共6份,置250 mL具塞锥形瓶中,分别精密加入一定量的白花前胡甲素、乙素对照品溶液,按照“2.2”法制备,并测定,计算回收率,甲素平均回收率103.81%,RSD:1.52%;乙素平均回收率105.09%,RSD:0.76%(见表1)。
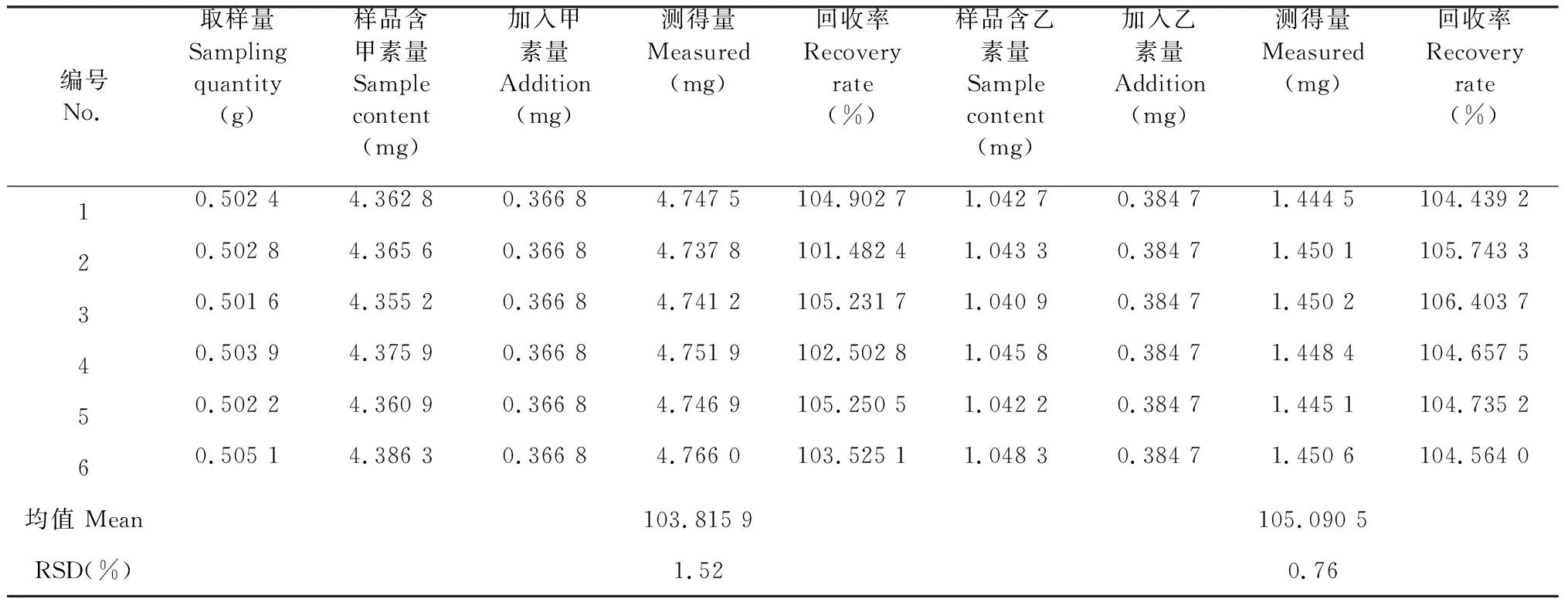
表1 白花前胡甲素、乙素加样回收率试验结果
2.5 数据处理方法
应用Excel 2010、GraphPad Prism 8、Origin 8等软件进行数据分析、处理及相关图表绘制,以中药色谱指纹图谱相似度评价系统(2012版)进行相似性分析,提取共有色谱峰面积导入SIMCA 14.1进行系统聚类分析(HCA)、主成分分析(PCA)和正交校正的偏最小二乘分析(OPLS),进而筛选差异性标志物。
2.6 双指标成分含量特征分析
由图1得知,18个单株样品中白花前胡甲素达标11个,白花前胡乙素达标5个(S5、S6、S7、S10和S11),双不达标2个(S13和S17),无双达标样品。甲素含量极大值为极小值的3.76倍,乙素含量极大值为极小值的9.7倍。同时发现甲素高,乙素就低;甲素低,则乙素高;呈负相关性。而18个样品甲素和乙素的均值为1.15%和0.24%达到药典要求的0.9%和0.24%。通过甲素和乙素比值(A)、乙素和甲素比值(B),分析其质量特征,其趋势如图2所示。由图中发现,乙素含量高的S5、S6、S7、S10和S11五个样品的A和B数量特征较为接近;其余样品的A和B数量特征较为接近,表明白花前胡群体质量特征变化差异大。全小区混合取样(S19)的指标成分含量分别为1.278%和0.293%。

图1 19批前胡双指标含量特征Fig.1 Content characteristics of double index in 19 batches of P.prasrupterum
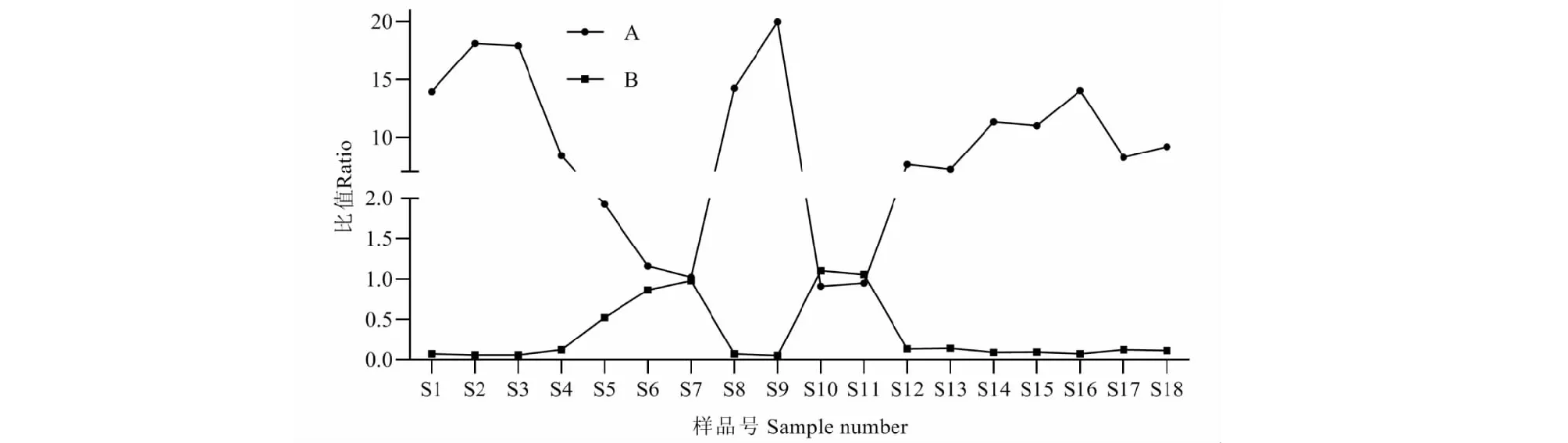
图2 18批前胡单株双指标比值图Fig.2 Two-index ratio chart in 18 batches of P.prasrupterum注:A:甲素/乙素,B:乙素/甲素。Note:A:Praeruptorin A/praeruptorin B;B:Praeruptorin B/praeruptorin A.
2.7 谱图相似性和化学模式识别
2.7.1 相似度分析
取收集的19批前胡样品按“2.2”项方法制备供试品溶液,按“2.3”项色谱条件进行测定,得到19批样品HPLC指纹图谱,并导入《中药色谱指纹图谱相似度评价系统2012版》软件,以S1图谱作为参照谱图,采用中位数法,多点校正、自动匹配生产共有峰6个。321 nm检测波长下的图谱叠加图如图3。根据18批样品的HPLC检测结果,具有6个共有特征峰,采用对照品对其2个共有峰进行了指认,分别为白花前胡甲素(峰2)和白花前胡乙素(峰5)(见图4)。计算不同单株样品之间与对照谱图(R)的相似度见图5。结果表明,18批前胡单株样品相似度在0.648~0.999。相对于R,其中S5、S6、S7、S10、S11相似度较低,分别为0.948、0.879、0.827、0.753和0.823,其他样品的相似度均在0.965~0.989之间。说明前胡不同植株类型间内在质量差异较大,植株类型表现丰富,有利于种质资源的挖掘利用。图5前胡指纹图谱相似度热图可较为直观地反应植株类型间指标成分的较大差异。
图3 19批前胡和对照谱图匹配图Fig.3 HPLC fingerprints of 19 batches of P.prasrupterum

图4 标准指纹图谱(A)与对照品HPLC图(B)Fig.4 Reference fingerprint of 18 batches of P.prasrupterum(A) and HPLC chromatogram of reference substances(B)注:2.白花前胡甲素;5.白花前胡乙素。Note:2.Praeruptorin A;5.Praeruptorin B.
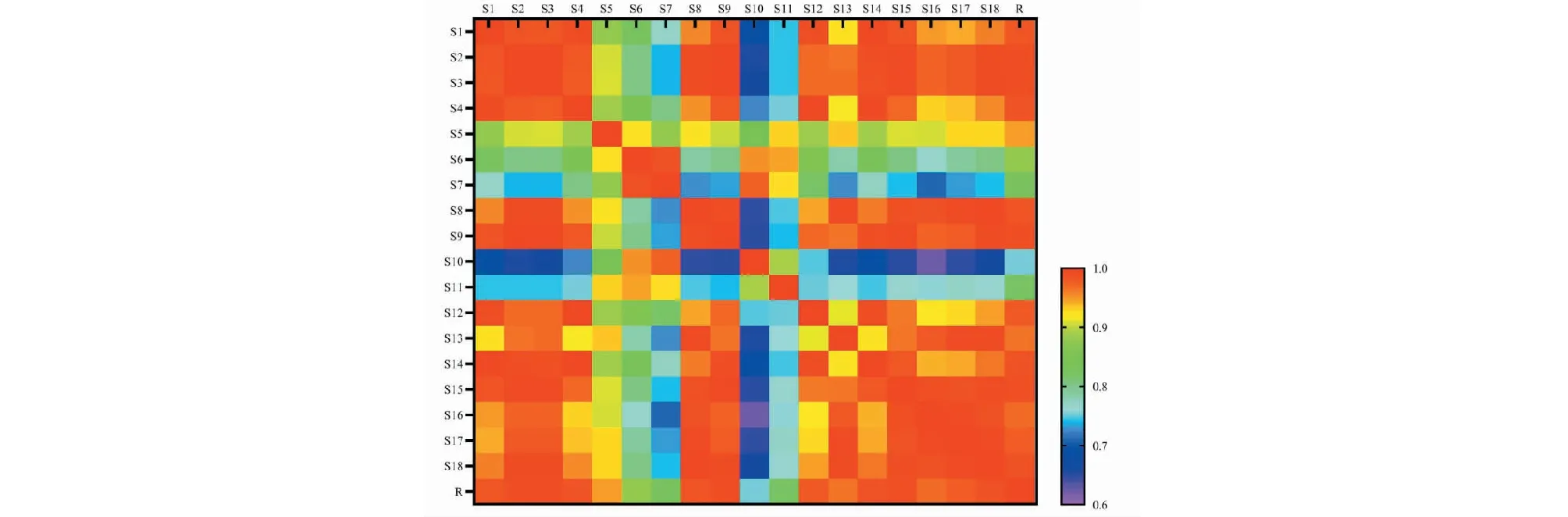
图5 前胡指纹图谱相似度热图Fig.5 Heat map of fingerprint similarty from P.prasrupterum
2.7.2 化学模式识别
考虑到相似度分析中不同植株间差异太大,进一步开展化学模式分析,掌握前胡植株类型的丰富程度和内在质量形成规律,为生产中质量稳定性控制提供技术支撑。
2.7.2.1 HCA分析
将18个白花前胡单株样品的6个共有峰的相对峰面积数据输入SICMA 14.1软件,对样品进行HCA分析。通过HCA分析得聚类树状图见图6,18个样品聚为两类,S5、S6、S7、S10、S11、S13和S17这7个植株类型聚为一个大类;而其他的11个前胡植株类型又聚为一个大类。
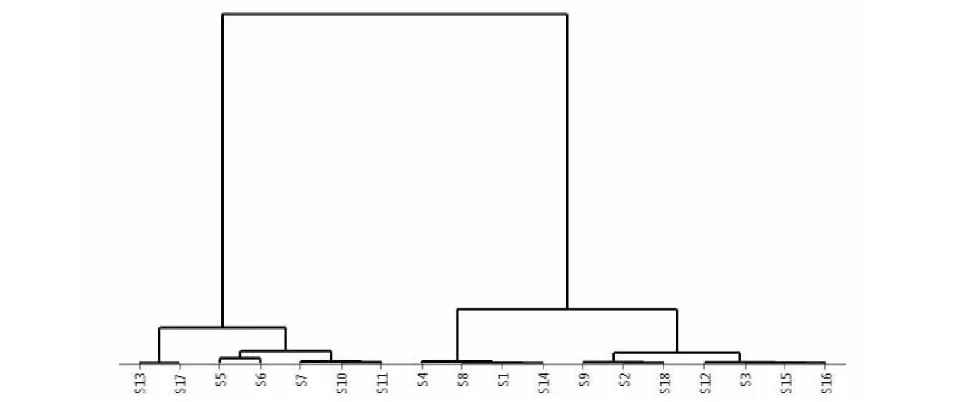
图6 前胡的聚类分析树状图Fig.6 Cluster analysis of P.prasrupterum
结合双指标质量特征分析结果可以发现,聚类分析所得两个大类以前胡甲素含量是否达标进行了明显分异。前胡甲素不达标的聚类中除S13和S17两个类型为双不达标外,其余5个类型的前胡乙素都远远地高于药典标准,其中有4个甚至超过了一倍;而其余11个植株样品形成的大类中,虽然前胡甲素含量达标,但有8个植株类型的乙素指标还不及药典要求的50%。
2.7.2.2 PCA分析
为了更为客观、直接的阐明前胡质量特征的差异性,利用SICMA 14.1软件对其共有峰数据进行PCA分析,其得分图可以提供可视化的前胡分类图。将18个白花前胡的HPLC图谱共有峰面积导入SICMA 14.1软件,经归一化处理后进行PCA分析,其R2X为0.999,Q2为0.787,表明模型稳定,预测能力强,结果如图7所示。
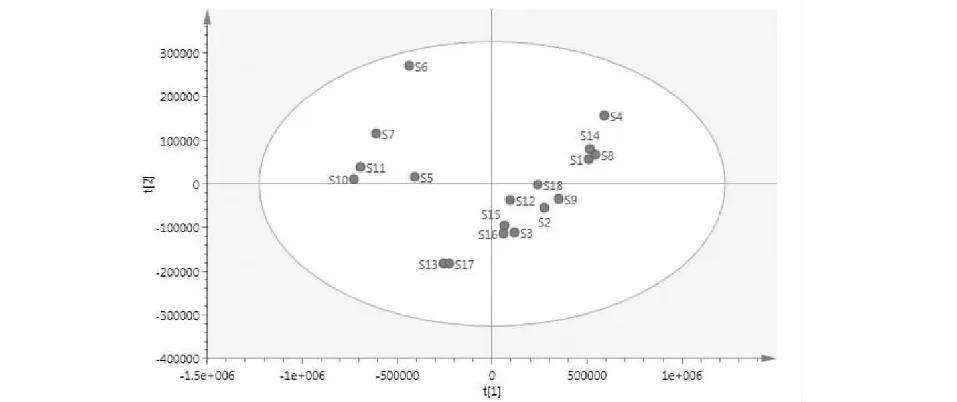
图7 PCA得分图Fig.7 PCA score scatter plot
由图7可知,18个白花前胡样品区分良好,S13和S17为一类;S5、S6、S7、S10和S11为一类;S1、S4、S8和S14聚为一类;S2、S3、S9、S12、S15、S16和S18聚为一类。表明18个白花前胡样品的质量差异性较大。同时也验证了前面聚类分析结果的可靠性。
2.7.2.3 OPLS分析
为了更好地解释样品组间差异性,找到组间贡献率较大的共有峰,对其数据进行OPLS分析得到散点图(图8)、VIP值图(图9)和载荷散点图(图10)。结果显示,模型参数R2X=0.999,R2Y=1.00,Q2=0.434,表明模拟拟合程度和预测能力较好,当前模型适合作为白花前胡HPLC指纹图谱的模式识别方法。从OPLS-DA得分散点图可看出,样品的数据点均落在95%置信区间内,说明各个样品的化学成分相似,但分散区域较大,说明样品在整体质量上存在较大的差异。在载荷散点图中,距离圆点越远,权重值越大,说明各成分的变化对区分样品的作用越大[13,14],结合变量重要性投影(variable importance in the projection,VIP)值图,筛选出能引起不同白花前胡样品成分差异的主要标记性成分,现在VIP>1且误差条范围在X>0以上的成分确定为贡献较大的成分,从图9中,可看出VIP>1且误差条范围在X>0以上的成分有2个,影响大小依次为峰2(白花前胡甲素)和峰5(白花前胡乙素)。同时在载荷图中也显示这两个化合物的变量离原点的距离较远,说明这两个成分是不同样品间成分差异的主要标记物。
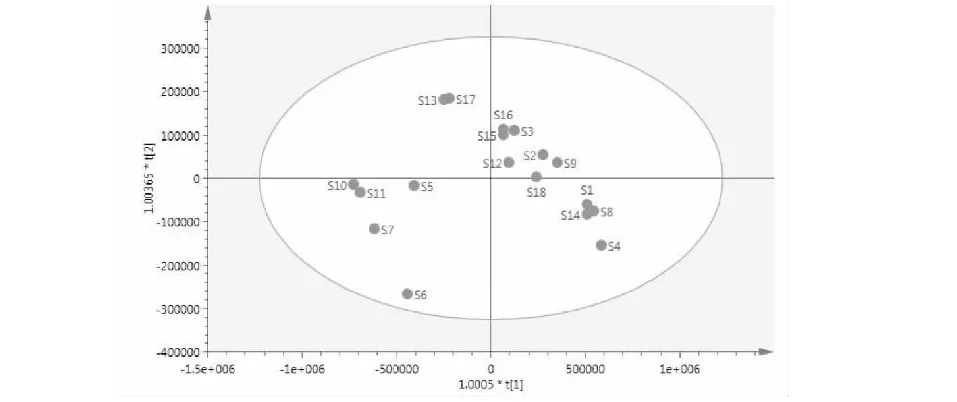
图8 OPLS得分图Fig.8 OPLS score scatter plot
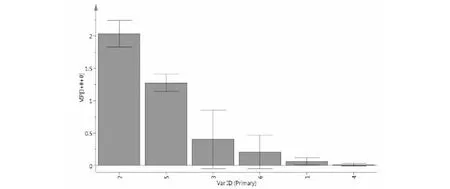
图9 VIP值图Fig.9 VIP score
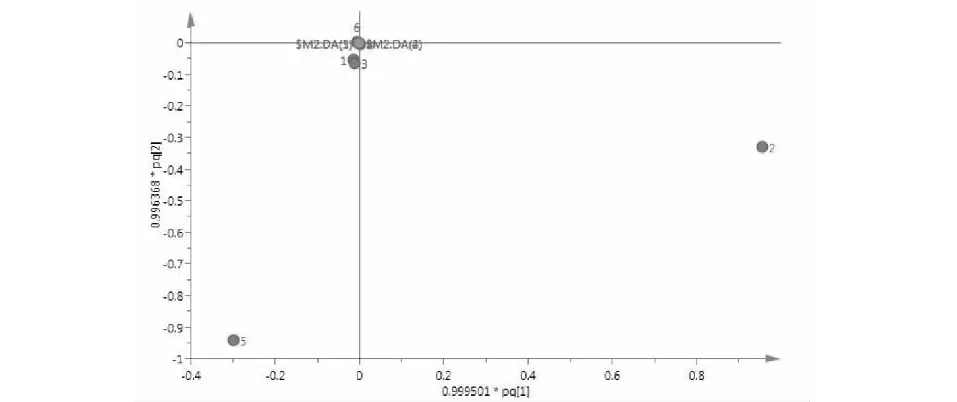
图10 载荷散点图Fig.10 Loading scatter plot
3 讨论与结论
研究中18个单株白花前胡甲素和白花前胡乙素平均含量为1.15%和0.24%,基本达到中国药典的指标要求,但全小区混合取样的指标成分含量分别为1.278%和0.293%,比18个单株指标成分平均值都要高。表明在剔除的小株样品中指标成分含量在混合样品含量构成中权重较大。Song等[15]研究推测白花前胡香豆素类成分主要存在中柱鞘壁组织和次生韧皮部的分泌道中,同时Xie等[16]研究发现在中柱鞘壁组织和次生韧皮部的白花前胡甲素和白花前胡乙素含量最高。推测小株样品个体类型自身含量较高,或者生长后期侧根或小根中累积含量较高,是否存在小株、小根的中柱鞘壁组织和次生韧皮部占比大,分泌道多,进而其香豆素含量高,有必要开展进一步的详细研究。
本研究采用HPLC技术建立前胡化学指纹谱图,得到6个共有特征峰,结合化学计量学方法对其进行了HCA、PCA和OPLS分析,发现18个白花前胡样品区分良好,共分为四类;同时得到2个特征(峰2和峰5)变量对样品的区分影响显著;并采用标准品对照指认2个特征变量为白花前胡甲素和白花前胡乙素。结果表明白花前胡甲素和白花前胡乙素在不同的植株类型间存在广泛的变异,有必要在多产地平行试验中结合叶柄颜色、叶片裂缺深浅、叶面积、块根性状、单株产量等农艺性状与内在质量的相关性和稳定性研究,分析不同农艺性状特征下相应单株的质量构成权重及其遗传稳定性,在间苗或育种过程中剔除对质量整体贡献无价值的株系,从栽培管理的角度提升种植基地前胡的整体质量水平,同时还可为品种选育与改良提供优质的种质资源。
本研究还发现,试验样株中前胡甲素含量高的,乙素就偏低;前胡甲素含量低,则乙素相对偏高;呈负相关性。而在项目团队的产地调研过程中发现多数基地都是前胡甲素达标而乙素很少达标。通过分析白花前胡甲素和白花前胡乙素的化学结构式均为二氢花椒内脂型香豆素,仅在其香豆素母环的10位取代基不同,甲素为乙酰基,乙素为烯酰基;现代合成技术利用顺式凯林内酯为母核合成白花前胡香豆素及其衍生物[17]。项目组推测:是否在前胡甲素和乙素两者之间存在一种转化关系或是在某种条件下出现乙素转化为甲素有待项目团队开展相应研究做出合理评价。
本研究目前仅仅从药典指标成分的角度进行了研究,尚未结合分子标记等方法对这些种质进行鉴定。不同种质类型是否受土壤类型、肥料种类、海拔高度、气候条件等的影响,有必要在分子水平上研究前胡种质遗传多样性,以精确鉴别重复和相似种质,为遗传育种中亲本的选配提供新的依据,以便更好地开发利用前胡种质资源。

