鼠尾草酸对MPTP诱导的多巴胺神经元损伤的保护作用研究
李 媛,耿艺娟,于浩飞,孙梦桢,张兰春,张荣平,胡炜彦*
1昆明医科大学药学院暨云南省天然药物药理重点实验室;2云南中医药大学中药学院,昆明 650500
随着国内外老龄化进程的加速,帕金森病(Parkinson’s disease,PD)的发病率正日益增高,成为继阿尔茨海默氏症(Alzheimer’s disease,AD)的第二大神经系统退行性疾病[1]。帕金森病患者人均经济负担占人均年收入的57.0%,占家庭年收入24.2%,给家庭和社会带来沉重的负担[2]。2018年6月,国家卫生健康委员会、科技部、工信部、药监总局、中医药管理局5部门联合公布的《第一批罕见病目录》中,帕金森病被收录其中。帕金森病病因及病理机制复杂,目前的研究认为帕金森的发病机制可能与遗传、环境、免疫等多因素有关[3],但尚未完全明晰。氧化应激诱导脂质过氧化,破坏核酸和蛋白质,损伤核糖核酸(RNA)和核脱氧核糖核酸(DNA),尤其对线粒体DNA造成损伤[4]。线粒体功能障碍和能量代谢异常被认为是神经元损伤的主要驱动因素[5]。尽管PD的分子机制尚未完全阐明,但众多证据表明,氧化应激导致神经死亡和神经功能障碍,是PD重要的病理机制之一[6]。保护神经元氧化损伤对PD的预防和治疗至关重要,优质抗氧化剂是PD潜在的治疗药物[7]。
鼠尾草酸是唇形科植物迷迭香(RosmarinusofficinalisL.,英文名:Rosemary)的主要成分,是一种高效天然抗氧化剂,具有抗氧化、延缓衰老作用,能够抑制Aβ聚集,保护Aβ诱导的海马神经元损伤[8,9]。但是,鼠尾草酸是否具有保护MPTP导致的神经元损伤,进而用于PD的防治药物的研发候选药物尚缺乏深入的研究。因此,本研究体外培养多巴胺神经元,用MPTP诱导神经元损伤,探究鼠尾草酸对MPTP诱导的多巴胺神经元损伤的保护作用及其可能机制。
1 材料与方法
1.1 实验动物
孕14 天 C57BL/6(C57)孕鼠,购于昆明医科大学实验动物中心,合格证号:SCXK(滇)-2011004。
1.2 试剂与仪器
鼠尾草酸(Sigma-Aldrich(Shanghai)Trading Co.Ltd,货号:3650-09-7);木犀草素(Sigma-Aldrich (Shanghai)Trading Co.Ltd,货号:L9283);B-27加神经元培养基(B-27 plus neurobasal medium);伯克改良伊格尔培养基(Dulbecco’s modified eagle medium,DMEM)、胎牛血清(fatal bovine serum,FBS)、胰蛋白酶(trypsine)等均购自Thermo Fisher 公司;磷酸缓冲液(phosphate buffered saline,PBS)购自Invitrogen公司;MPTP、多聚赖氨酸(poly-l-lesine,PLL)购自Sigma公司;TH抗体、绿色荧光二抗购自Abcam公司。
细胞计数试剂盒(Cell Counting Kit-8,CCK-8)、二喹啉甲酸(bicinchoninic acid,BCA)蛋白浓度测定试剂盒、乳酸脱氢酶(LDH)检测试剂盒、丙二醛(malondialdehyde,MDA)检测试剂盒、超氧化物歧化酶(superoxide dismutase,SOD)等购自碧云天生物技术有限公司;核糖核酸(RNA)提取试剂盒、实时荧光定量聚合酶链式反应(RT-PCR)试剂盒购自宝生物工程(大连)有限公司;GAPDH及caspase 3基因引物均有Invitrogen公司(上海)合成。GAPDH,上游引物:F:TGACGTGCCGCCTGGAGAAA,下游引物 R:AGTGTAGCCCAAGATGCCCTTCAG;caspase 3,上游引物 F:ACCGATGTCGAT GCAGCTAA,下游引物 R:GGTGCGGTAGAGT AAGCATA。
1.3 实验方法
1.3.1 胎鼠多巴胺神经元分离和培养
无菌操作下取出孕14天胎鼠的中脑腹侧组织,剪碎,置0.125% Trypsine 中,37 ℃水浴消化15 min,用含10%FBS 的DMEM终止消化,吹打下细胞,75 μm筛网过滤,滤液1 000 rpm,离心5 min。沉淀中加入B-27 plus neurobasal medium混悬,再次离心(1 000 rpm,5 min),沉淀中加入B-27 plus neurobasal medium混悬,调整细胞浓度为5.0 ×105个/mL,接种于PLL包被过的96孔板(120 μL/孔),6孔板(2 mL/孔)和放有玻片的24孔板(0.5 mL/孔)中。37 ℃二氧化碳培养箱中培养,24 h后半换液,72 h后加入阿糖胞苷(2.5 mg/L),120 h后更换为B-27 plus neurobasal medium,继续培养。分别用于实验。
1.3.2 神经元活力检测
神经元培养第7天,参考文献[9]及预实验结果,将设定剂量的鼠尾草酸(5、20、80 μmol/L)加入96孔板处理30 min后,加入MPTP(10.0 μmol/L)诱导神经元损伤,加入20 μmol/L的木犀草素(luteolin,Lut)作为阳性对照,加入相同体积DMSO作溶剂空白对照,加入鼠尾草酸(5、20、80 μmol/L)但不加MPTP处理做药物对照。24 h后,加入CCK-8(20 μL/孔)溶液,设定加入相应体积培养液、药物和CCK-8溶液但没有细胞的孔作为试剂空白对照。在细胞培养箱中继续孵育1 h。在450 nm测定吸光度。
各组细胞活力=[(各组吸光度-试剂空白对照组吸光度)/
(溶剂空白组吸光度 -试剂空白对照组吸光度)]× 100%
1.3.3 神经元形态观察
神经元培养第7天,将设定剂量的鼠尾草酸(5、20、80 μmol/L)加入24孔板处理30 min后,加入MPTP(10.0 μmol/L)诱导神经元损伤,加入木犀草素(20 μmol/L)作为阳性对照,加入相同体积DMSO作溶剂空白对照。24 h后,吸出培养液,预热的PBS洗三次后加入4% PFA固定,取出玻片,用含1% Triton 的封闭液封闭1 h后,加一抗(TH)4 ℃孵育12 h,DPBS洗3 次(5 min/次),加入偶联的荧光二抗室温孵育60 min,PBS洗3次(5 min/次),装片,共聚焦显微镜下观察。
1.3.4 神经元总RNA 提取
神经元培养第7天,将设定剂量的鼠尾草酸(5、20、80 μmol/L)加入24孔板处理30 min后,加入MPTP(10 μmol/L)诱导神经元损伤,加入木犀草素(20 μmol/L)作为阳性对照,加入相同体积DMSO作溶剂空白对照。24 h后,加入Trizol裂解液,按RNA提取试剂盒操作说明书提取总RNA。
1.3.5 RT-PCR反应
按照RT-PCR试剂盒操作说明书进行RT-PCR反应。反应体系及扩增条件如下:逆转录体系包括标本总RNA 500 ng,逆转录酶1.25 μL,寡核苷酸1.25 μL,核苷酸引物5 μL,缓冲液5 μL,不含RNase的水补齐至25 μL。37 ℃反应15 min,85 ℃反应5 min,cDNA 4 ℃保存。
PCR反应体系(10 μL)包括cDNA 1 μL,上游引物0.20 μL,下游引物0.20 μL,缓冲液5 μL,PCR参比染料0.20 μL,不含RNase的水2.80 μL。反应程序为:95 ℃ 30 s,95 ℃ 20 s,55 ℃ 20 s,72 ℃ 30 s,72 ℃ 10 s,共40 个循环。
1.3.6 SOD活性和MDA含量检测
神经元培养第7天,将设定剂量的鼠尾草酸(5、20、80 μmol/L)加入24孔板处理30 min后,加入MPTP(10 μmol/L)诱导神经元损伤,加入木犀草素(20 μmol/L)作为阳性对照,加入相同体积DMSO作溶剂空白对照。24 h后,去除培养液,置冰上,按SOD活力测定试剂盒和MDA含量测定试剂盒操作说明书操作测定各组SOD活力和MDA含量。
1.3.7 培养液中LDH漏出量的检测
神经元培养第7天,将设定剂量的鼠尾草酸(5、20、80 μmol/L)加入24孔板处理30 min后,加入MPTP(10 μmol/L)诱导神经元损伤,加入木犀草素(20 μmol/L)作为阳性对照,加入相同体积DMSO作溶剂空白对照。24 h后,收集培养上清液,按LDH定量测定试剂盒说明书操作检测各组培养液中LDH的漏出量。
1.3.8 统计分析
2 结果
2.1 鼠尾草酸对MPTP诱导的多巴胺神经元活力降低的影响
神经元活力检测结果显示,MPTP(10 μmol/L)作用24 h后,神经元活力显著降低;而不同剂量鼠尾草酸(5、20、80 μmol/L)预处理30 min均可改善由MPTP导致的神经元活力降低,与MPTP组比较,高、中剂量组(鼠尾草酸20、80 μmol/L处理组)具有显著性差异,但低剂量组(鼠尾草酸5 μmol/L处理组),差异无显著性(见表1)。
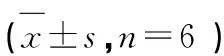
表1 鼠尾草酸对神经元活力的影响
2.2 鼠尾草酸对MPTP诱导的多巴胺神经元形态的影响
共聚焦显微镜下观察结果显示,与正常组相比,MPTP(10 μmol/L)作用24 h后,神经元萎缩,轴突断裂,树突减少。而中、高剂量鼠尾草酸(20、80 μmol/L)预处理30 min可改善这一现象,神经元轴突断裂减少,树突增多(见图1)。
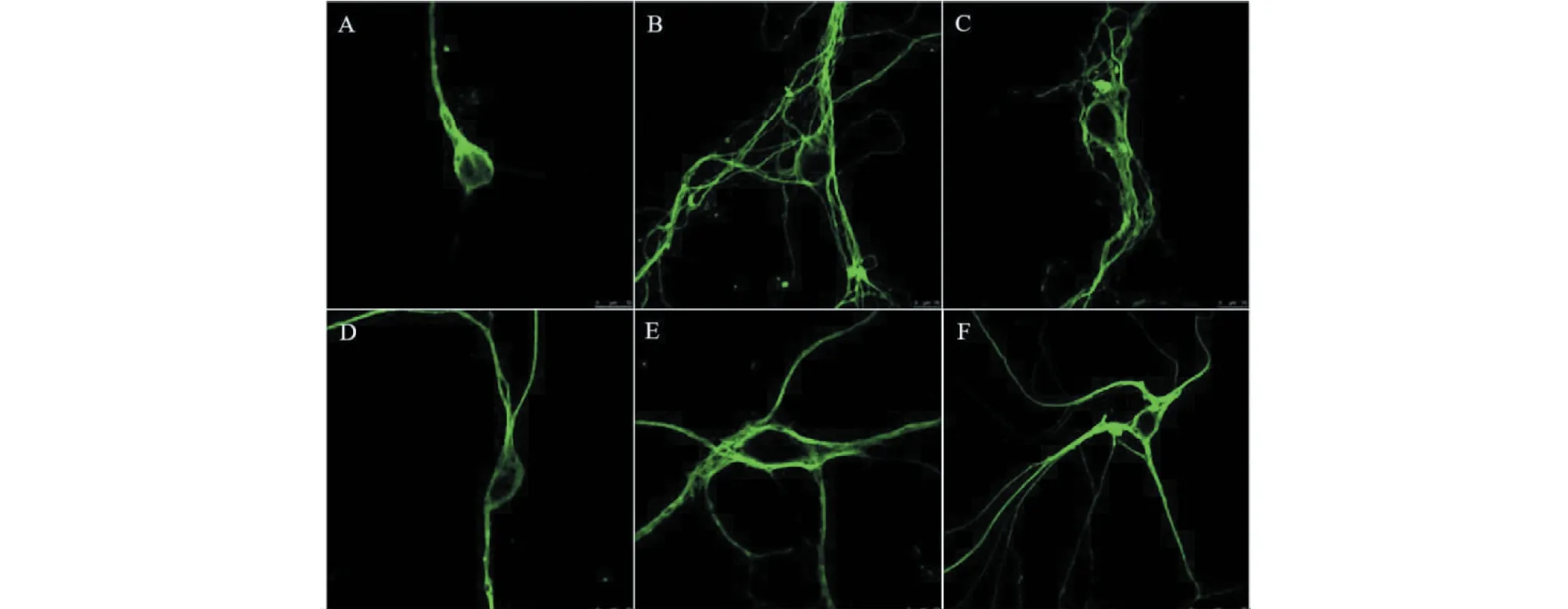
图1 鼠尾草酸对神经元形态的影响Fig.1 The effect of carnosic acid on neuronal morphology注:A:模型组;B:空白对照组;C:阳性对照组;D:鼠尾草酸低剂量组;E:鼠尾草酸中剂量组;F:鼠尾草酸高剂量组,下同。Note:A:model group;B:Control group;C:Luteolin group;D:CA-L group;E:CA-M group;F:CA-H group,the same below.
2.3 鼠尾草酸对MPTP诱导的多巴胺神经元caspase-3 mRNA和蛋白表达的影响
RT-PCR检测结果显示,MPTP(10 μmol/L)作用24 h后,caspase-3 mRNA和总caspase-3及剪切型caspase-3蛋白表达显著升高;而不同剂量鼠尾草酸(5、20、80 μmol/L)预处理30 min可逆转caspase-3 mRNA(见表2)和总caspase-3及剪切型caspase-3蛋白表达的异常升高(见图2)。
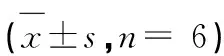
表2 鼠尾草酸对caspase-3 mRNA 表达的影响
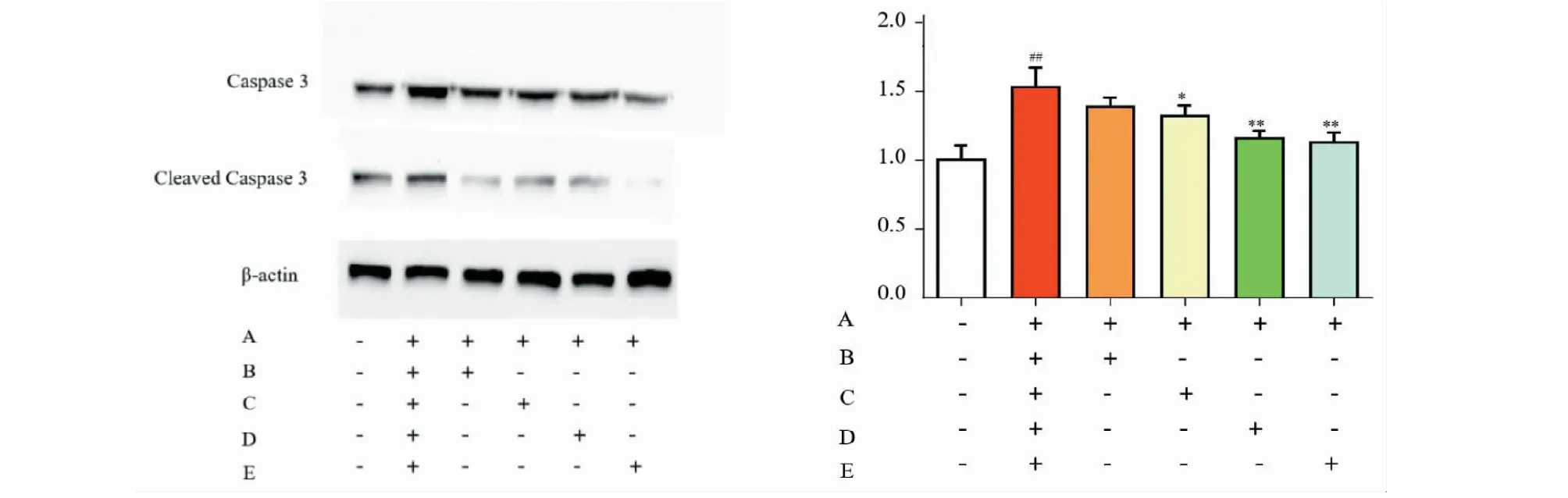
图2 鼠尾草酸阻止MPTP诱导的caspase 3活性异常升高(n=4)Fig.2 Carnosic acid prevents MPTP-induced abnormal increase in caspase-3 activity (n=4)注:总caspase-3 的量归一化到β-actin;剪切型caspase-3的量归一化到总caspase-3;与空白对照组比较,##P<0.01;与模型组比较,**P<0.01,*P<0.05。Note:The amount of total caspase-3 is normalized to β-actin;the amount of cleaved caspase-3 is normalized to total caspase-3;##P<0.01 vs the reagent blank control group;**P<0.01, *P<0.05 vs MPTP group.
2.4 鼠尾草酸对MPTP诱导的多巴胺神经元SOD活性和MDA含量的影响
超氧化物歧化酶(SOD)可以调节脑内自由基代谢,减少氧化应激反应,保证免遭自由基损伤,进而达到保护神经元的目的。PD患者体内氧自由基的产生与清除失去平衡,产生脂质过氧化,过氧化脂质以及氧自由基代谢产物丙二醛(MDA)生成增多,引起细胞毒性。为了探究鼠尾草酸对MPTP诱导的多巴胺神经元是否具有抗氧化作用,我们检测了多巴胺神经元SOD活性和MDA含量。结果显示,MPTP(10 μmol/L)作用24 h后,神经元SOD活性显著降低,MDA含量显著增加;预先给予鼠尾草酸(20、80 μmol/L)预处理30 min,可明显逆转这一现象,与MPTP组比较,中、高剂量鼠尾草酸处理组神经元SOD活性显著升高,MDA含量显著降低(见表3)。

表3 鼠尾草酸对神经元MDA含量和SOD活性的影响
2.5 鼠尾草酸对MPTP诱导的多巴胺神经元培养液中LDH漏出的影响
乳酸脱氢酶是生物体内糖酵解途径中一种至关重要的氧化还原酶,其可催化乳酸氧化为丙酮,在机体自身免疫调节与炎性反应中发挥着重要作用。为了探究鼠尾草酸对MPTP诱导的多巴胺神经元培养液中LDH漏出是否有影响,我们检测了多巴胺神经元培养液中LDH水平。结果显示,MPTP(10 μmol/L)作用24 h后,培养液中LDH漏出量显著增加;预先给予鼠尾草酸(5、20、80 μmol/L)预处理30 min,可明显降低培养液中LDH漏出,与MPTP组比较有显著性差异(见表4)。

表4 鼠尾草酸对神经元LDH漏出的影响
3 讨论与结论
帕金森的临床治疗药物有多巴胺受体激动剂、单胺氧化酶B(MAO-B)抑制剂、抗胆碱能药物、复方左旋多巴制剂、金刚烷胺以及神经保护剂等[10-12]。尽管用于治疗帕金森的药物种类很多,但仍然没有能彻底根治帕金森的药物。脑内过量的活性氧会导致核酸崩解和脂质过氧化等反应,引起线粒体功能障碍,进而可神经元丢失。线粒体功能障碍促进了氧化应激反应、衰老以及神经退行性改变,直接参与PD等多种神经退行性疾病的病理过程[13],高质量的抗氧化剂可能是潜在的治疗药物[14]。
鼠尾草酸是迷迭香的多酚类主要成分之一,具有良好的抗氧化作用,长期被用作食品、日化产品抗氧化[15],已有研究显示鼠尾草酸及以鼠尾草酸为主要成分的迷迭香提取物具有良好的中枢神经系统保护作用[16,17],但其能否保护多巴胺能神经元氧化损伤,开发成用于预防治疗PD的药物,尚未研究证实。1 -甲基- 4 -苯基-1,2,3,6-四氢吡啶(1-methyl-4-pheyl-1,2,3,6-tetra-hydrophridine,MPTP)是一种神经毒剂,在体内代谢产生1-甲基-4-苯基吡啶离子(MPP+),MPP+进入线粒体后抑制氧化呼吸链复合体I的活性,引起多巴胺能神经元氧化应激损伤,导致哺乳动物产生类似帕金森病的症状,是一种公认的构建PD模型的金标准[18-20]。在本研究中,我们用MPTP(10 μmol/L)处理体外培养的多巴胺神经元,发现MPTP处理后,神经元萎缩,轴突断裂,树突减少,神经元活力降低,神经元caspase-3 mRNA和蛋白表达显著增加,MDA含量和培养液中LDH漏出显著增加,神经元SOD活性明显降低。而用鼠尾草酸预处理后,可逆转MPTP诱导的神经元形态萎缩和活力降低;同时可逆转MPTP诱导的神经元caspase-3 mRNA和蛋白的异常升高;降低MDA的含量和LDH的漏出;增强神经元SOD的活性。表明鼠尾草酸对MPTP诱导的多巴胺能神经元具有保护作用,由于鼠尾草酸可降低MPTP诱导的多巴胺能神经元MDA的含量和LDH的漏出,增强神经元SOD的活性,我们推测鼠尾草酸对帕金森的保护作用可能与抗氧化损伤有关。木犀草素(luteolin)是一种天然,存在于多种植物中具有多种药理活性,如抗肿瘤、抗菌、抗病毒、抗炎、祛痰、降尿酸、抗过敏和免疫增强等作用。研究报道,木犀草素和芦丁组合物,能够减轻 6-OHDA诱导的细胞损伤,抑制PD模型大鼠的震颤行为,减轻 DA 能神经元损伤和炎性因子的生成、释放;可以改善MPTP诱导帕金森病小鼠运动协调能力,调节脑内神经递质水平、抑制炎症反应、减少神经元损伤[21]。因此本实验选用木犀草素作为阳性对照药。
本研究结果显示鼠尾草酸对MPTP导致的多巴胺神经元损伤具有保护作用,其作用机制可能与其抗氧化,神经元氧化损伤和逆转caspase-3异常激活有关,但尚需更为严格的实验加以证实(例如设计在MPTP损伤多巴胺神经元后用不同剂量CA用来改善MPTP带来的神经损伤,加入拮抗剂,线粒体其他相关蛋白检测等实验)。本研究可为迷迭香的深入开发利用提供帮助,同时也为PD预防治疗药物的研发提供参考。

