基于HPLC指纹图谱与多成分含量测定结合化学计量学的玉屏风散质量评价
申亚君,安 琪,丁笑颖,李恒阳,郭 龙,郑玉光,2,郑 倩,张 丹*
1河北中医学院 河北省中药炮制技术创新中心,石家庄 050200;2河北医药化工职业技术学院,石家庄 050026;3石家庄市中医院,石家庄 050051
玉屏风散首载于元代朱震亨的《丹溪心法》[1],由防风、黄芪、白术三味药组成,在中医方剂里有“玉屏组合少而精,芪术防风鼎足行”的说法。该方益气,固表,止汗,用于表虚不固,自汗恶风,面色晄白,或体虚易感风邪者[2]。方中君药黄芪性味甘温,补气升阳,固表止汗[2],具有抗肿瘤、保护心脑血管、提高免疫功能、保护肺功能、保护肾组织、保护肝损伤、保护肠功能、调节血压、抗衰老、防治骨质疏松症等作用[3];臣药白术味甘微温,健脾益气,燥湿利水[2],白术可助君药加强益气之功;防风为佐祛风解表,胜湿止痛[2]。黄芪配白术,汗不外泄,外邪易难内侵,该方以补气药为主,配合小量祛风解表之品防风,使补中寓散[4]。临床上常用于治疗气虚体质、有效减少反复上呼吸道感染频率[5]、小儿哮喘[6]、慢性荨麻疹、湿疹[7,8]、肝癌[9-11]。
目前关于玉屏风散质量分析的研究,已有部分文献报道[12-14],但饮片的质量受产地、加工炮制方法等的影响,在临床疗效上也有一定的差异[15]。因此,本研究利用HPLC法建立了15批玉屏风散的HPLC指纹图谱,并对玉屏风散中11种成分的含量进行了同时测定,同时结合化学计量学的方法对其质量进行了综合评价,为建立玉屏风散水煎液质量标准、阐明玉屏风散药效机制以及指导临床合理用药提供了一定的依据。
1 仪器与材料
1.1 仪器
岛津LC-20AT高效液相色谱仪(日本岛津制作所);SPD-M20A紫外检测器(日本岛津制作所);BSA224S-CW电子分析天平(赛多利斯科学仪器有限公司);SHB-Ⅲ循环水式多用真空泵(郑州长城科工贸有限公司);HH-2数显恒温水浴锅(江苏省金坛市荣华仪器制造有限公司);KQ2200E型超声波清洗器(昆山市超声仪器有限公司)。
1.2 材料
乙腈为色谱纯(Fisher Scientific Co.Ltd.),甲醇为色谱纯(Fisher Scientific Co.Ltd.),正丁醇(天津市永大化学试剂有限公司),水为超纯水。
对照品升麻素苷(批号PRF7040523、纯度>98%)、毛蕊异黄酮葡萄糖苷(批号PRF8032744、纯度>98%)、升麻素(批号PRF7090123、纯度>98%)、5-O-甲基维斯阿米醇苷(批号PRF7083021、纯度>98%)、亥茅酚苷(批号PRF7083022、纯度>98%)、毛蕊异黄酮(批号PRF7120844、纯度>98%)、芒柄花素(批号PRF8032146、纯度>98%)、芒柄花苷(批号PRF8032741、纯度>98%)、白术内酯I(批号PRF7071542、纯度>98%)、白术内酯II(批号PRF7080843、纯度>98%)、白术内酯III(批号PRF8032742、纯度>98%)均购于成都普瑞法科技开发有限公司。
15批黄芪饮片、防风饮片、白术饮片分别购于石家庄市内各药房,经河北中医学院张丹副教授鉴定均为正品(见表1)。各饮片均符合《中国药典》2020版项下性状要求,鉴定结果黄芪为豆科植物蒙古黄芪Astragalusmembranaceus(Fisch.) Bge.var.mongholicus(Bge.) Hsiao或膜荚黄芪Astragalusmembranaceus(Fisch.) Bge.的干燥根,防风为伞形科植物防风Saposhnikoviadivaricate(Turcz.) Schischk.的干燥根,白术为菊科植物白术AtractylodesmacrocephalaKoidz.的干燥根茎。将黄芪、白术、防风三种饮片分别粉碎过60目筛,按2∶2∶1的比例混合均匀,即得玉屏风散样品。
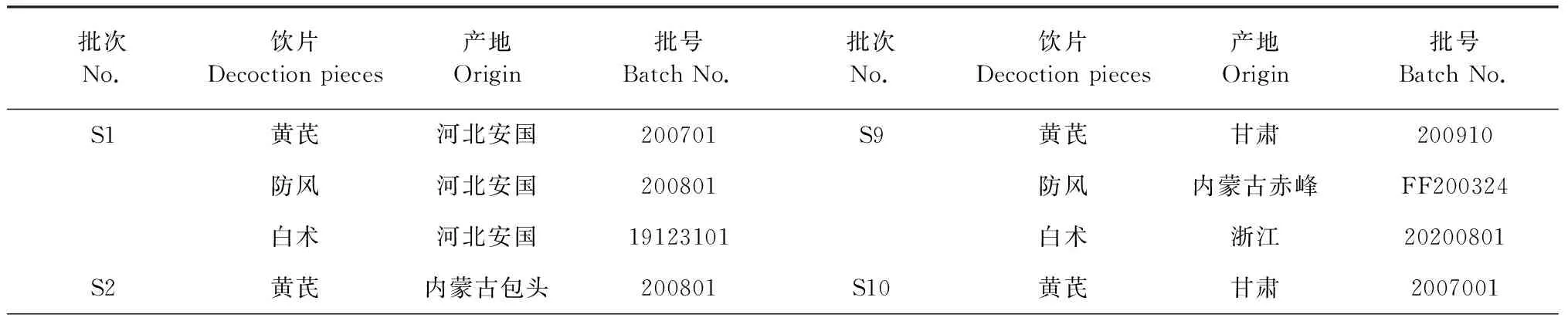
表1 15批次玉屏风散饮片的产地信息
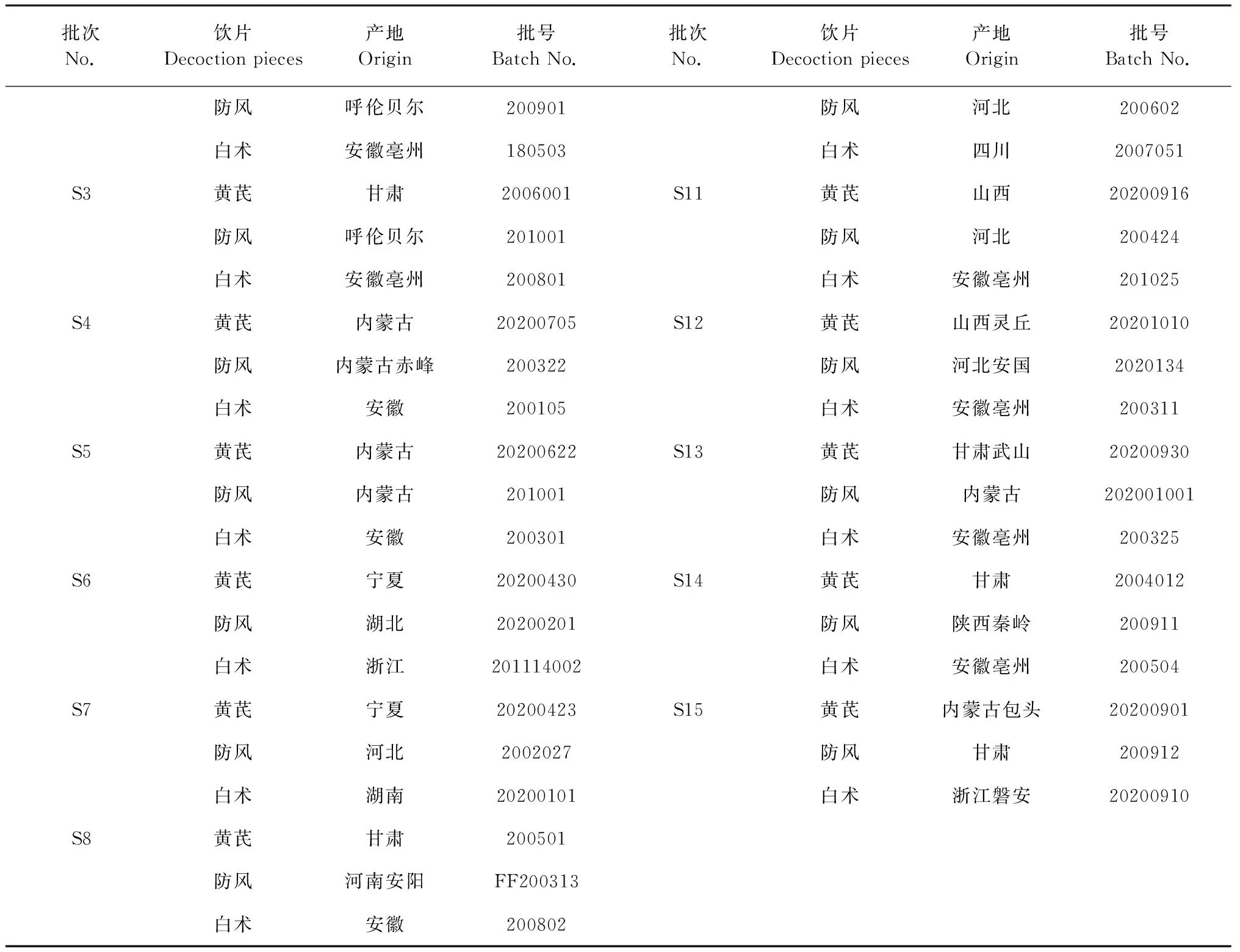
续表1(Continued Tab.1)
2 方法与结果
2.1 溶液的制备
2.1.1 混合对照品溶液
精密称取适量对照品,用甲醇溶解配制成含升麻素苷、毛蕊异黄酮葡萄糖苷、升麻素、5-O-甲基维斯阿米醇苷、亥茅酚苷、毛蕊异黄酮、芒柄花素、芒柄花苷、白术内酯III、白术内酯I、白术内酯II的对照品混合溶液,浓度分别为1.725、1.010、1.110、1.530、1.290、1.010、2.050、0.990、2.090、2.035、2.005 mg/mL。
2.1.2 玉屏风散供试品溶液
精密称取粉末约2.5 g,加50 mL甲醇超声提取30 min,过滤,滤液浓缩至干后,加水20 mL,用水饱和的正丁醇萃取四次,合并萃取液,蒸干,残渣加适量甲醇使溶解,转移至10 mL量瓶中,加甲醇至刻度,摇匀,0.22 μm微孔滤膜滤过,即得。
2.1.3 阴性样品溶液
分别按“2.1.2”项下的方法制成缺黄芪、缺防风、缺白术的阴性样品溶液。
2.2 色谱条件
Shimadzu Inertsil ODS-2 C18(250 mm × 4.6 mm,5 μm)色谱柱,以乙腈(A)-水溶液(B)为流动相,梯度洗脱(见表2),流速1.0 mL/min,检测波长230 nm,柱温30 ℃,进样量10 μL。
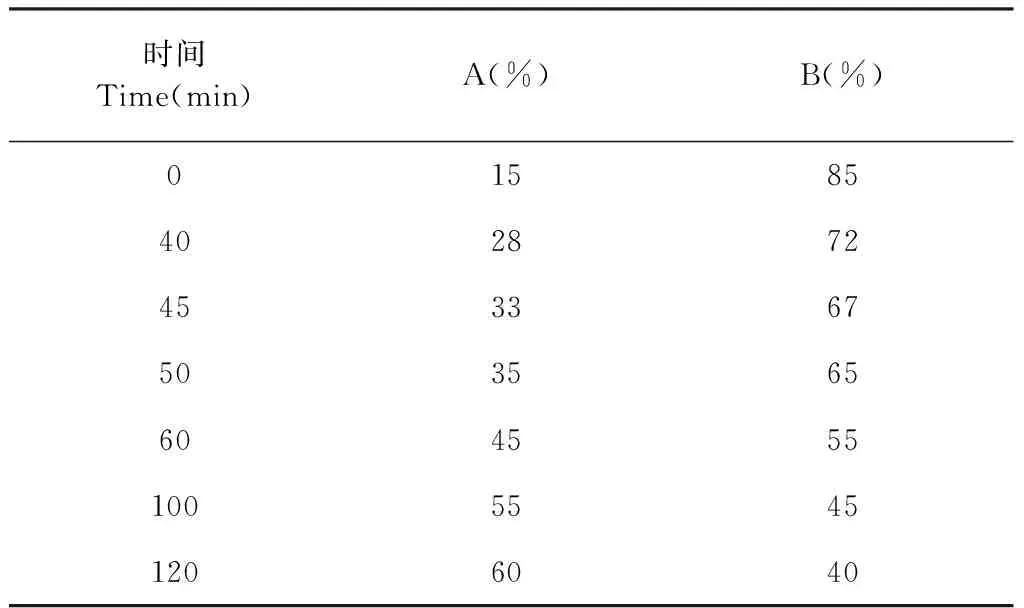
表2 梯度洗脱程序
2.3 玉屏风散HPLC指纹图谱的建立
2.3.1 精密度试验
取玉屏风散样品(编号S1)适量,按“2.1.2”项下方法制备供试品溶液,精密吸取同一玉屏风散供试品溶液,连续进样6次,以1号峰(升麻素苷)为参照峰,测得其余17个共有峰相对保留时间RSD<3.0%,相对峰面积的RSD<3.0%。结果表明仪器精密度良好。
2.3.2 稳定性试验
取玉屏风散样品(编号S1)适量,按“2.1.2”项下方法制备供试品溶液,精密吸取同一玉屏风散供试品溶液,分别在供试品溶液制备后第0、4、8、12、18、24 h进样,以1号峰(升麻素苷)为参照峰,测得其余17个共有峰相对保留时间RSD<3.0%,相对峰面积的RSD<3.0%。结果表明供试品溶液在制备后24 h内稳定。
2.3.3 重复性试验
精密称定玉屏风散样品(编号S1)2.5 g,平行6份,按“2.1.2”项下方法处理,得玉屏风散供试品溶液,依法进样,以1号峰(升麻素苷)为参照峰,测得其余17个共有峰相对保留时间RSD<3.0%,相对峰面积的RSD<3.0%,表明该方法的重复性良好。
2.3.4 指纹图谱的建立及相似度分析
取各批次玉屏风散样品适量,按“2.1.2”项下方法制备供试品溶液,按“2.2”项下方法测定,采用中药色谱指纹图谱相似度评价系统(2004版)建立15批样品指纹图谱(图1),共标示出24个共有峰,指认出其中11个峰。15批样品色谱图与对照指纹图谱相比较,各批次样品的指纹图谱相似度在0.835~0.965之间,表明玉屏风散各批次间相似性较好(见表3)。

图1 15批玉屏风散HPLC指纹图谱(S1~S15)和对照指纹图谱(R)Fig.1 HPLC fingerprints of 15 batches of Yupingfeng Powder (S1~S15) and referential fingerprint (R)
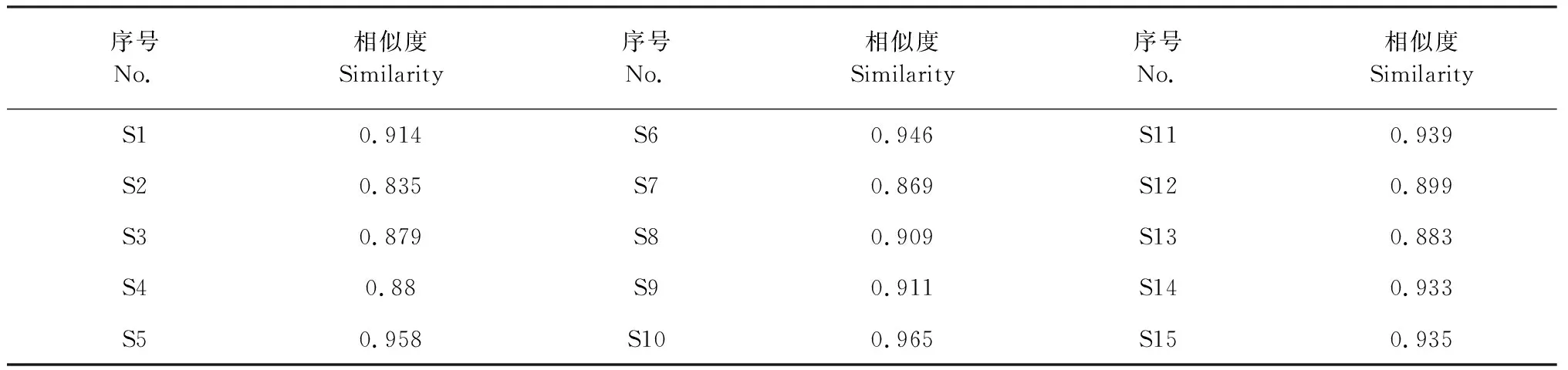
表3 15批玉屏风散指纹图谱与对照指纹图谱相似度比较
2.3.5 主要特征峰归属
精密吸取“2.1.2”项下对照品储备液适量,依法进样测定,与指纹图谱各主要共有峰进行对比,指认出11个色谱峰,其中1号峰升麻素苷、2号峰毛蕊异黄酮葡萄糖苷、3号升麻素、4号峰5-O-甲基维斯阿米醇苷、5号峰亥茅酚苷、7号峰毛蕊异黄酮、9号峰芒柄花素、12号峰芒柄花苷、15号峰白术内酯III、18号峰白术内酯I、20号峰白术内酯II。
2.4 11种成分含量测定
2.4.1 线性关系考察
分别精密量取“2.1.1”项下混合对照品溶液适量,加甲醇制成系列梯度浓度的混合对照品溶液,按照“2.2”项下的条件测定,记录峰面积。将所得峰面积(Y)与各对照品质量浓度(X)进行线性回归。结果显示各组分线性关系良好(见表4)。
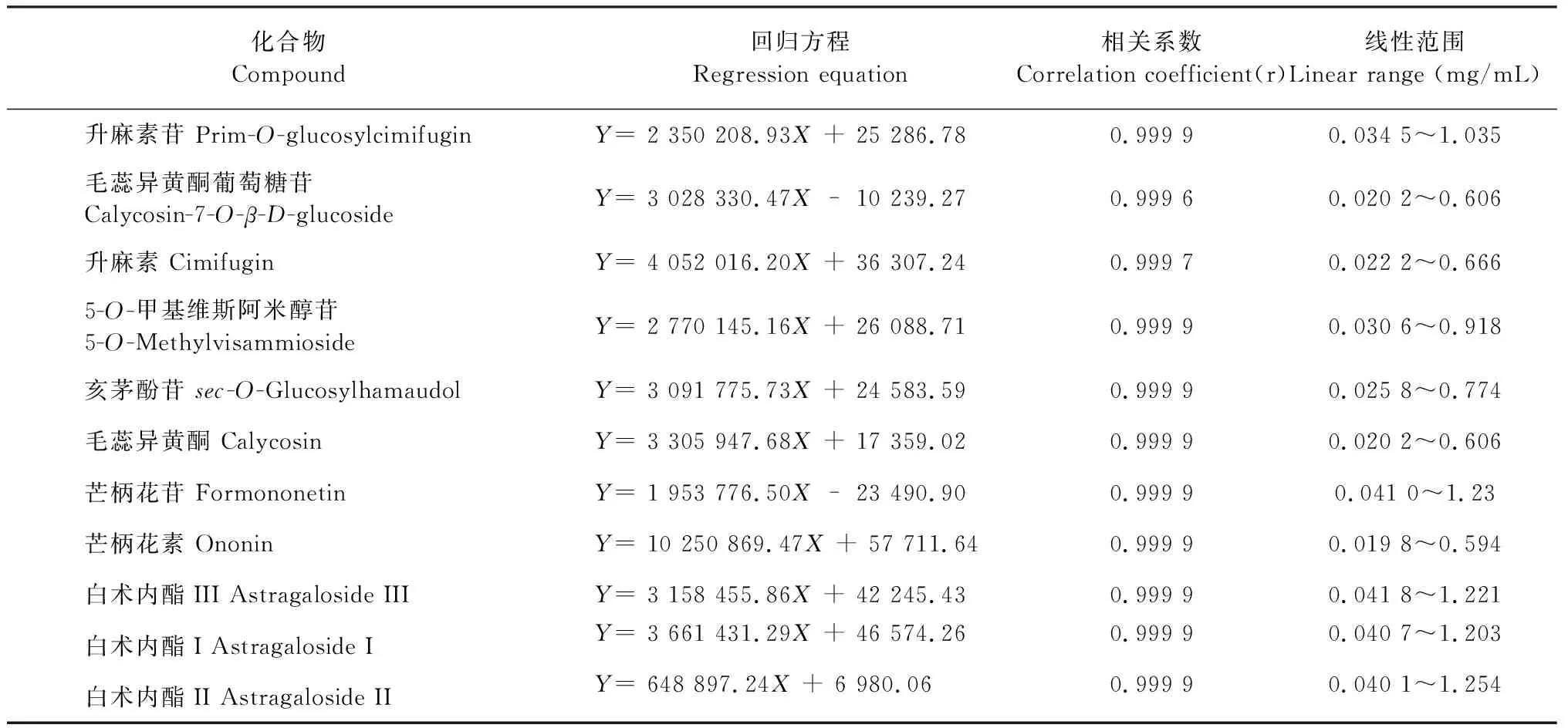
表4 11种成分的回归方程、相关系数和线性范围
2.4.2 精密度试验
精密吸取“2.1.1”项下混合对照品溶液,在“2.2”项下色谱条件连续进样6次,测得各特征峰保留时间的RSD<3.0%,相对峰面积的RSD<3.0%。结果表明仪器精密度良好。
2.4.3 稳定性试验
取玉屏风散粉末(编号S1)适量,按上述“2.1.2”项下方法制备供试品溶液,分别在供试品溶液制备后第0、4、8、12、18、24 h进样,记录峰面积。计算各成分的相对峰面积的RSD<3.0%。结果表明供试品溶液在制备后24 h内稳定。
2.4.4 重复性试验
取玉屏风散粉末(编号S1)精密称定2.5 g,平行6份,按“2.1.2”项下方法处理,得玉屏风散水煎液供试品溶液,依法进样测定,记录峰面积。计算各成分的相对峰面积的RSD<3.0%。结果表明该方法的重复性良好。
2.4.5 加样回收率试验
精密称定11种成分含量已知的玉屏风散粉末样品1.25 g,平行6份,分别加入对照品溶液适量,按照“2.1.2”项下方法制备供试品溶液,“2.2”项下色谱条件进样分析,计算11个成分的加样回收率的平均回收率分别为98.31%、99.27%、95.99%、102.75%、101.68%、98.63%、98.79%、97.99%、98.21%、101.36%、96.89%,RSD分别为2.7%、1.9%、2.3%、1.7%、2.5%、1.7%、1.9%、1.7%、2.9%、2.7%、2.1%。
2.4.6 样品含量测定
按照“2.1.2”项下方法制备15批玉屏风散供试品及阴性样品,在“2.2”项下色谱条件进样分析,混合对照品、样品色谱图及阴性样品色谱图见图2。通过与阴性样品色谱图对比,可以判定2、7、9、12号峰存在于黄芪饮片中,1、3、4、5号色谱峰存在于防风饮片中,15、18、20号色谱峰主要存在于白术饮片中,含量结果见表5。
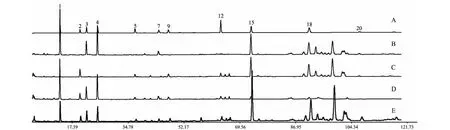
图2 混合对照品(A)、黄芪阴性样品(B)、防风阴性样品(C)、白术阴性样品(D)和玉屏风散(E)的HPLC图Fig.2 HPLC of mixed reference (A),negative sample without Astragali Radix (B),negative sample without Saposhnikoviae Radix (C),negative sample without Atractylodis Macrocephalae Rhizoma (D),and Yupingfeng Powder (E)
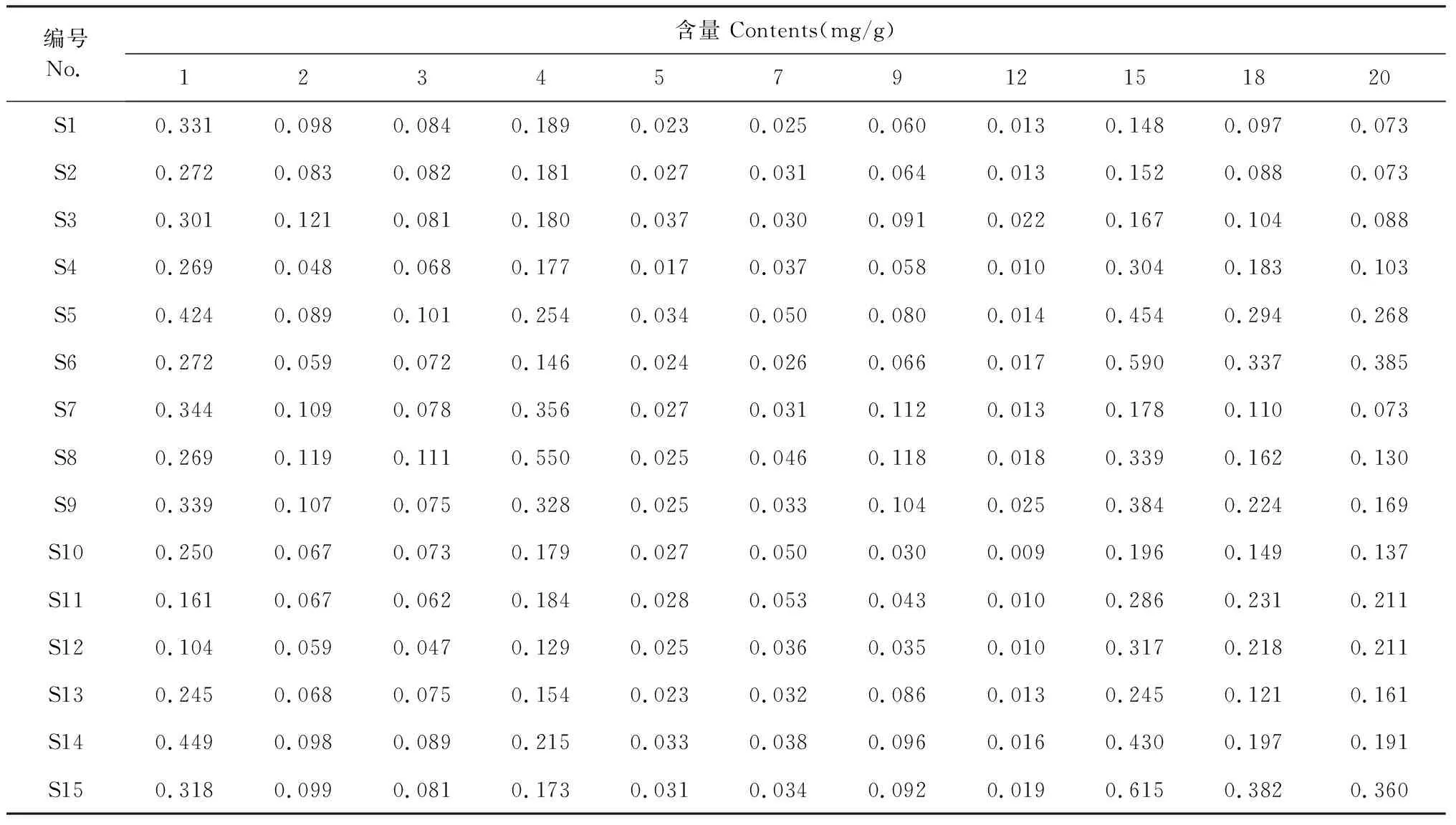
表5 玉屏风散中11种成分含量测定结果(n=3)
2.5 基于化学计量学的玉屏风散水煎液质量分析
2.5.1 聚类分析
以15批玉屏风散中的11个成分的含量为变量,组成11×15数据矩阵导入SPSS 23.0软件中,采用组间联接系统聚类法,以平方欧式距离为测度进行聚类分析,结果见图3。当类间距离为25时,15批样品可聚为两类,S1、S2、S3、S4、S7、S8、S10、S11、S12、S13为第Ⅰ类,S5、S6、S9、S14、S15为第Ⅱ类。结果表明,不同批次的样品主要成分的含量存在一定的差异,这可能与生产饮片所用药材的产地、采收季节以及加工炮制有一定的关系,也反映出中药饮片质量的差异。
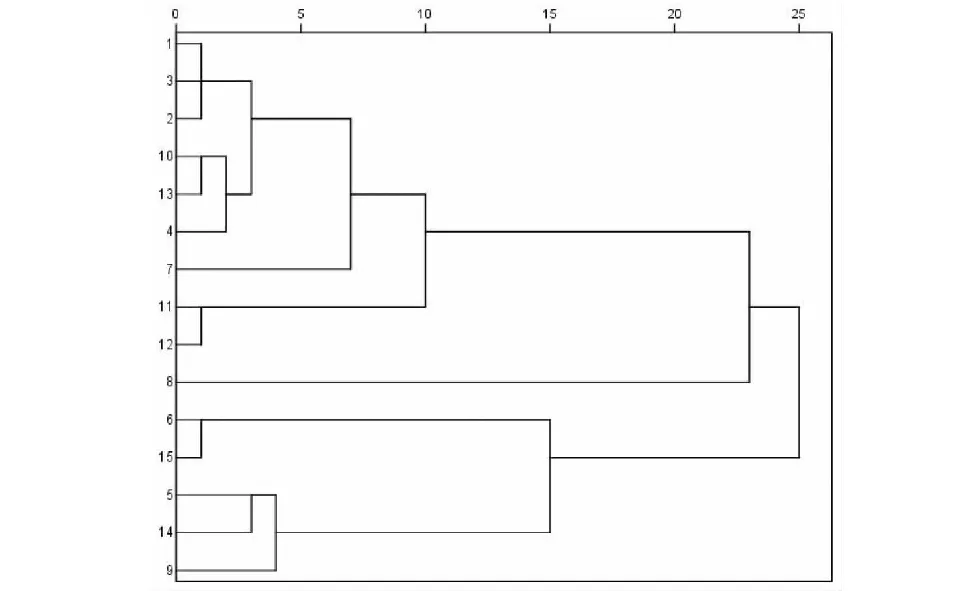
图3 15批玉屏风散聚类树状图Fig.3 Dendrogram of 15 batches of Yupingfeng Powder
2.5.2 主成分分析
以15批玉屏风散样品中11个成分的含量为变量,采用SIMCA-P 13.0软件对15批玉屏风散样品进行PCA分析,前两个主成分的贡献率66.0%,即可以用2个潜在综合指标来解释66.0%的总方差,可反映不同批次的玉屏风散的质量差异(见图4)。15批玉屏风散样品被分成2类,与聚类分析结果基本一致,究其原因为各批次样品之间的质量差异所导致。
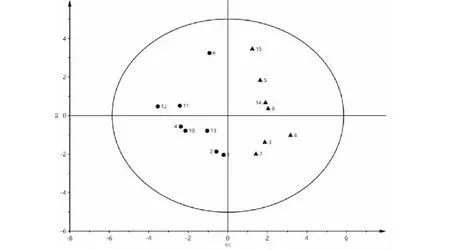
图4 样品PCA得分图Fig.4 PCA score scatter plot of 15 batches of Yupingfeng Powders
2.5.3 正交偏最小二乘法
为确定影响玉屏风散的潜在化学指标,本研究继续采用正交偏最小二乘法(OPLS-DA)对15批样品中的11种成分的含量组成的变量进行分析。与PCA分析结果一致,15批玉屏风散样品被分为两类(见图5),R2X= 0.968,R2Y=0.964和Q2= 0.854,表面所建立的模型具有很好的预测能力。为了选择化学标记,基于投影(VIP)值的可变重要性进一步筛选11个成分。VIP代表变量的差异,当VIP>1.0时,即代表该成分是分化中起重要作用的组分。结果显示,升麻素苷、毛蕊异黄酮葡萄糖苷、5-O-甲基维斯阿米醇苷、毛蕊异黄酮、芒柄花素的VIP>1.0,说明这5种成分对玉屏风散整体质量影响较大(见图6)。
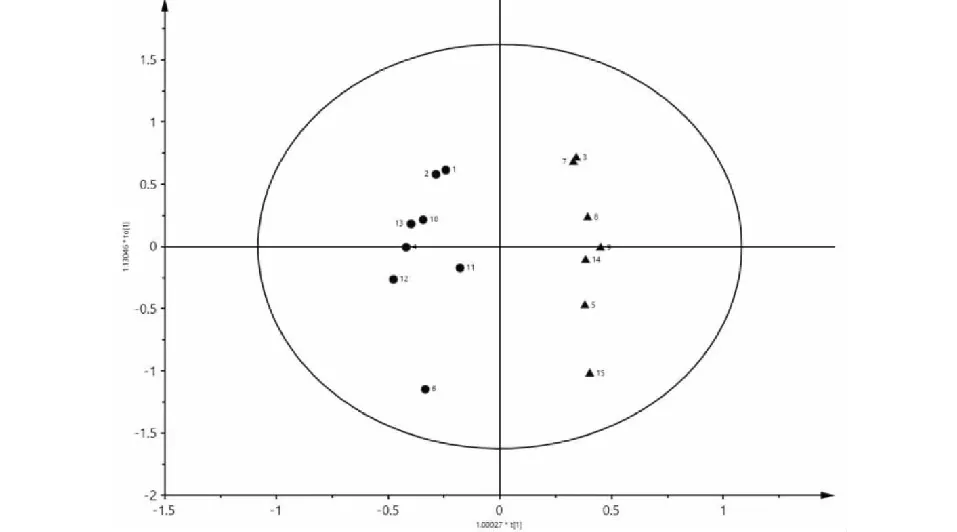
图5 样品OPLS-DA得分图Fig.5 OPLS-DA score scatter plot of 15 batches of Yupingfeng Powders
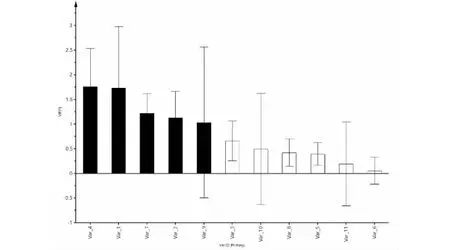
图6 样品各成分的VIP图Fig.6 VIP values of 15 batches of Yupingfeng Powders
3 结论
本实验在优化玉屏风散供试品溶液提取方式时,同时对比了超声、回流、连续回流三种提取方法,以玉屏风散色谱图中色谱峰的数量、分离度及定量测定的11种目标成分的提取率为指标分析,色谱峰相对保留时间的RSD<3.0%,其总提取率有较大差异,其中超声和索提两种方式所得物质含量较大,但是索提耗时较长,最后综合考虑采用超声方法进行提取。
实验中考察了甲醇-水、乙腈-水等不同流动相系统,结果发现乙腈-水干扰较小且分离效果较好,分析时间短,且梯度洗脱过程中基线平稳,因此选择乙腈-水为流动相。
对11个化合物分别在230、254、276、300、320 nm,5个波长下检测的色谱图进行比较,结果黄芪在230 nm检测波长下检出的特征峰相对较多且峰分离度高,有最大吸收;防风在230、254 nm检测波长下检出的特征峰数量基本一致;白术则在230 nm检测波长下有最大吸收,且白术内酯Ⅰ和白术内酯Ⅲ在其他波长下吸收较弱,因此采用了230 nm作为检测波长。
本实验建立了15批玉屏风散的HPLC指纹图谱,选取黄芪中的毛蕊异黄酮葡萄糖苷、毛蕊异黄酮、芒柄花苷、芒柄花素,防风中的升麻素苷、升麻素、5-O-甲基维斯阿米醇苷、亥茅酚苷、和白术中白术内酯III、白术内酯I、白术内酯II为主要定量指标进行含量测定,并采用HCA、PCA和OPLS-DA等化学计量学方法考察了不同批次玉屏风散的整体性与差异性,结果发现,15个批次的样品HPLC指纹图谱相似度在0.835~0.965之间,HCA和PCA分析结果基本一致,将样品分为两大类,结合饮片产地信息发现,第Ⅰ类中饮片多来自内蒙等地区,第Ⅱ类样品中饮片则多来自浙江等地,南北方在土壤、气候及栽培方式上均有很大不同,且各药店饮片来源于不同产地的不同饮片加工厂,道地中药材及优良产地是影响饮片质量的关键因素,中药材因受不同生长环境影响所含有效成分有所不同[16]。因此饮片质量与中药饮片生产所需的药材产地、采收加工的季节与加工炮制有一定的相关性。本研究所建立的质量评价方法简便,重复性好,可对药品生产企业在原药材及制备过程中提供参考依据,有利于玉屏风散的临床合理运用。

