艾纳香地上部分化学成分及其抗氧化与酪氨酸酶抑制活性研究
周立强,熊 燕,陈俊磊,张嘉瑜,郝小江,4*,顾 玮*
1贵州医科大学 省部共建药用植物功效与利用国家重点实验室; 2贵州省中国科学院天然产物化学重点实验室,贵阳 550014;3贵州医科大学 药学院,贵阳 550025;4中国科学院昆明植物研究所,昆明 650201;5贵阳护理职业技术学院,贵阳 550081
酪氨酸酶是黑色素代谢中目前唯一已知,并在黑色素生物合成过程中起关键作用的一种酶,它控制着黑素形成。酪氨酸酶活性与某些色素障碍性皮肤病及面部黄褐斑的产生有关,增高会产生黄褐斑等色素沉着性疾病。国内外学者常利用抑制酪氨酸酶活性试验筛选治疗皮肤色素沉着过多症的药物。近年来,从天然产物中提取抑制酪氨酸酶活性成分物质成为国内外开发美白美容化妆品的一种途径[1]。
艾纳香(BlumeabalsamiferaDC.)是菊科艾纳香属多年生草本植物,苗药名档窝凯Diangd vob bvid,别名大风艾、冰片艾、家风艾等,主产于贵州、广西、云南等地。民间记录具有治跌打损伤、疮疖痈肿、湿疹、皮炎、通诸窍散郁火、消肿止痛等功效,用于治疗风湿性关节炎、产后风痛、痛经等症[2],在黎族、壮族、苗族等地有悠久的用药历史。艾纳香的叶片,枝可提艾粉,经提炼后可制成天然冰片,副产品为冰片油。天然冰片能散郁热,清热止痛,开窍醒神,故在医药行业中用途广泛。艾纳香叶片原料一般在提取生产完“艾片”之后都是作为废渣处理,这样造成很大的资源浪费。初步分析,这些残渣中仍旧含有大量的黄酮类等功效成分。因此,深入研究艾纳香的非挥发性成分,并探索其药用功效具有重要的科学和应用价值。本课题组前期已经对艾纳香中的部分黄酮类化合物及其抗氧化活性和α-葡萄糖苷酶抑制活性进行了报道[3]。为进一步探究艾纳香中的非挥发性成分并进一步探讨其在化妆品开发及色素障碍性皮肤病领域的应用潜力,本研究运用各种色谱手段及波谱学技术对艾纳香地上部分的非挥发性成分进行了分离纯化和鉴定,并进一步运用DPPH法、酪氨酸酶催化左旋多巴氧化速率法对化合物的体外抗氧化活性及酪氨酸酶抑制剂活性进行了筛选。
1 材料和方法
1.1 仪器与材料
薄层柱色谱硅胶GF254(青岛海洋化工厂,中国);Sephadex LH-20凝胶(Pharmacia公司,美国);HITACHI高效液相色谱仪(Primaide,日立高新技术集团,日本);反相填充材料RP-18(Merck公司,德国);HPLC色谱柱为Zorbax SB-C18(半制备柱5 μm,9.4 mm×250 mm,安捷伦公司,美国);EYELA N-1100旋转蒸发仪(东京理化器械株式会社,日本);INOVA-400、500、600 MHz核磁共振波谱仪(Bruker公司,德国);BioTek Epoch 全波长酶标仪(BioTek公司,美国);1,1-二苯基苦基苯肼(思域化工,中国);左旋多巴(Macklin公司,中国);硝基苯基-α-D-吡喃葡萄糖苷(东京化成工业株式会社,日本);α-葡萄糖苷酶(上海源叶生物科技有限公司,中国);多酚氧化酶(上海源叶生物科技有限公司,中国);L-抗坏血酸(Macklin公司,中国);曲酸(上海源叶生物科技有限公司,中国);阿卡波糖(上海源叶生物科技有限公司,中国);Na2CO3、二甲基亚砜均为分析纯。本实验所用石油醚、二氯甲烷、乙酸乙酯、丙酮、甲醇等有机溶剂均为贵州省中国科学院天然产物化学重点实验室统一采购。
艾纳香地上部分于2019年9月采自贵州省黔南布依族苗族自治州罗甸县,经贵州省中国科学院天然产物化学重点实验室顾玮副研究员鉴定,凭证标本(HGML-2019-23)保存在贵州省中国科学院天然产物化学重点实验室。
1.1 实验方法
1.2.1 化合物的提取和分离
取干燥的艾纳香地上部分(75.7 kg),粉碎之后用乙醇(100 L)加热回流提取3次,减压回收得到浸膏与水混悬,依次用石油醚、乙酸乙酯萃取,分别得到石油醚部位2.3 kg 和乙酸乙酯部位1.8 kg。石油醚部位(2.3 kg)经40~80目正相硅胶柱层析,用石油醚/乙酸乙酯(1∶0→2∶1)、二氯甲烷/甲醇(1∶0→0∶1)洗脱得到12段样品,记为Fr-1~Fr-12。
Fr-1段经正相硅胶柱(石油醚、石油醚/乙酸乙酯=100∶1→1∶1、乙酸乙酯)初步分离,得到11段样品,洗脱过程中出现大量白色结晶,重结晶得到化合物16(6.7 g)。Fr-1-6(13.5 g)经正相硅胶分离(石油醚/乙酸乙酯=50∶1)得到9段样品,Fr-1-6-7经正相硅胶分离(石油醚/乙酸乙酯=50∶1)、正相硅胶分离洗脱过程中发现不溶性白色固体,甲醇洗净得到化合物15(6.8 mg)。Fr-1-7经正相硅胶分离(石油醚/乙酸乙酯=50∶1)得到4段样品,洗脱过程中出现不溶物,甲醇洗净得到化合物13(9.4 mg)。乙酸乙酯萃取部位经正相硅胶柱(40~80目)初步分离得到Fr-1~5,其中Fr-2经正相硅胶分离(石油醚/乙酸乙酯=20∶1→1∶1、氯仿/甲醇=100∶1→1∶1)得8段样品,其中Fr-2-5经反相硅胶分离(甲醇/水=50∶1→90∶1)得到6段样品,其中60%部分出现白色针状结晶,重结晶得到化合物17(500 mg),剩余部分经正相硅胶分离得到7段,Fr-2-5-6经Sephadex LH-20凝胶分离得到化合物11(16.5 mg),剩余主要部分经RP-HPLC(Zorbax SB-C18,甲醇/水=32∶68,流速2.0 mL/min)纯化得到化合物10(43.1 mg,tR=30.2 min);90%部分经正相硅胶(石油醚/乙酸乙酯=30∶1)分离得到化合物14(100 mg)。Fr-2-7经反相硅胶(甲醇/水=50∶1→90∶1)分离得到9段样品,80%段发现黄色不溶性固体,柱色谱纯化得化合物2(14.2 mg)。乙酸乙酯部位Fr-3(316.42 g)经正相硅胶分离(石油醚/乙酸乙酯=10∶1→1∶1、二氯甲烷/甲醇=100∶1→1∶1)得到Fr-1~7,Fr-3-4段出现大量黄色固体粉末,甲醇洗净得到化合物3(108.4 mg)和4(113.2 mg),剩余部分经MCI分离(甲醇/水=50∶1→90∶1)得到8段样品,50%部分经正相硅胶(二氯甲烷/甲醇=60∶1)分离得到的Fr-3-4-2,经Sephadex LH-20凝胶和正相硅胶分离(二氯甲烷/甲醇=100∶1)得到化合物18(23.9 mg),剩余部分用RP-HPLC(Zorbax SB-C18,甲醇/水=40∶60,流速2.0 mL/min)纯化得到化合物6(34.2 mg,tR=39.9 min)。55%部分经正相硅胶分离(300~400目,二氯甲烷/甲醇=100∶1)得到的Fr-3-4-3-3出现黄色不溶性粉末,甲醇洗净得到化合物5(155.1 mg),剩余部分经正相硅胶(300~400目,二氯甲烷/甲醇=100∶1)、Sephadex LH-20凝胶分离得到化合物7(10.2 mg)。65%部分出现大量不溶性黄色固体,甲醇洗净得到化合物8(500 mg)。Fr-3-5经反相硅胶分离(甲醇/水=50∶1→90∶1)得到6段样品,50%部分经正相硅胶分离(300~400目,二氯甲烷/甲醇=100∶1)得到化合物9(100 mg)。Fr-5-1经正相硅胶得到8段样品,Fr-5-1-7过凝胶柱后进一步通过正相硅胶(石油醚/乙酸乙酯=5∶1)得到化合物12(120.3 mg)。Fr-8-1-1经正相硅胶多次分离(石油醚/乙酸乙酯=10∶1)得到化合物1(17.1 mg)。
1.2.2 DPPH自由基清除活性测试
参照文献报道的DPPH自由基清除活性的方法并做适当改进[4],用DPPH作为底物,浓度为0.15 mmol/L,分为3个组:阴性对照组A(160 μL无水甲醇和40 μL DPPH)、样品组B(160 μL样品和40 μL DPPH)、样品背景对照组C(160 μL样品和40 μL甲醇),避光30 min使其充分反应后于517 nm测定吸光值。平行3次,按照公式(DPPH清除率=[A-(B-C)]/A×100%)计算DPPH自由基清除率,并用SPSS软件计算IC50值。
1.2.3 酪氨酸酶抑制活性测试
本实验参考酪氨酸酶催化左旋多巴(L-DOPA)氧化速率的方法,并加以改进[5]。以0.2 M 磷酸盐缓冲液(PBS)为溶剂,蘑菇酪氨酸酶配置成59 U/mL,分为4个组:空白组A(120 μL PBS)、空白对照组B(90 μL PBS和30 μL蘑菇酪氨酸酶)、样品背景对照组C(20 μL样品和100 μL PBS)和样品组D(20 μL样品、70 μL PBS和30 μL蘑菇酪氨酸酶),30 ℃恒温箱中孵育5 min,后将各孔加入0.5 mM左旋多巴(L-DOPA)100 μL,继续孵育10 min后,于492 nm下测定吸光值。平行3次,按照公式(抑制率=[(B-A)-(D-C)]/(B-A)×100%)计算酪氨酸酶的抑制率,并用SPSS软件计算IC50值。
2 结果与分析
2.1 化合物结构鉴定
化合物1黄色粉末;ESI-MS:m/z367.00 [M+Na]+;分子式为C18H16O7;UV(MeOH)λmax(logε)229(3.501),226(3.447),223(3.195);1H NMR(600 MHz,CDCl3)δ:12.66(1H,s,5-OH),7.71(1H,d,J= 2.0 Hz,H-2′),7.68(1H,dd,J= 8.4,2.0 Hz,H-6′),7.05(1H,d,J= 8.4 Hz,H-5′),6.45(1H,d,J= 2.2 Hz,H-8),6.36(1H,d,J= 2.2 Hz,H-6),6.14(1H,s,3-OH),4.00(3H,s,3′-OCH3),3.89(3H,s,4′-OCH3),3.87(3H,s,7-OCH3);13C NMR(150 MHz,CDCl3)δ:156.0(C-2),138.9(C-3),178.8(C-4),162.0(C-5),97.9(C-6),165.5(C-7),92.2(C-8),156.7(C-9),106.0(C-10),122.7(C-1′),122.4(C-6′),146.4(C-3′),148.3(C-4′),110.9(C-2′),114.6(C-5′),60.2(7-OCH3),56.1(4′-OCH3),55.8(3′-OCH3)。以上波谱数据与文献[6]报道对照基本一致,因此鉴定化合物1为7,3′,4′-三甲基槲皮素。
化合物2黄色粉末;ESI-MS:m/z313.10 [M-H]-;分子式为C17H14O6;UV(MeOH)λmax(logε)220(2.672);1H NMR(600 MHz,CDCl3)δ:6.92(1H,s,H-3),6.35(1H,d,J= 1.9 Hz,H-6),6.79(1H,d,J= 1.9 Hz,H-8),7.58(1H,d,J= 10.0 Hz,H-2′),6.94(1H,d,J= 8.3 Hz,H-5′),7.57(1H,s,H-6′),3.87(3H,s,OCH3),3.89(3H,s,OCH3);13C NMR(150MHz,CDCl3)δ:164.5(C-2),103.8(C-3),182.4(C-4),157.8(C-5),98.5(C-6),165.6(C-7),93.2(C-8),161.6(C-9),105.1(C-10),121.7(C-1′),110.6(C-2′),151.5(C-3′),148.6(C-4′),116.3(C-5′),121.0(C-6′),56.4(-OCH3),56.5(-OCH3)。以上波谱数据与文献[7]报道对照基本一致,因此鉴定化合物2为4′,5-二羟基-3′,7-二甲氧基黄酮。
化合物3黄色粉末;ESI-MS:m/z299.00 [M-H]-;分子式为C16H12O6;UV(MeOH)λmax(logε)221(2.886);1H NMR(600 MHz,DMSO-d6)δ:12.97(1H,s,-OH),7.43(2H,m,H-2′,6′),6.89(1H,d,J= 8.5 Hz,H-5′),6.72(1H,s,H-3),6.70(1H,d,J= 2.0 Hz,H-8),6.35(1H,d,J= 2.2 Hz,H-6),3.85(3H,s,7-OCH3);13C NMR(150 MHz,DMSO-d6)δ:182.3(C-4),165.6(C-2),164.7(C-7),161.7(C-5),157.7(C-9),150.3(C-4′),146.2(C-3′),121.9(C-1′),119.6(C-6′),116.4(C-5′),114.0(C-2′),105.1(C-10),103.6(C-3),98.4(C-6),93.0(C-8),56.5(-OCH3)。以上波谱数据与文献[8]报道对照基本一致,因此鉴定化合物3为木犀草素-7-甲醚。
化合物4黄色粉末;ESI-MS:m/z315.10 [M-H]-;分子式为C16H12O7;UV(MeOH)λmax(logε)230(10.000),226(3.732),222(3.622);1H NMR(600 MHz,DMSO-d6)δ:12.48(1H,s,-OH),7.73(1H,d,J= 2.1 Hz,H-2′),7.57(1H,dd,J= 8.5,2.2 Hz,H-6′),6.89(1H,d,J= 8.0 Hz,H-5′),6.68(1H,d,J= 2.0 Hz,H-8),6.33(1H,d,J= 2.2 Hz,H-6),3.85(3H,s,7-OCH3);13C NMR(150 MHz,DMSO-d6)δ:176.4(C-4),165.3(C-7),160.8(C-5),156.5(C-9),148.3(C-4′),147.7(C-2),145.6(C-3′),136.5(C-3),122.4(C-1′),120.5(C-6′),116.0(C-2′),115.7(C-5′),104.5(C-10),97.9(C-6),92.3(C-8),56.5(7-OCH3)。以上波谱数据与文献[9]报道对照基本一致,因此鉴定化合物4为鼠李素。
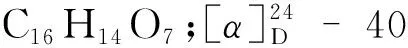
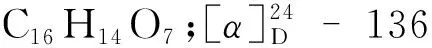
化合物7黄色粉末;ESI-MS:m/z301.00 [M-H]-;分子式为C15H10O7;UV(MeOH)λmax(logε)223(3.096);1H NMR(600 MHz,DMSO-d6)δ:7.67(1H,d,J= 2.3 Hz,H-2′),7.54(1H,dd,J= 8.5,2.3 Hz,H-6′),6.88(1H,d,J= 8.4 Hz,H-5′),6.4(1H,d,J= 2.0 Hz,H-8),6.19(1H,d,J= 2.0 Hz,H-6);13C NMR(150 MHz,DMSO-d6)δ:176.3(C-4),164.4(C-7),161.2(C-5),156.6(C-9),148.2(C-4′),147.3(C-2),145.5(C-3′),122.4(C-1′),120.5(C-6′),116.1(C-2′),115.5(C-5′),103.4(C-10),98.7(C-6),93.8(C-8)。以上波谱数据与文献[9]报道对照基本一致,因此鉴定化合物7为槲皮素。
化合物8黄色粉末;ESI-MS:m/z285.00 [M-H]-;分子式为C15H10O6;UV(MeOH)λmax(logε)229(4.129),226(3.703),223(3.508);1H NMR(600 MHz,DMSO-d6)δ:12.97(1H,s,5-OH),7.41(1H,dd,J= 8.1,2.0 Hz,H-6′),7.39(1H,d,J= 2.0 Hz,H-2′),6.89(1H,d,J= 8.1 Hz,H-5′),6.66(1H,s,H-3),6.44(1H,d,J= 2.2 Hz,H-8),6.19(1H,d,J= 2.2 Hz,H-6);13C NMR(150 MHz,DMSO-d6)δ:182.1(C-4),164.6(C-7),164.4(C-2),161.9(C-9),157.8(C-4′),150.2(C-9),146.2(C-3′),122.0(C-1′),119.5(C-6′),116.5(C-5′),113.8(C-2′),104.2(C-10),103.3(C-3),99.3(C-6),94.3(C-8)。以上波谱数据与文献[12]报道对照基本一致,因此鉴定化合物8为木犀草素。
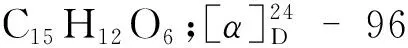

化合物11黄色粉末;ESI-MS:m/z487.30 [M+Na]+;分子式为C21H20O12;UV(MeOH)λmax(logε)222(2.942);1H NMR(600 MHz,DMSO-d6)δ:7.60(1H,d,J= 1.7 Hz,H-2′),7.56(1H,dd,J= 8.4,2.0 Hz,H-6′),6.85(1H,d,J= 8.4 Hz,H-5′),6.43(1H,s,H-8),6.21(1H,s,H-6),5.43(1H,d,J= 7.4 Hz,H-1′′),3.10~3.61(6H,m,H-sugar);13C NMR(150 MHz,DMSO-d6)δ:177.8(C-4),165.4(C-7),161.5(C-5),156.8(C-9),156.6(C-2),149.2(C-4′),145.5(C-3′),133.7(C-3),121.9(C-1′),121.5(C-6′),116.7(C-5′),115.8(C-2′),104.1(C-10),101.4(C-1′′),99.3(C-6),94.1(C-8),78.0(C-3′′),76.9(C-5′′),74.5(C-2′′),70.3(C-4′′),61.3(C-6′′)。以上波谱数据与文献[15]报道对照基本一致,因此鉴定化合物11为异槲皮苷。
化合物12淡黄色粉末;ESI-MS:m/z315.00 [M-H]-;分子式为C16H12O7;UV(MeOH)λmax(logε)231(4.147),228(3.873),226(3.649);1H NMR(600 MHz,DMSO-d6)δ:3.77(3H,s,OCH3),6.19(1H,d,J= 2.0 Hz,H-6),6.40(1H,d,J= 1.5 Hz,H-8),6.91(1H,d,J= 8.5 Hz,H-5′),7.43(1H,dd,J= 2.5,8.5 Hz,H-6′),7.54(1H,d,J= 2.5 Hz,H-2′);13C NMR(150 MHz,DMSO-d6)δ:60.1(OCH3),94.1(C-8),99.0(C-6),104.6(C-10),115.9(C-2′),116.2(C-5′),121.1(C-6′),121.2(C-1′),138.1(C-3),145.7(C-3′),149.2(C-4′),156.1(C-2),156.8(C-9),161.7(C-5),164.7(C-7),178.4(C-4,C=O)。以上波谱数据与文献[16]报道对照基本一致,因此鉴定化合物12为3-甲氧基槲皮素。


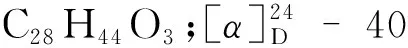
化合物16白色粉末;ESI-MS:m/z219.10 [M+Na]+;分子式为C10H12O4;1H NMR(400 MHz,CDCl3)δ:14.04(1H,s,-OH),6.05(1H,d,J= 2.3 Hz,H-3),5.91(1H,d,J= 2.3 Hz,H-5),3.85(3H,s,4-OCH3),3.82(3H,s,6-OCH3),2.61(3H,s,-COCH3);13C NMR(100 MHz,CDCl3)δ:203.1(C=O),167.5(C-4),166.0(C-6),162.8(C-2),105.9(C-1),93.4(C-3),90.7(C-5),55.5(-OCH3),32.9(-COCH3)。以上波谱数据与文献[20]报道对照基本一致,因此鉴定化合物16为2-羟基-4,6-二甲氧基苯乙酮。
化合物17白色粉末;ESI-MS:m/z181.10 [M-H]-;分子式为C9H10O4;1H NMR(600 MHz,DMSO-d6)δ:13.83(br s,-OH),5.97(1H,d,J= 2.2 Hz,H-5),5.86(1H,d,J= 2.2 Hz,H-3),3.8(3H,s,-OCH3),2.52(3H,s,-CH3);13C NMR(150 MHz,DMSO-d6)δ:202.7(C=O),166.8(C-2),165.6(C-4),163.8(C-6),105.0(C-1),96.0(C-3),91.7(C-5),56.3(-OCH3),33.0(-CH3)。以上波谱数据与文献[21]报道对照基本一致,故鉴定化合物17为2,4-二羟基-6-甲氧基苯乙酮。
化合物18无色油状物;ESI-MS:m/z235.10 [M+Na]+;分子式为C10H12O5;1H NMR(600 MHz,(CD3)2CO)δ:6.76(1H,d,J= 2.0 Hz,H-2),6.72(1H,d,J= 8.0 Hz,H-5),6.57(1H,dd,J= 8.1,2.2 Hz,H-6),4.31(1H,m,H-8),3.67(3H,s,-OCH3),2.91(1H,dd,J= 13.8,4.9 Hz,H-7a),2.78(1H,dd,J= 13.9,7.3 Hz,H-7b);13C NMR(150 MHz,(CD3)2CO)δ:174.1(C-9),144.7(C-3),143.7(C-4),129.0(C-1),120.8(C-6),116.8(C-2),114.9(C-5),71.9(C-8),51.1(-OCH3),40.0(C-7)。以上波谱数据与文献[22]报道对照基本一致,因此鉴定化合物18为丹参素甲酯。
2.2 化合物抗氧化活性筛选结果
用DPPH法对从艾纳香地上部分分离得到的18个化合物进行体外抗氧化活性的筛选,从表1中可以看出,化合物3~5、7~12、18在100 μg/mL的浓度下初筛抑制率均大于50%,表现出较好的DPPH自由基清除能力。进一步测定并计算这些化合物的IC50值,结果表明,化合物4的抗氧化活性最高,其IC50= 0.335±0.199 μg/mL,与阳性药维生素C的IC50(0.155 ± 0.030 μg/mL)值较为接近。化合物不同质量浓度对DPPH自由基清除活性的影响如图1所示,化合物3~5、7~12对DPPH自由基清除能力与浓度基本成正的量效关系,表明其抗氧化活性随着化合物质量浓度的提高而增强。但化合物18对DPPH自由基清除能力与浓度不成正的量效关系,在样品浓度为1.23 μg/mL时,抑制率最大,达到93.189%。
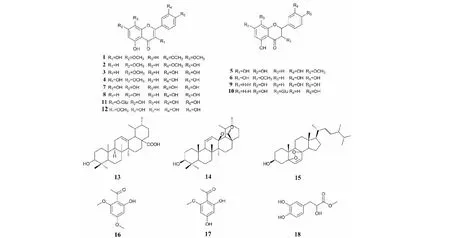
图1 化合物1~18的结构Fig.1 Structures of compounds 1-18
2.3 化合物酪氨酸酶抑制剂活性筛选结果
用酪氨酸酶催化左旋多巴(L-DOPA)氧化速率的方法对从艾纳香地上部分分离得到的18个化合物进行体外酪氨酸抑制剂活性的筛选,从表2中可以看出,化合物7、13、14、16、17在100 μg/mL的浓度下表现出较好的酪氨酸抑制剂活性。进一步测定这些化合物的IC50值,结果表明,化合物7的酪氨酸抑制剂活性最好,其IC50值为20.973±3.219 μg/mL。化合物不同质量浓度对酪氨酸抑制剂活性的影响如图2所示,化合物7、13、14、16、17对左旋多巴的清除率与浓度成正的量效关系,表明其酪氨酸抑制剂活性随着化合物质量浓度的提高而增强。
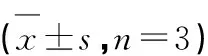
表1 DPPH自由基清除能力筛选
续表1(Continued Tab.1)

图2 不同浓度样品对DPPH的清除率Fig.2 Effects of different concentration samples on DPPH radical scavenging activity

表2 酪氨酸酶抑制活性的筛选
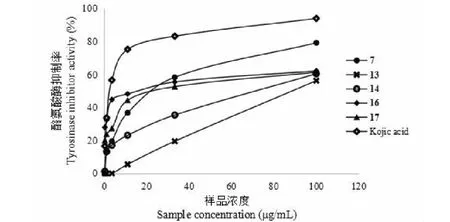
图3 不同浓度的样品对酪氨酸酶的抑制活性Fig.3 Effects of different concentration samples on tyrosinase inhibitory activity
3 结论
本文从抗氧化、酪氨酸酶抑制活性两个方面对此加以研究。本研究运用各种色谱手段从艾纳香地上部分分离纯化得到18个化合物,其中化合物10、14和18为首次从艾纳香属植物中分离得到,化合物13为首次从艾纳香中分离得到。活性测试结果发现化合物3~5、7~12、18表现出较强的DPPH自由基清除能力,化合物7、13、14、16、17有较好的酪氨酸酶抑制剂活性。结果显示化合物的DPPH自由基清除能力与酪氨酸酶抑制剂活性的关联性不大,只有化合物7在两种实验测试中均显示较好的活性,其具体作用机理还需进一步的研究。黄酮类化合物是一类很强的抗氧化剂,如槲皮素、木犀草素、圣草素等黄酮类化合物均具有较强的抗氧化性。有研究报道化合物3~5、7~9、11~13和化合物18具有较强的DPPH自由基清除能力[23,24]。有研究显示化合物4、5、7、13具有较好的酪氨酸酶的抑制作用[25,26],其余化合物对酪氨酸酶的抑制作用未见报道。本文系统地针对艾纳香中的化合物进行了分离纯化,并针对这些化合物进行了抗氧化和酪氨酸酶抑制活性研究,该研究结果为艾纳香资源进一步在抗氧化和酪氨酸酶抑制方面的应用提供了科学依据和理论支持,也为艾纳香在人体色素障碍性皮肤疾病领域和日化产品领域的开发和应用提供一些思路和方向。

