天麻素联合异钩藤碱通过线粒体途径抑制MPP+诱导PC12细胞凋亡
李晓明,荣 华,潘思文,董妙先
齐齐哈尔医学院 医药科学研究所,齐齐哈尔 161006
帕金森氏病(Parkinson’s disease,PD)是一种伴随运动缺陷症状的中枢神经系统退行性疾病。90%以上的PD为散在性发作,约10%的PD为家族性遗传发作。PD主要病理生化特征是黑质多巴胺能神经元渐进性缺失,导致纹状体多巴胺水平降低[1],1-甲基-4-苯基-1,2,3,6-四氢吡啶(1-methyl-4-phenyl-1,2,3,6-tetrahydropridine,MPTP)具有线粒体复合物Ⅰ抑制作用,进入体内后生成活性1-甲基-4-苯基吡啶离子(1-methyl-4-phenylpyridinium,MPP+),MPP+在线粒体内产生的自由基引起线粒体损伤[2]。线粒体介导的多巴胺能神经元凋亡是PD重要病理机制[3]。在PD患者死亡后的脑组织中,一些濒死的神经元表现出凋亡的形态学特征[4]。针对线粒体损伤而开展的PD治疗研究受到基础和临床医学研究者的广泛关注。自1967年Cotzias等将左旋多巴首次成功应用于PD临床治疗以来,多巴胺替代治疗一直是治疗PD的主要手段,但这种疗法仅能在一定程度上缓解临床症状,不能从根本上延缓疾病进程[5]。中医药治疗PD具有疗效稳定持久,毒副作用较小的优势。随着对PD发生、发展凋亡机制的研究深入,中药有效成分联合在PD神经保护治疗中展现出显著优势[6]。我们前期研究发现,天麻素和异钩藤碱均在体内体外帕金森病模型中发挥神经保护作用[7,8],PD是遗传和环境因素引起的复杂疾病,基于多靶点的联合用药治疗PD越来越受到关注。本研究旨在探讨天麻素和异钩藤碱联合应用保护MPP+诱导PC12细胞凋亡的作用及机制。
1 材料和方法
1.1 材料
1.1.1 仪器
Safire 2型酶标仪(瑞士Tecan公司);FACS Calibur型流式细胞仪(美国BD公司);Stratagene Mx3005P Real-time PCR仪(Agilent公司);JY-ZY5电泳槽和JY200C电泳仪(北京君意东方电泳设备有限公司);Smart ChemiTMImage Analysis System(北京赛智创业科技有限公司);HL-2000分子杂交箱(美国UVP公司);ELX800全自动酶标仪(BioTek公司)。
1.1.2 细胞株和药品
PC12细胞株(中科院上海细胞库);MPP+iodide(Sigma-Aldrich公司,批号:035M4782V);异钩藤碱(南京景竹生物科技有限公司,批号:JZ18102901);天麻素(南京景竹生物科技有限公司,批号:JZ18061402);氯化锂(Lithium chloride,LiCl;Sigma-Aldrich公司,批号:MKBV0497V);LY294002(Sigma-Aldrich公司,批号:092M4616V);PD98059(Sigma-Aldrich公司,批号:MKBR5598V)。
1.1.3 试剂和引物
Caspase-Glo®3/7Assay(Promega公司,批号:0000126888);Quantikine®rat/mouse cytochromecassay kit(R&D systems公司,批号:P131219);JC-1线粒体膜电位检测试剂盒(挧圣生物,批号:J6901150);高灵敏度化学发光检测试剂盒(康为世纪公司,批号:022819190619);二抗(康为世纪公司,批号:40420);Anti-Akt antibody(Santa Cruz公司,批号D0219);Anti-p-Akt antibody(Santa Cruz公司,批号:J0721);Cell Titer 96®AQueous Non-Radioactive cell Proliferation Assay(Promega公司,批号:0000312867);Cell Death Detection ELISAPLUSAssay Kit(Roche公司,批号:29876600);烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide,NAD+)/NADH Quantification Kit(BioVision公司,批号:9G020337)。
1.2 方法
1.2.1 细胞培养及药物处理
PC12细胞用含10%小牛血清及1%青霉素- 链霉素混合液的DMEM培养液培养,细胞置于37 ℃、5%CO2的培养箱中,每2~3天更换1次培养液。细胞密度生长融合达70%~80%时传代。加入250 μM MPP+预处理对数生长期的PC12细胞1 h后,加入天麻素(1 μM)和/或异钩藤碱(0.3 μM)共同孵育24 h后,收集细胞。为了分析细胞外调节蛋白激酶(extracellular regulated protein kinases,ERK1/2)、蛋白激酶B(Protein Kinase B,PKB/Akt)和糖原合成激酶-3β(glycogen synthase kinase-3β,GSK-3β)信号通路的作用,在MPP+损伤之前,PC12细胞用PD98059、LY294002或/和氯化锂预处理30 min。
1.2.2 caspase-3/7活性检测
按Caspase-Glo®3/7 Assay试剂盒说明书,PC12细胞加入Caspase-Glo®试剂,在室温孵育60 min后,酶标仪测量荧光值。通过计算处理组荧光值/对照组荧光值来确定caspase-3/7的活性。
1.2.3 JC-1染色法检测线粒体膜电位
按JC-1线粒体膜电位检测试剂盒说明书,PC12细胞加入JC-1染色工作液,37 ℃孵育20 min,JC-1染色缓冲液洗涤,细胞培养液重悬PC12细胞,采用流式细胞仪检测JC-1线粒体膜电位。
1.2.4 细胞色素C(cytochromec,Cyt-c)含量检测
按Quantikine®rat/mouse cytochromecassay kit试剂盒说明书,收集PC12细胞上清液,加Cyt-c结合物,加洗液,加底物溶液,加停止液。在450 nm处酶标仪测定光密度。用标准物浓度和OD值绘制标准曲线,计算PC12细胞培养上清中Cyt-c含量。
1.2.5 免疫印迹检测Akt磷酸化水平
采用细胞核蛋白与细胞浆蛋白抽提试剂盒提取PC12细胞蛋白质,通过十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分离蛋白质,湿法转膜,TBST封闭液(含5%脱脂牛奶)室温封闭PVDF膜2 h。加入p-Akt一抗杂交液4 ℃孵育过夜,TBST洗膜,加相应二抗37 ℃孵育2 h。加入超敏化学发光液发光,X光片曝光。图像分析软件AlphaEaseFCTM(瑞士Alpha Innotech公司)分析印迹条带的积分光密度,并用Akt1积分光密度值进行归一化。
1.2.6 细胞增殖分析
按CellTiter 96®AQueousNon-Radioactive Cell Proliferation Assay试剂盒说明书测定细胞增殖活性,酶标仪490 nm处测定吸光度值,细胞存活率=处理组OD值/对照组OD值×100%。
1.2.7 细胞凋亡检测
按Cell Death Detection ELISAPLUSAssay Kit试剂盒说明书,裂解PC12细胞,离心取上清液。加入检测试剂孵育,加入终止液,405 nm处测定OD值。
1.2.8 分光光度法测定细胞总NAD和NADH含量
按照NAD+/NADH Quantification Kit说明书用操作,酶标仪450 nm处测定吸光度值,根据标准曲线计算总NAD和NADH含量。
1.2.9 统计学分析
2 结果
2.1 天麻素、异钩藤碱单用及联用对PC12细胞凋亡和caspase-3/7活性的影响
ELISA结果显示(如图1A),与空白对照组比较,MPP+组PC12细胞凋亡显著增加(P<0.05);与MPP+组比较,天麻素组和异钩藤碱组PC12细胞凋亡显著减少(均P<0.05)。与天麻素或异钩藤碱单独处理组比较,天麻素联合异钩藤碱组细胞凋亡显著减少(均P<0.05)。如图1B所示,与空白对照组比较,MPP+组caspase-3/7活性显著增加(P<0.05);与MPP+组比较,天麻素组和异钩藤碱组caspase-3/7活性显著减少(均P<0.05)。而天麻素联合异钩藤碱组caspase-3/7活性较二者单独处理组显著降低(均P<0.05)。天麻素联合异钩藤碱对PC12细胞凋亡和caspase-3/7活性的抑制效应可部分被PD98059和LY294002或LiCl单独预处理逆转,而PD98059、LY294002和LiCl联合预处理则完全逆转这些药理效应。
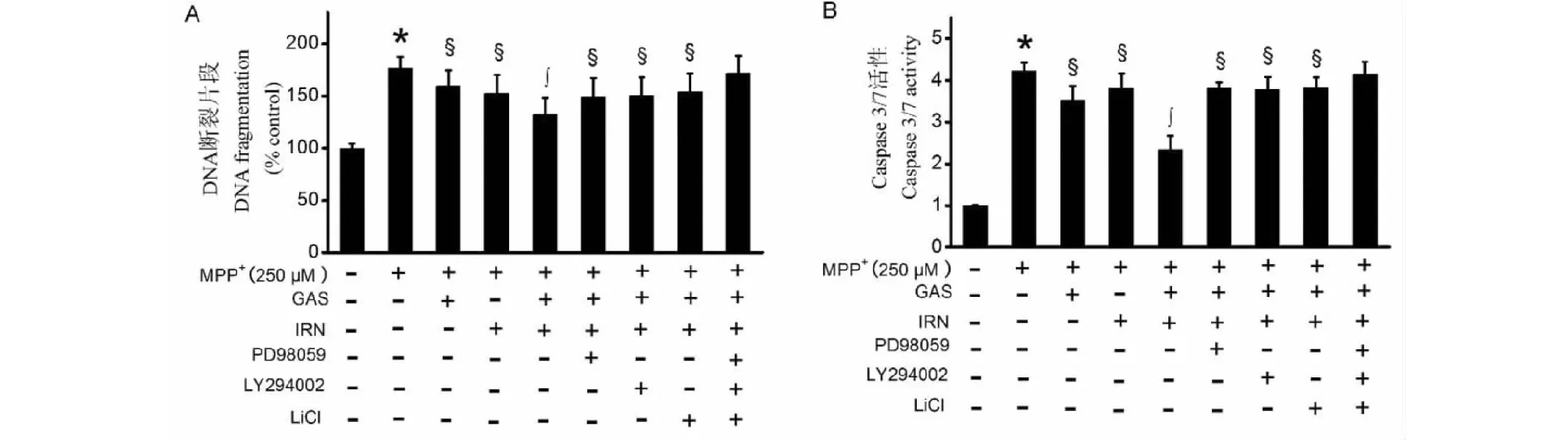
图1 天麻素联用异钩藤碱对MPP+处理的PC12细胞凋亡(A)和caspase-3/7活性(B)的影响Fig.1 Effects of gastrodin and/or isorhynchophylline on apoptosis (A) and caspase-3/7 activity (B) in MPP+-treated PC12 cells注:与空白对照组比较,*P<0.05;与MPP+组比较,§P<0.05;与天麻素或异钩藤碱单用组比较,§P<0.05;GAS:天麻素;IRN:异钩藤碱,下同。Note:*P<0.05 vs control;§P<0.05 vs MPP+;§P<0.05 vs GAS or IRN alone;GAS:Gastrodin;IRN:Isorhynchophylline.
2.2 天麻素联用异钩藤碱对MPP+诱导的PC12细胞增殖的影响
MTS分析结果显示(见图2):与空白对照组比较,MPP+组细胞增殖活性显著减少(P<0.05);与MPP+组比较,天麻素联合异钩藤碱组细胞增殖活性显著增加(均P<0.05),且天麻素联合异钩藤碱对细胞增殖活性的提高作用可部分被PD98059或LY294002单独预处理逆转,DPI则完全逆转天麻素联合异钩藤碱对细胞增殖活性的提高作用。
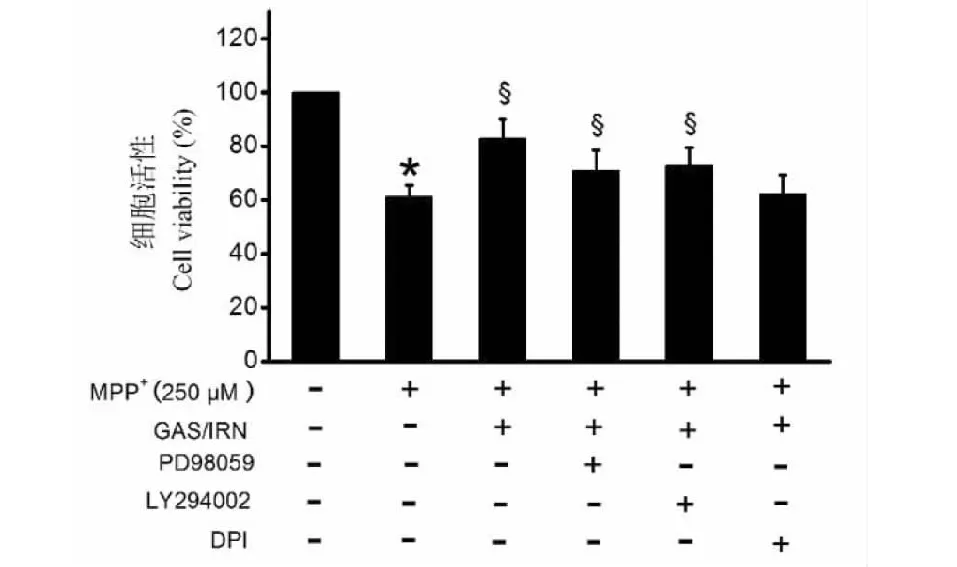
图2 天麻素联合异钩藤碱对MPP+处理的PC12细胞增殖的影响Fig.2 Effects of gastrodin combined with isorhynchophylline on cells proliferation in MPP+-treated PC12 cells
2.3 天麻素、异钩藤碱单用及联用对MPP+处理PC12细胞线粒体跨膜电位和Cyt-c释放的影响
如图3所示,与空白对照组比较,MPP+组PC12细胞JC-1红/绿比值显著降低(P<0.05),而细胞培养上清液中cyct-C含量显著增加(P<0.05)。与MPP+组比较,天麻素组JC-1红/绿比值显著增加(P<0.05),而细胞培养上清液中cyct-C含量显著减少(P<0.05)。异钩藤碱组JC-1红/绿比值显著增加(P<0.05),而细胞培养上清液中cyct-C含量无显著性差异(P>0.05)。天麻素联合异钩藤碱对JC-1红/绿比值的增加效应和对细胞培养上清液中cyct-C含量的降低效应明显强于二者单独处理组(均P<0.05)。天麻素联合异钩藤碱对JC-1红/绿比值的增加效应和对细胞培养上清液中cyct-C含量的降低效应可部分被PD98059、LY294002或LiCl单独预处理逆转,而PD98059、LY294002和LiCl联合预处理则完全逆转这些药理效应。
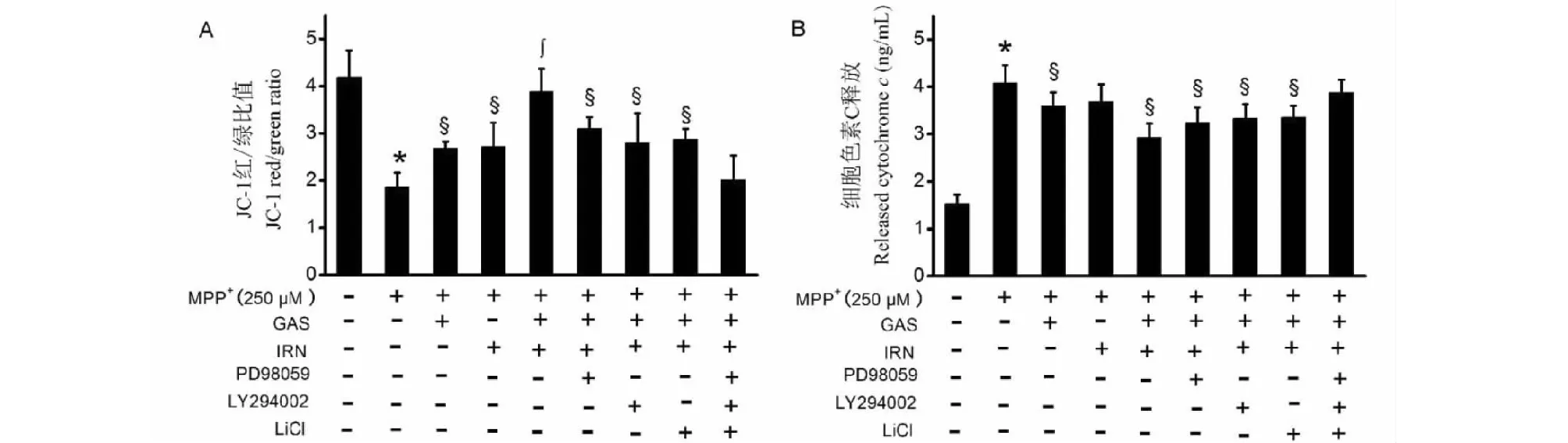
图3 天麻素、异钩藤碱单用及联用对JC-1红/绿比值(A)和细胞培养上清液中cyct-C含量(B)的影响Fig.3 Effects of gastrodin and/or isorhynchophylline on JC-1 aggregates/JC-1 monomers ratio (A) and supernatant cytochrome c concentration (B) in MPP+-treated PC12 cells
2.4 天麻素联合异钩藤碱对NAD+含量和NAD+/NADH比值的影响
如图4A和B所示,与空白对照组比较,MPP+组NAD+含量和NAD+/NADH比值显著降低(均P<0.05);与MPP+组比较,天麻素联合异钩藤碱组NAD+含量和NAD+/NADH比值显著增加。天麻素联合异钩藤碱对NAD+含量和NAD+/NADH比值的增加效应可部分被PD98059、LY294002或LiCl单独预处理逆转,而PD98059、LY294002和LiCl联合预处理则完全逆转天麻素联合异钩藤碱对NAD+含量和NAD+/NADH比值的增加效应。

图4 天麻素联合异钩藤碱对MPP+处理的PC12细胞NAD+含量(A)和NAD+/NADH比值(B)的影响Fig.4 Effects of gastrodin combined with isorhynchophylline on NAD+ concentration (A) and NAD+/NADH ratio(B) in MPP+-treated PC12 cells
2.5 天麻素、异钩藤碱单用及联用对MPP+处理PC12细胞Akt磷酸化水平的影响
我们以前研究发现,天麻素增加了MPP+处理的SH-SY5Y细胞ERK1/2磷酸化水平[8],异钩藤碱减少了GSK-3β磷酸化水平[7],Akt是调控GSK-3β磷酸化的关键上游信号分子[9]。因此,我们进一步观察天麻素、异钩藤碱单用及联用对MPP+处理PC12细胞Akt磷酸化水平的影响。Western blot结果显示(如图5A和B):与空白对照组比较,MPP+组Akt磷酸化水平无显著性差异(P>0.05);与MPP+组比较,天麻素单独组Akt磷酸化水平无显著性差异(P>0.05),异钩藤碱单独组和天麻素联合异钩藤碱组PC12细胞Akt磷酸化水平均显著增加(均P<0.05)。而天麻素联合异钩藤碱组PC12细胞Akt磷酸化水平与异钩藤碱单独组之间无显著性差异(P>0.05)。表明天麻素联合异钩藤碱活化Akt的药物组分是异钩藤碱,而不是天麻素。
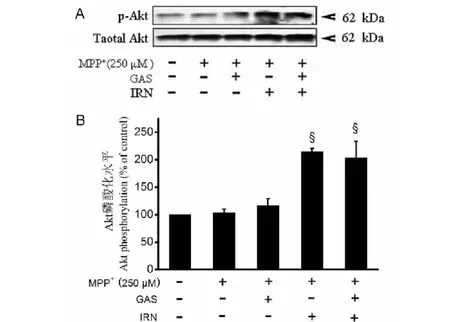
图5 天麻素或/和异钩藤碱对MPP+处理的PC12细胞Akt磷酸化的影响Fig.5 Effects of gastrodin and/or isorhynchophylline on Akt phosphorylation in MPP+-treated PC12 cells
3 讨论与结论
以改善运动症状为核心的多巴胺替代治疗目前仍是PD治疗的基石,但受到远期疗效和并发症的制约[10]。 “神经保护”已成为延缓PD进展的重要治疗策略[11]。PD是由多种因素导致的发病机制复杂疾病,而联合用药诱导的生物靶标之间的协同作用可能是改善PD复杂病理的有效手段。中药复方天麻钩藤饮能明显改善PD患者症状,我们在前期研究中发现,天麻素和异钩藤碱分别是天麻和钩藤的抗PD的主要活性成分[9]。
在PD患者脑中已经检测到许多凋亡的神经元和氧化应激,而氧化应激是启动细胞凋亡信号通路的重要因素[12],而多巴胺能神经元过度凋亡在PD的进展中都起关键作用,PD的各种病因最终可经细胞凋亡这一共同通路导致PD发病[13]。MPTP通过脑血屏障被胶质细胞摄取氧化后生成MPP+,中脑多巴胺能神经元通过多巴胺转运体摄取MPP+后,在线粒体内抑制线粒体复合物I活性,导致中脑黑质多巴胺能神经元凋亡,MPTP/MPP+是诱导PD模型的有效药物[14]。本研究显示,MPP+增加PC12细胞凋亡和caspase-3/7活性,天麻素或者异钩藤碱单独均能显著抑制PC12细胞凋亡和caspase-3/7活性,天麻素和异钩藤碱联用的抑制作用明显强于二者单独抑制作用。
近年来随着对线粒体结构和功能的深入研究,发现PD的进行性发展与线粒体密切相关[15]。线粒体功能障碍导致线粒体外膜通透性增加,线粒体内Cyt-c释放到细胞质,并与凋亡蛋白酶激活因子1结合形成多聚体,激活caspase-9和caspase-3,导致静息状态的核酸内切酶活化,最终引起DNA断裂和细胞凋亡[16],而多巴胺能神经元凋亡可导致PD的发生。本研究显示,MPP+降低PC12细胞JC-1红/绿比值,增加细胞培养上清液cyct-C含量,而天麻素和异钩藤碱联合应用对JC-1红/绿比值的增加和细胞培养上清液cyct-C降低的效应明显强于二者单独应用,提示天麻素和异钩藤碱联合应用的神经保护作用与改善线粒体功能障碍有关。ERK1/2、Akt和GSK-3β信号通路在天麻素和异钩藤碱联合应用神经保护作用中发挥重要作用。
烟酸进入体内后可以在酶的作用下生成NAD+和NADP+。NAD+是呼吸链的重要组成之一,参与生物体内的氧化还原反应,提高细胞内NAD+/NADH的含量可缓解神经退行性疾病[17]。Akt信号通路是细胞内重要的促存活信号通路,Akt磷酸化水平增加可对抗神经元凋亡并促进神经元存活,Akt已被证实参与PD发病过程[18]。有研究表明,PD患者黑质致密部Akt水平降低[19]。本研究显示,MPP+降低PC12细胞NAD+含量和NAD+/NADH比值,而天麻素和异钩藤碱联合应用提高了PC12细胞NAD+含量和NAD+/NADH比值。异钩藤碱单独或与天麻素联合均增加了PC12细胞Akt磷酸化水平。Akt在天麻素和异钩藤碱联合应用提高细胞NAD+含量和NAD+/NADH比值中发挥重要作用。
综上所述,本研究明确了天麻素与异钩藤碱联用具有协同作用,可以更好的抑制PD相关的神经元凋亡,其机制可能与改善线粒体功能有关,但是联用体外协同神经保护作用需要在体内实验验证,以及其协同神经保护的分子机制有待进一步研究。

