黑果腺肋花楸花色苷通过Nrf2机制对Aβ1-42诱导SH-SY5Y细胞产生氧化应激及细胞凋亡的保护作用
孟令帅,曹 森,彭 琳,马立志,孟宪军,周笑犁*
1贵阳学院食品与制药工程学院,贵阳550005;2沈阳农业大学食品学院,沈阳110866
阿尔茨海默病(Alzheimer’s disease,AD),又叫老年性痴呆,是一种进行性神经退行性疾病,能够导致记忆丧失,认知功能障碍,行为障碍,社会障碍,并且是痴呆的最常见原因[1,2]。据估计,全世界有2 400万人患有痴呆症,其中大多数人患有阿尔茨海默病[3]。此外,阿尔茨海默病是一种常见的与年龄相关的疾病,最常见于65岁或以上的人群[4,5]。因此,阿尔茨海默病仍然是人口老龄化的主要健康问题之一,阿尔茨海默病病例在未来几十年注定会显著增长。目前,有几种假设可以解释阿尔茨海默病的发病机制,包括β-淀粉样蛋白(Aβ)肽和tau蛋白过度磷酸化,这些在阿尔茨海默病的发病机制中起主要作用[6]。此外,越来越多的证据表明氧化应激和细胞凋亡在阿尔茨海默病中起关键作用[7]。相关研究表明,AD患者的氧化应激能够导致细胞凋亡[8,9]。同时,氧化应激能够激活细胞保护机制,包括内源性抗氧化剂和抗氧化酶系统。参与这种保护作用的主要抗氧化酶是血红素氧合酶-1(HO-1),超氧化物歧化酶(SOD),过氧化氢酶(CAT)和谷胱甘肽过氧化物酶(GSH-Px)。抗氧化酶基因的转录激活主要受核转录相关因子(Nrf2)[10]的调节。一些植物化学物质可以激活Nrf2/抗氧化反应元件(ARE)信号,从而上调抗氧化酶的表达,增强神经元对氧化应激的抵抗力[11]。在静息状态下,Nrf2以复合物的形式存在。当复合物被破坏时,Nrf2易位至细胞核并与ARE序列结合以促进抗氧化酶的表达。已知Aβ的细胞外沉积会导致神经元的氧化损伤和细胞凋亡,并且Aβ也被证明可诱导ROS和过氧化氢(H2O2)过量产生,并降低SOD和GSH-Px水平,从而导致氧化应激[12]。
目前,花色苷对于阿尔茨海默病的预防、保护等作用已经取得了一定的研究进展。Heo等[13]研究了草莓花色苷对阿尔茨海默病细胞模型的神经保护活性。研究表明,草莓花色苷能够减少氧化应激的发生以及氧化应激诱导的细胞凋亡,从而能够对神经细胞起到保护的作用。Badshah等[14]研究了黑大豆中花色苷对Aβ1-42诱导的神经退行性细胞和动物模型的神经保护作用。研究表明了花色苷通过维持Ca2+稳态,有效的减少神经细胞凋亡,对神经细胞能够起到保护作用。Meng等[15]研究了矢车菊素-3-O-葡萄糖苷对阿尔茨海默病细胞模型的保护作用。结果表明矢车菊素-3-O-葡萄糖苷能够通过调节细胞抗氧化和凋亡相关基因来保护阿尔茨海默病细胞免受Aβ1-40诱导的氧化应激和细胞凋亡。以上研究说明了花色苷可能成为AD等神经退行性疾病的潜在候选药物。此外,最近Isaak等[16]的研究发现由矢车菊-3-O-半乳糖苷,矢车菊-3-O-葡萄糖苷和矢车菊-3-O-阿拉伯糖苷组成的越橘花色苷能够保护心肌细胞免受氧化应激及细胞凋亡产生的损伤。先前的研究表明了黑果腺肋花楸中花色苷含量非常高,结构简单,主要由矢车菊-3-O-半乳糖苷,矢车菊-3-O-葡萄糖苷,矢车菊-3-O-阿拉伯糖苷及矢车菊-3-O木糖苷组成[17],高纯度的花色苷相对更容易分离出来。因此,我们选择高纯度的黑果腺肋花楸花色苷来研究对氧化应激相关的阿尔茨海默病的预防和保护作用。
1 材料与方法
1.1 材料和试剂
试验所需高纯度花色苷请参考Meng等[17];β淀粉样肽(1-42)(Aβ1-42,北京博奥森生物技术有限公司);DMEM(10565-018)、胎牛血清(fetal bovine serum,FBS,10099-141)、gluta max(35050061)(美国Gibco公司);二甲基亚砜(DMSO)(D8371,上海索莱宝公司);2,3-二甲氧基-1,4-萘醌购(D5439-5MG)、H2O2检测试剂盒(29300)(中国碧云天公司);SOD检测试剂盒(19160)、annexin V-FITC凋亡检测试剂盒(APOAF-20TST)(美国Sigma公司);Nrf2抗体(ab62352)、HO-1抗体(ab13248)、NQO1抗体(ab28947)、Bcl-2抗体(ab196495)、Bax抗体(ab32503)、GAPDH内参抗体(Sc-32233)、山羊抗兔IgG H&L (HRP,Ab6721)、山羊抗鼠IgG H&L(HRP,Ab6789)(英国Abcam公司);BCA蛋白质测定试剂盒(WLA004,沈阳万类生物有限公司);试验所需引物(沈阳汇佰生物科技有限公司);TRIzol、TaKaRa试剂盒(美国Gibco公司);SH-SY5Y细胞(中科院上海细胞库)。
1.2 主要仪器设备
倒置显微镜(中国奥林巴斯有限公司);H-2050R型超速冷冻离心机(湖南湘仪离心机有限公司);DZF-6050型真空干燥箱(上海SYSBERY仪器有限公司);iMarkTM型酶标仪(美国Bio-Rad有限公司);Mini-PROTEAN®Tetra型垂直蛋白电泳仪(美国Bio-Rad有限公司);5200型凝胶成像系统(上海Tianon有限公司);ExicyclerTM 96型荧光定量仪(韩国BIONEER有限公司)。
1.3 SH-SY5Y细胞培养及分组
SH-SY5Y细胞培养于含有5% CO2、10% FBS的37 ℃ DMEM培养基中,经过复苏、传代,然后保存于4 ℃备用。共200 g的溶解于10 mL的DMSO中,得到20 mg/mL的花色苷原液并储存于4 ℃备用。共2 mg的Aβ1-42溶解于1.8 mL的DMSO中制成257 mM的原液并储存于4 ℃备用。花色苷及Aβ1-42的浓度的筛选,细胞给药及细胞分组参考Meng等[18]的方法,细胞主要分组如下。
对照组:SH-SY5Y细胞在含有5% CO2的培养箱中于37 ℃下培养24 h。
模型组(Aβ1-42组):将Aβ1-42提前一天放入含有5% CO2的培养箱中于37 ℃老化24 h,然后加入SH-SY5Y细胞中,在含有5% CO2的培养箱中于37 ℃培养24 h,终浓度为1 μM。
低剂量药物保护组、中剂量药物保护组以及高剂量药物保护组分别先用20、40、60 μg/mL花色苷预处理SH-SY5Y细胞24 h,在含有5% CO2的培养箱中于37 ℃培养24 h,然后用1 μM Aβ1-42处理,继续在含有5% CO2的培养箱中于37 ℃培养24 h。所述Aβ1-42已在37 ℃下老化24 h。
1.4 氧化应激相关指标的测定
1.4.1 细胞内ROS(reactive oxygen species)的检测
采用2,3-二甲氧基-1,4-萘醌对SH-SY5Y细胞进行染色,使用荧光显微镜观察细胞内ROS水平。简而言之,将生长良好且没有污染的SH-SY5Y细胞弃去培养基,用适量PBS清洗细胞表面,并弃去PBS,然后在37 ℃的细胞培养箱中用适量胰蛋白酶消化细胞。待消化完成后,用胰酶2倍体积的完全培养基中止消化,并吹打培养瓶瓶底,将细胞移入离心管,1 000 rpm离心5 min,去掉上清液,加1 mL完全培养基吹打混匀细胞(沿壁轻轻吹打24次左右),每孔放入3×105个细胞,过夜,根据试验分组对细胞进行给药,过夜。爬片的细胞PBS 2 mL浸洗2次,将2,3-二甲氧基-1,4-萘醌母液稀释100倍,对已放置在盖玻片上的细胞染色15 min,PBS 2 mL浸洗2次,载玻片滴加一滴甘油,将染色好的盖玻片反扣于甘油上(细胞面朝下盖到载玻片上),透明指甲油封片,荧光显微镜200倍观察,拍照。
1.4.2 细胞内超氧化物歧化酶(superoxide dismutase,SOD)的检测
采用SOD测定试剂盒对细胞内SOD进行检测,每个浓度收集1×106个细胞,用100 μL含1%蛋白酶抑制剂的PBS稀释,并12 000 rpm离心10 min,取上清。准备96孔板,每个样品分为样品孔和三个空白孔,空白孔1、空白孔2、空白孔3。样品孔和空白孔2加入20 μL样品,在空白孔1和空白孔3中加入20 μL ddH2O;每孔加入200 μL WST working solution,并混匀。在空白孔2和空白孔3中加入Dilution Buffer 20 μL。在空白孔1和样品孔中加入20 μL Enzyme Working Solution。37 ℃孵育20 min,酶标仪450 nm处进行读数。计算公式为:
SOD活性={[(S1-S3)-(SS-S2)]/(S1-S3)}×100%
SS:样品孔的吸光度值;S1:空白孔1的吸光度值;S2:空白孔2的吸光度值;S3:空白孔3的吸光度值。
1.4.3 细胞内H2O2的检测
简而言之,将SH-SY5Y细胞在裂解缓冲液中裂解并以12 000 rpm离心10 min,弃去沉淀,将上清液储存在-20 ℃,使用BCA蛋白质定量测定试剂盒定量蛋白质含量。用H2O2检测试剂盒测量细胞内H2O2水平,并根据标准曲线计算,样品中H2O2浓度表示为μmol/g蛋白质。
1.5 Annexin-V-PI/FITC 检测细胞凋亡
采用Annexin V-PI/FITC细胞凋亡检测试剂盒检测细胞凋亡。简而言之,用PBS洗涤细胞,然后弃去PBS。在37 ℃的培养箱中用胰蛋白酶消化细胞。然后用完全培养基终止消化,并将细胞转移到离心管中。将细胞以1 000 rpm离心5 min,弃去上清液。吹打细胞并与1 mL培养基混合,向每个孔中加入1×106个细胞并放入培养箱中过夜。根据实验组处理细胞并在孵育24 h后收集。用1×结合缓冲液将细胞悬浮至1×106/mL,并将500 μL细胞悬浮液加入与5 μL Annexin V FITC和10 μL PI混合于每个流动管中。最后,将反应体系在室温下避光孵育,并使用BD C6流式细胞仪进行检测。
1.6 蛋白质印迹(Western blot)
根据试验分组对SH-SY5Y细胞进行给药处理。根据文献所述提取蛋白质[14]。采用BCA蛋白质定量测定试剂盒测定蛋白质水平,十二烷基硫酸钠-聚丙烯酰胺凝胶分离电泳(SDS-PAGE)分离蛋白质,并将其转移到PVDF膜,将膜用PBST浸泡,在室温下转移到封闭溶液中1.5 h,然后与PBST稀释的一抗钙调蛋白、细胞色素c、caspase-9、裂解的caspase-3、Bcl-2、Bax等抗体(抗体信息见表1)在4 ℃培养过夜(GAPDH为内参蛋白)。将膜与二抗以1∶2 000的稀释度按照上述方式制备,室温孕育1.5 h,然后用PBST洗涤三次,大约10 min。采用ECL显色试剂盒进行化学发光反应,用ECL发光仪器观察条带,并用凝胶图像处理系统进行光密度分析。

表1 抗体
1.7 实时荧光定量PCR(quantitative real-time PCR)
取对数生长期SH-SY5Y细胞,PBS洗涤细胞表面,弃去PBS,然后在37 ℃的细胞培养箱中用胰蛋白酶消化细胞,消化完成后,使用完全培养基终止消化,吹打培养瓶底部,将细胞转移到离心管中,1 000 rpm离心5 min,弃去上清液,用1 mL完全培养基反复洗涤细胞三次并用其混合,然后在37 ℃的细胞培养箱中培养过夜。根据试验分组对SH-SY5Y细胞进行给药处理,并将其置于含有5% CO2的培养箱中于37 ℃下培养24 h,然后收集。使用TRIzol从培养的SH-SY5Y细胞中提取总RNA,并使用TaKaRa试剂盒进行逆转录。以通过反转录获得的cDNA为模板,采用荧光定量PCR仪进行扩增,反应体系为20 μL,其中,cDNA模板1 μL,上下游引物(10 μM)(见表2)各0.5 μL,SYBR GREEN mastermix 10 μL,然后ddH2O补足至20 μL。反应条件为95 ℃,10 min,(95 ℃,10 s;60 ℃,20 s;72 ℃,30 s)共40个循环,4 ℃,5 min。最后采用Exicycler 96实时定量荧光检测器进行RT-PCR分析。

表2 荧光定量PCR所用引物
1.8 数据统计与分析
采用Excel软件计算平均值和标准差。采用SPSS 17.0软件对所得数据进行统计分析。采用单因素方差分析(ANOVA)法进行组间差异显著性分析,P<0.05为显著,P<0.01为极显著。采用Origin 7.5软件作图。
2 结果与分析
2.1 细胞内ROS的测定
由图1的结果我们可以看出,与对照组(control)相比,模型组(Aβ1-42)中的氧自由基明显增多,说明Aβ1-42能够诱导SH-SY5Y细胞产生氧化应激。此外,与模型组相比,药物保护组中的氧自由基明显减少,而且,随着药物保护组中花色苷(anthocyanins,Ant)剂量的升高,细胞中的氧自由基也不断降低。其中,高剂量药物保护组(Aβ1-42+Ant(60 μg/mL))细胞中的氧自由基含量最少,对细胞的保护作用最好。说明Ant能够削弱Aβ1-42诱导SH-SY5Y细胞产生的氧化应激,能够对细胞起到保护作用。

图1 细胞内ROS的测定Fig.1 The determination of intracellular ROS注:红色:氧自由基生成增多;蓝色:抗氧化作用增加,氧自由基受抑制;G1:对照组;G2:模型组;G3:花色苷干预组(20 μg/mL);G4:花色苷干预组(40 μg/mL);G5:花色苷干预组(60 μg/mL),下同。Note:Red:oxygen free radical production increased;Blue:antioxidant effect increased and oxygen free radical was inhibited;G1:Control group;G2:Model group (Aβ1-42);G3:Aβ1-42+Ant (20 μg/mL);G4:Aβ1-42+Ant (40 μg/mL);G5:Aβ1-42+Ant (60 μg/mL),the same below.
2.2 细胞内SOD的测定
由图2的结果可以看出,与对照组相比,模型组的SOD活性显著低于对照组(P<0.05),大约降低16.24%。与模型组相比,药物保护组中随着花色苷含量的升高,SOD的活性逐渐显著升高(P<0.05),其中,高剂量药物保护组(Aβ1-42+Ant(60 μg/mL))的SOD活性最高为99.54%,与模型组相比,SOD活性升高了23.24%。
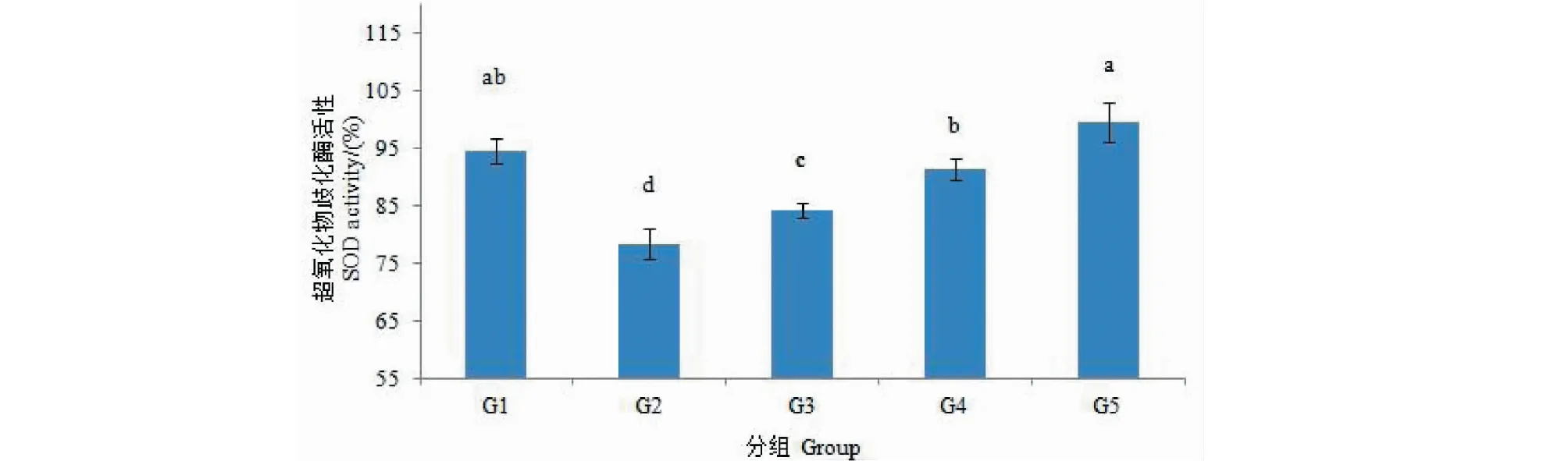
图2 细胞内SOD的测定Fig.2 The determination of intracellular SOD注:小写字母不同表示差异显著(P<0.05)。Note:Different lowercase letters represent significant difference (P<0.05).
2.3 细胞内H2O2的测定
从图3可以看出,与对照组相比,模型组(Aβ1-42)细胞内H2O2的产生显著增加(P<0.05),表明Aβ1-42可诱导H2O2的产生。此外,在药物保护组中,随着花色苷浓度的增加,细胞内H2O2的产生与模型组相比显著降低(P<0.05)。当花色苷浓度为60 μg/mL时,与对照组相比,细胞内H2O2的产生无明显变化(P>0.05)。这些结果表明,黑果腺肋花楸花色苷可以减少SH-SY5Y细胞中Aβ1-42诱导的H2O2的产生。

图3 细胞内H2O2的测定Fig.3 The determination of intracellular H2O2注:小写字母不同表示差异显著(P<0.05)。Note:Different lowercase letters represent significant difference (P<0.05).
2.4 细胞凋亡的检测
从图4和表3可以看出,与对照组相比,模型组中早期细胞凋亡率增加了3.3%,晚期细胞凋亡率增加了4.5%,细胞总凋亡率增加了7.8%,表明Aβ1-42可诱导SH-SY5Y细胞凋亡。与模型组相比,在药物保护组中,随着药物保护组中花色苷含量的增加,早期凋亡率,晚期凋亡率和总细胞凋亡率逐渐降低。当花色苷浓度为60 μg/mL时,与模型组相比,总细胞凋亡率下降了8.3%。这些结果表明,黑果腺肋花楸花色素苷预处理能够有效的削弱Aβ1-42诱导SH-SY5Y细胞产生的细胞凋亡。

表3 SH-SY5Y细胞凋亡

图4 SH-SY5Y细胞凋亡Fig.4 The apoptosis in SH-SY5Y cell
2.5 蛋白印记分析
通过蛋白质印迹分析Nrf2相关抗氧化蛋白及凋亡相关蛋白表达,结果显示在图5中。与对照组相比,Aβ1-42组中Nrf2、HO-1、NQO1、Bax蛋白表达上调,Aβ1-42组Bcl-2蛋白表达下调。在药物保护组中,随着花色苷浓度的增加,与模型组相比,Nrf2、HO-1、NQO1蛋白的表达逐渐上调,Bax蛋白的表达逐渐下调,当花色苷浓度为60 μg/mL时,Nrf2、HO-1和NQO1蛋白的表达量最高,Bax蛋白的表达量最低。此外,当花色苷浓度为20 μg/ mL时,与对照组相比,Bcl-2蛋白表达略有下调,之后随着花色苷浓度的增加,Bcl-2蛋白表达逐渐上调。当花色苷浓度为60 μg/mL时,Bcl-2蛋白表达量最高。这些结果说明花色苷能够激活Nrf2,使其转入细胞核内促进HO-1及NQO1蛋白的表达。此外,花色苷也能够促进抗凋亡蛋白Bcl-2的表达,抑制促凋亡蛋白Bax的表达。
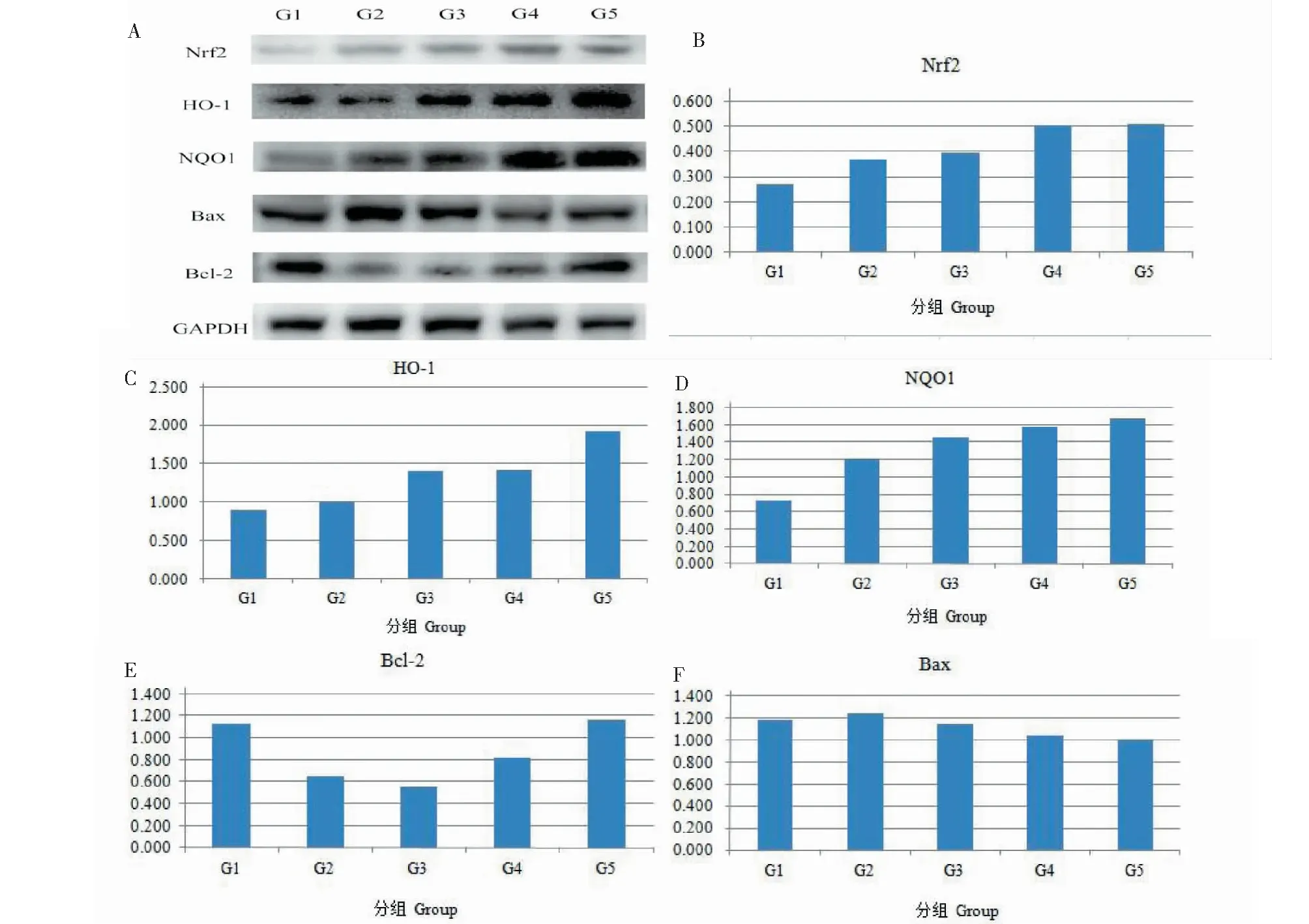
图5 Aβ1-42诱导的SH-SY5Y细胞中的凋亡相关蛋白的蛋白印记分析Fig.5 Western blot analysis of apoptotic-related proteins in Aβ1-42-induced SH-SY5Y cells
2.6 RT-PCR分析
通过RT-PCR检测Nrf2相关基因和凋亡相关基因的转录,详细结果见图6。从图中可以看出,与对照组相比,Aβ1-42组中Nrf2、HO-1、NQO1和Bax相对mRNA表达显著上调(P<0.05),Aβ1-42组中Bcl-2相对mRNA表达显著下调(P<0.05)。在药物保护组中,与模型组相比,当花色苷浓度为20 μg/mL时,Nrf2相对mRNA表达下降0.095,随着花色苷浓度的继续增加,Nrf2相对mRNA表达与模型组相比显著上调(P<0.05)。当花色苷浓度为20 μg/mL时,NQO1、Bcl-2相对mRNA表达与模型组相比无显著变化(P>0.05),随着花色苷浓度的继续增加,NQO1、Bcl-2相对mRNA表达相比于模型组显著上调(P<0.05)。此外,随着花色苷浓度的增加,与模型组相比,HO-1相对mRNA表达显著上调(P<0.05),Bax显著下调(P<0.05)。
3 讨论与结论
氧化应激产生的ROS直接或间接地损伤细胞内蛋白质、脂质、核酸等大分子物质的生理功能,是众多疾病发生的病理生理基础。机体在应对氧化应激的发生时形成了一套复杂的氧化应激应答系统来应对自由基和有毒物质的损害,当暴露于亲电子试剂或活性氧刺激时,机体自身能诱导出一系列的保护性蛋白,以缓解细胞所受的损害[19]。这一协调反应是由保护性蛋白DNA 上游调节区的抗氧化反应元件(antioxidant responsive element,ARE)来调控的。研究表明,核转录相关因子Nrf2 (nuclear factor erythroid 2-related factor 2,Nrf2)通过与ARE 相互作用调节编码抗氧化蛋白,是迄今为止发现的最为重要的内源性抗氧化应激通路[20]。先前的研究已经表明了花色苷因其较强的抗氧化能力,能够清除体内自由基,降低氧化应激水平,保护机体免受氧化应激造成的损伤[21-23]。随着研究的进一步深入,研究表明花色苷能够通过Nrf2信号通路上调相关抗氧化酶的表达,降低氧化应激水平,从而保护阿尔茨海默病细胞或者动物模型免受氧化应激引起的损伤[24]。

图6 RT-PCR对Aβ1-42引诱的SH-SY5Y细胞中相对mRNA表达分析Fig.6 The relative mRNA expression analysis using Real Time-PCR in Aβ1-42-induced SH-SY5Y cells注:小写字母不同表示差异显著(P<0.05)。Note:Different lowercase letters represent significant difference (P<0.05).
此外,细胞凋亡经常伴随氧化应激的发生而发生,并且哺乳动物细胞中的细胞凋亡通过外在和内在途径进行。外在途径涉及细胞外信号因子与质膜中死亡受体的结合[25]。内在途径由细胞内应激激活并通过线粒体进行。线粒体凋亡途径受Bcl-2家族的调节,Bcl-2家族包括抗凋亡蛋白如Bcl-2和Bcl-xL,以及促凋亡蛋白如Bax和Bak[26]。近年来,研究表明氧化应激和细胞凋亡促进了AD的发展。因此,发掘可以预防神经元氧化损伤和凋亡的生物活性物质,从而有助于预防和控制AD,具有重要的研究意义。
在前言中已经介绍了,目前一些研究已经报道花色苷能够通过减少氧化应激的发生以及氧化应激诱导的细胞凋亡从而对阿尔茨海默病起到预防和保护的作用。因此本研究采用Aβ1-42诱导的SH-SY5Y细胞构建阿尔茨海默病细胞模型系统,选择ROS、SOD、H2O2作为氧化应激相关指标,通过Nrf2信号通路研究花色苷对氧化应激及细胞凋亡的保护作用,评价花色苷的细胞保护作用。结果表明了黑果腺肋花楸花色苷能够激活Nrf2代谢通路,上调HO-1、NQO1基因mRNA及蛋白的表达,从而上调HO-1、NQO1、SOD等相关抗氧化酶的表达,降低细胞内的氧化应激水平。同时,黑果腺肋花楸花色苷还能够上调Bcl-2基因及蛋白的表达,下调Bax基因及蛋白的表达,从而降低细胞的凋亡。因此,黑果腺肋花楸花色苷能够有效保护阿尔茨海默病免受Aβ1-42诱导SH-SY5Y细胞产生的氧化应激及细胞凋亡。先前的关于花色苷对阿尔茨海默病影响的研究大多数采用的花色苷均为粗提物或者混合物,而本次研究采用的花色苷混合物结构简单明确,并且纯度达到93%以上,更能够说明花色苷对阿尔茨海默病的作用,这对于花色苷及其相关产品的进一步开发具有重要的意义。

