肺癌患者PET-CT的最大标准摄取值的临床意义
吴忠伟
(南通大学附属瑞慈医院影像科 江苏 南通 226010)
随着影像技术的迅猛发展,正电子发射断层扫描/计算机断层扫描(PET/CT)已广泛应用于临床的疾病检测和诊断,在肺癌的筛查诊断、术前的分期诊断中日益重要[1]。本研究回顾性分析本院2019年1月—2020年12月收治确诊的69例肺癌患者的PET-CT影像学资料以及临床资料,分析PET-CT的原发病灶的最大标准摄取值(maximal standardized uptake values, SUVmax)与患者的年龄、性别、分化程度、病理类型、TNM分期、淋巴结转移的关系,应用受试者工作特征曲线(receiver operating characteristic curve, ROC曲线)分析淋巴结的SUVmax对淋巴结转移的诊断效能,现将结果报道如下。
1 资料与方法
1.1 一般资料
选取本院2019年1月—2020年12月收治确诊的69例肺癌患者为研究对象,其中男性42例,女性27例,年龄39~59岁,平均(57.65±12.59)岁。腺癌30例,鳞癌21例,腺鳞癌16例,小细胞肺癌2例。高分化18例,中分化40例,低分化11例。TNMⅠ期21例,Ⅱ期36例,Ⅲ期12例。淋巴结转移51例,无淋巴结转移18例。所有患者均为首次确诊的患者,术前未经任何抗肿瘤治疗。排除肺部其他病变患者、继发肿瘤患者和患有其他肿瘤患者。本研究经医院伦理委员会批准(伦理审批号:20201203)。
1.2 PET-CT检查方法
所有患者空腹,血糖10 mmol/L以下,注射18F-FDG(华谊),休息1 h后,应用GE discovery IQ扫描仪进行扫描,扫描参数设置如下:①肺部CT平扫:5 mm层厚,5 mm间隔,螺距1.375:1,电压120 kV,Smart mA,Auto mA,mA Range 180~440,重建1.25 mm薄层。②体部PET CT扫描:检查范围从眼眶至股骨中上段(特殊病例可扫描至足趾)。CT部分:3.75 mm层厚,3.26 mm间隔,螺距0.938:1,电压120 kV,Smart mA,Auto mA,mA Range 120~350;PET部分:使用GE最新迭代技术,Q.Clear值400,矩阵192×192,单个床位宽度202.12 m m,扫描5个床位,重叠10~15,单个床位扫描时间2 min,共10 min。③头颅PET CT扫描: CT部分:3.75 mm层厚,3.26 mm间隔,螺距0.938:1,电压120 kV,Smart mA,Auto mA,mA Range 180~440;PET部分:Q.Clear值180,矩阵256×256,单个床位宽度202.12 mm,扫描1个床位,单个床位扫描时间3 min,共3 min。由2位影像科副主任及以上医师对影像资料采取双盲法阅片,利用PET代谢信息以及CT影像解剖学信息,即在PET图像上测出原发病灶以及可疑淋巴结最大标准摄取值(SUVmax)。
1.3 统计学处理
本研究所得数据应用SPSS 21.0数据软件包进行统计分析。本研究所得计量资料符合正态分布,用均数±标准差表示。本研究所得计数资料用构成比表示。两组间均数比较采用独立t检验,三组以上均数比较采用单因素方差分析。应用Spearman相关分析原发病灶的SUVmax与患者的年龄、性别、分化程度、病理类型、TNM分期、淋巴结转移的相关性。应用ROC曲线分析淋巴结的SUVmax对淋巴结转移的诊断效能。以P<0.05认为差异有统计学意义。
2 结果
2.1 肺癌原发灶SUVmax与临床特征的关系
统计分析结果显示,肺癌原发灶SUVmax与患者的年龄、性别、病理分型无相关性。TNMⅡ、Ⅲ期患者肺癌原发灶SUVmax显著高于TNMⅠ期患者,差异有统计学意义(P<0.05),但是TNMⅡ、Ⅲ期患者肺癌原发灶SUVmax差异无统计学意义(P>0.05),Spearman相关性分析显示肺癌原发灶SUVmax与TNM分期呈正相关(r=0.493,P<0.01)。低分化患者肺癌原发灶SUVmax最高,中分化的次之,高分化的最低,三者间差异均有统计学意义(P<0.05),Spearman相关性分析显示肺癌原发灶SUVmax与分化程度呈负相关(r=-0.570,P<0.01)。淋巴结转移的患者肺癌原发灶SUVmax显著高于无淋巴结转移的患者,差异有统计学意义(P<0.05),Spearman相关性分析显示肺癌原发灶SUVmax与淋巴结转移呈正相关(r=0.28,P=0.02<0.05)。见表1。
表1 肺癌原发灶SUVmax与临床特征的关系(± s)
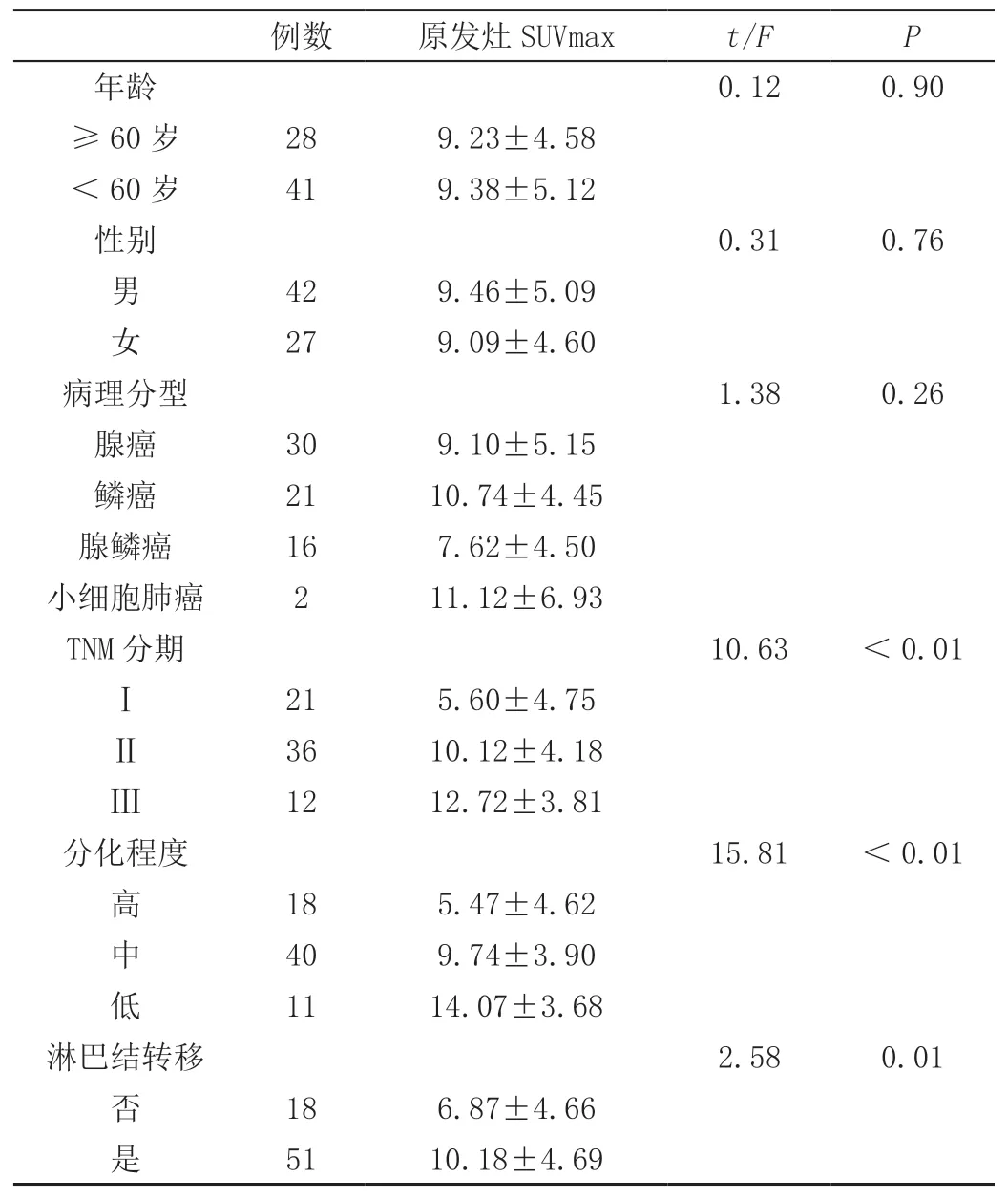
表1 肺癌原发灶SUVmax与临床特征的关系(± s)
?
2.2 淋巴结SUVmax对肺癌淋巴结转移的诊断效能
淋巴结转移患者的淋巴结SUVmax(7.30±4.54)显著高于无淋巴结转移患者(4.64±3.70),差异有统计学意义(t=2.23,P=0.03<0.05)。ROC曲线分析显示,当淋巴结SUVmax的Cutoff值为1.96时,对肺癌淋巴结转移的诊断曲线下面积(area under curve,AUC)为0.68(95%CI:0.56~0.79,P=0.01),对肺癌淋巴结转移的诊断灵敏度、特异度、准确率分别为90.20%(46/51)、44.44%(8/18)、78.26%(54/69)。见表2、图1。

表2 淋巴结SUVmax对肺癌淋巴结转移的诊断效能
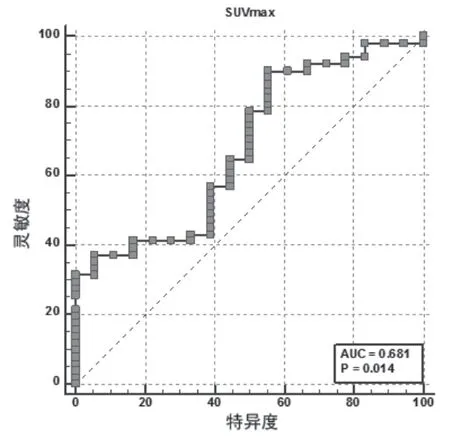
图1 ROC曲线分析淋巴结SUVmax对肺癌淋巴结转移的诊断效能
3 讨论
PET/CT的混合成像技术可为肿瘤的早期诊断提供组合的功能和形态学信息[2-3]。PET属于非侵入性功能成像方法,可以早期检测包括肺癌在内的肿瘤患者的受影响组织的病理生理变化,并且这些功能变化可能发生在解剖变化之前。目前,18F-FDG是肿瘤学中最常用的PET放射性示踪剂,这种放射性标记的葡萄糖类似物通过细胞膜葡萄糖转运蛋白被细胞吸收,随后被细胞内的己糖激酶磷酸化。18F-FDG PET或PET/CT识别肿瘤病变的能力主要与大多数肿瘤细胞的糖酵解活性增加有关[4]。通常肿瘤组织具有很高的代谢活性,增加了葡萄糖的摄取,因此在肿瘤组织中高度积累了18FDG,从而增加了SUV。
目前在辅助诊断肺癌时主要使用三种类型的SUV来评估病灶,分别是SUVmax、感兴趣区域(ROI)的平均SUV以及在整个肿瘤体积上的SUV。据研究报道,在这些各种半定量方法中,SUVmax可为单发肺结节提供最高的诊断准确性[5]。但是SUVmax与肺癌的临床特征关系如何则鲜见报道,本研究的结果显示,肺癌原发灶SUVmax与患者的年龄、性别、病理分型无相关性,与TNM分期以及淋巴结转移呈正相关,与分化程度呈负相关。结果提示,肺癌原发灶SUVmax可能有助于肺癌患者的术前评估,对指导治疗具有一定的临床意义。以往的研究表明,淋巴结的FDG代谢水平可以帮助诊断淋巴结转移。但是,可以清楚地区分淋巴结转移的SUVmax的阈值仍不明确。本研究结果显示,淋巴结转移患者的淋巴结SUVmax显著高于无淋巴结转移患者(P<0.05)。ROC曲线分析显示,当淋巴结SUVmax的Cutoff值为1.96时,对肺癌淋巴结转移的诊断AUC为0.68(95%CI:0.56~0.79),对肺癌淋巴结转移的诊断灵敏度、特异度、准确率分别为90.20%、44.44%、78.26%。结果提示,在本研究的样本中,淋巴结SUVmax对诊断淋巴结转移的灵敏度较高,但是特异度较差,本研究样本数量较少,而且是单中心的回顾性研究,是否能够联合其他预测因素进行联合诊断,以提高其诊断效能有待于我们后续进一步的分析研究。
综上所述,PET-CT肺癌原发病灶的SUVmax与肺癌分化程度、TNM分期及淋巴结转移密切相关,淋巴结的SUVmax对淋巴结转移诊断具有一定的临床应用价值。

