国产人工打洞沉香中一个新的2-(2-苯乙基)色酮二聚体
胡汝慧 李薇 王昊 梅文莉 米承能 袁靖喆 戴好富


摘 要:为进一步研究国产人工打洞法所结沉香中的化学成分,本研究采用硅胶柱色谱、Sephadex LH-20、半制備高效液相等色谱方法从其乙酸乙酯萃取物中分离纯化得到2个单体化合物。根据核磁共振(NMR)、质谱(MS)等波谱数据分别鉴定为2-(2-苯乙基)色酮二聚体(+)-3′,3′′′-dihydroxy-4′,4′′′-dimethoxyaquisinenone G (1)和aquilasinenone F (2),其中化合物1为新化合物。抗氧化活性测试结果表明,化合物1和2都对DPPH自由基具有一定的清除能力,其中化合物2的IC50 值为(64.6±1.6)mol/L,阳性对照为L(+)-抗坏血酸。
关键词:国产人工打洞沉香;2-(2-苯乙基)色酮二聚体;DPPH;分离鉴定
Abstract: In order to further study the chemical constituents of Chinese agarwood induced by artificial holing, two compounds were isolated from the ethyl acetate extract of the agarwood by silica gel column chromatography, Sephadex LH-20, semi-preparative HPLC column chromatography and other methods in this study. According to NMR, MS and other spectral data, they were identified as dimeric 2-(2-phenethyl) chromones, (+)-3′,3′′′-dihydroxy-4′,4′′′- dimethoxyaquisinenone G (1) and aquilasinenone F (2). Compound 1 is a new compound. The results of activity measurement showed that both compounds had certain scavenging ability to 2,2-Diphenyl- 1-picrylhydrazyl (DPPH) radicals. The IC50 value of compound 2 was (64.6±1.6)mol/L, and the positive control was L (+)-ascorbic acid.
Keywords: Chinese agarwood induced by artificial holing; dimeric 2-(2-phenethyl)chromone; DPPH; isolation and identification
沉香为瑞香科(Thymelaeaceae)沉香属(Aquilaria)或拟沉香属(Gyrinops)物含有树脂的木材[1]。沉香作为一种传统中药,其味辛、苦,性微温,广泛应用于止痛、止咳、止吐,并可以缓解胃病、咳嗽、风湿和高烧[2-3]。白木香是我国沉香的唯一基原植物,主要分布在海南、福建、广东及广西等地区,其所结树脂称为“国产沉香”[4-6]。白木香只有在自然伤害(雷劈、风害、虫蛀等)或人为伤害(砍伤、凿洞、接菌等)下才会结香[7]。随着人们对沉香需求的不断扩大,其野生资源面临枯竭,沉香作为濒危物种目前已被列入《濒危野生动植物种国际贸易公约》(CITES)名录[8]。因此,在其野生资源利用受到限制的情况下,为了满足沉香的市场需求,人工结香技术不断地发展,其中人工打洞法是一种较为常见的人工结香方法[9]。
前期在对人工打洞法产生的“国产沉香”化学成分的研究中,本课题组分离鉴定了一系列的倍半萜类和2-(2-苯乙基)色酮类化合物[9-16]。为了进一步揭示人工打洞对沉香化学成分的影响,本研究对国产沉香的乙酸乙酯萃取部分进行分离纯化,采用波谱学方法对化合物进行鉴定,以期从中发现更多具有不同连接方式的二聚体,丰富沉香中2-(2-苯乙基)色酮聚合物的骨架结构,为国产沉香的进一步开发利用提供一定的科学依据。
1 材料与方法
1.1 材料
1.1.1 植物材料 结香4年的国产人工打洞沉香样品(4.7 kg)于2012年11月采自云南省西双版纳傣族自治州,经中国热带农业科学院热带生物技术研究所代正福副研究员鉴定其基原植物为白木香[Aquilaria sinensis (Lour.) Gilg],样本保存在中国热带农业科学院热带生物技术研究所(标本编号为AW20121108)。
1.1.2 仪器与设备 薄层色谱硅胶板和柱色谱硅胶,青岛海洋化工厂;Sephadex LH-20,德国默克公司;N1000(2 L)立式旋转蒸发仪,上海爱朗仪器有限公司;安捷伦1260分析型高效液相色谱仪,美国安捷伦科技有限公司;Bruker AV 500型超导核磁共振波谱仪,德国布鲁克公司;ELX-800酶标仪,美国宝特公司;UV-2550紫外可见分光光度计,日本岛津公司;API QSTAR Pulsar 质谱仪(HR-ESI-MS),德国布鲁克公司;AV-500Nicolet 380红外光谱仪,美国赛默公司;MCP 5100旋光仪,美国安东帕公司;万分之一电子秤,北京赛多利斯天平有限公司;JASCO J-715分光光度计,日本分光株式会社;SUMMIT P680A半制备高效液相色谱仪,美国戴安公司;半制备色谱柱(C18,250 mm×10.0 mm,ID),日本半井公司。
1.1.3 主要试剂 浓硫酸(≥98%),淄博滨岭化工有限公司;核磁共振用氘代试剂(≥99%),德国默克公司;乙腈、甲醇,色谱纯,天津科密欧公司;甲醇、氯仿,分析纯,天津科康德公司;石油醚、乙酸乙酯和丙酮,均为分析纯,广州化工公司;2,2-联苯基-1-苦基肼基,Sigma公司;L(+)-抗坏血酸,国药集团公司。
1.2 方法
1.2.1 化学成分的分离 国产人工打洞沉香(4.7 kg)粉碎成粉末后用95%乙醇溶液加热回流提取3次,减压浓缩后得到乙醇提取物(510.0 g)。提取物分散至水中后依次用乙酸乙酯和正丁醇各萃取3次,萃取液分别经减压浓缩,得到乙酸乙酯浸膏(310.0 g)和正丁醇浸膏(199.0 g)。将乙酸乙酯相(310.0 g)经减压硅胶柱色谱,用氯仿∶甲醇(1∶0~0∶1)梯度洗脱得到9个流份(Fr.1~9)。Fr. 5(89.6 g)首先经MCI柱色谱除去部分色素得到86.6 g,经减压硅胶柱(石油醚∶丙酮=2∶1,1∶1,1∶1,1∶20)分成6个流份(Fr.5-a~f),将其中Fr.5-c(46.8 g)经Sephadex LH-20(氯仿∶甲醇=1∶1)凝胶柱色谱洗脱得5个流份(Fr.5-c-1~5)。Fr.5-c-3(5.8 g)经反相柱色谱(甲醇∶水=3∶7~1∶0)梯度洗脱得到11个流份(Fr.5-c-3-1~11),其中Fr.5-c-3-5(299.0 mg)经Sephadex LH-20(氯仿∶甲醇=1∶1)凝胶柱色谱洗脱得3个流份(Fr.5-c-3-5-1~3),再将Fr.5-c- 3-5-2(228.3 mg)减压硅胶柱色谱,用氯仿∶甲醇(80∶1~0∶1)梯度洗脱得到5个流份(Fr.5- c-3-5-2-1~5),最后Fr.5-c-3-5-2-3(66.3 mg)经半制备高效液相色谱C18柱;28%乙腈-水系统为流动相;流速4 mL/min;检测波长210 nm得到化合物1(1.4 mg,tR=39.5 min)。Fr.5-c-3-4(240.9 mg)经Sephadex LH-20(氯仿∶甲醇=1∶1)凝胶柱色谱洗脱得5个流份(Fr.5-c-3-4-1~5),再将Fr.5-c-3-4-4(106.8 mg)减压硅胶柱色谱,用氯仿∶甲醇(80∶1~0∶1)梯度洗脱得到6个流份(Fr.5-c-3-4-4-1~6),最后Fr.5-c-3-4-4-5(36.5 mg)经半制备高效液相色谱C18柱;45%甲醇-水系统为流动相;流速4 mL/min;检测波长210 nm得到化合物2(1.5 mg,tR=16.3 min)。
1.2.2 DPPH自由基清除率的测定 参照文献[17]对化合物1和2进行DPPH自由基清除能力测定。用无水乙醇配制0.1 mmol/L的2,2-联苯基-1-苦基肼基(DPPH)溶液,避光保存;配制100 mmol/L (+)-抗坏血酸(Vc)溶液(作为阳性对照);将待测样品稀释为1000.00、500.00、250.00、125.00、62.50、31.25 ?mol/L不同浓度。将以下各溶液混匀于96孔酶标板后置于酶标仪中:实验组20 ?L待测样品溶液+180 ?L DPPH溶液,阴性对照20 ?L DMSO溶液+180 ?L DPPH溶液,阳性对照20 ?L Vc溶液+180 ?L DPPH溶液,空白对照20 ?L DMSO溶液+180 ?L无水乙醇溶液。避光保存30 min,于酶标仪517 nm波长处测其吸光度。计算出样品对DPPH自由基的清除率和IC50值,每个分析样品重复3次。清除率计算公式如下:
1.2.3 化合物的结构鉴定方法 (1)核磁共振谱(NMR):用约0.5 mL的CD3OD氘代试剂溶解纯化合物,并转移到微量核磁管中進行核磁共振测试。
(2)质谱(MS):微量样品用色谱级甲醇溶解后过0.45 ?m 微孔滤膜,再用进样针吸取少量样品溶液注入质谱仪中,采集信息。质谱条件:阳离子采集模式,采集二级质谱,扫描范围m/z 70~2200,氮气流速6.0 L/min,干燥气体温度为250℃,雾化气压力为15 psi,毛细管压力4000 V。
(3)红外光谱(IR):将溴化钾置于红外灯下研磨,并用粉末压片机将其压成透明的溴化钾片;然后将溶于适量易挥发有机溶剂的样品滴到溴化钾片上,待溴化钾片上溶剂挥干后再在红外光谱仪上进行测定。
(4)紫外光谱(UV):将样品溶于适宜溶剂并配制成20 ?g/mL溶液,测试前先用溶剂做空白对照将紫外分光光度计进行调零,然后将溶液移入石英比色皿,在190~400 nm波长下扫描,记录吸收值。
2 结果与分析
2.1 化合物结构鉴定
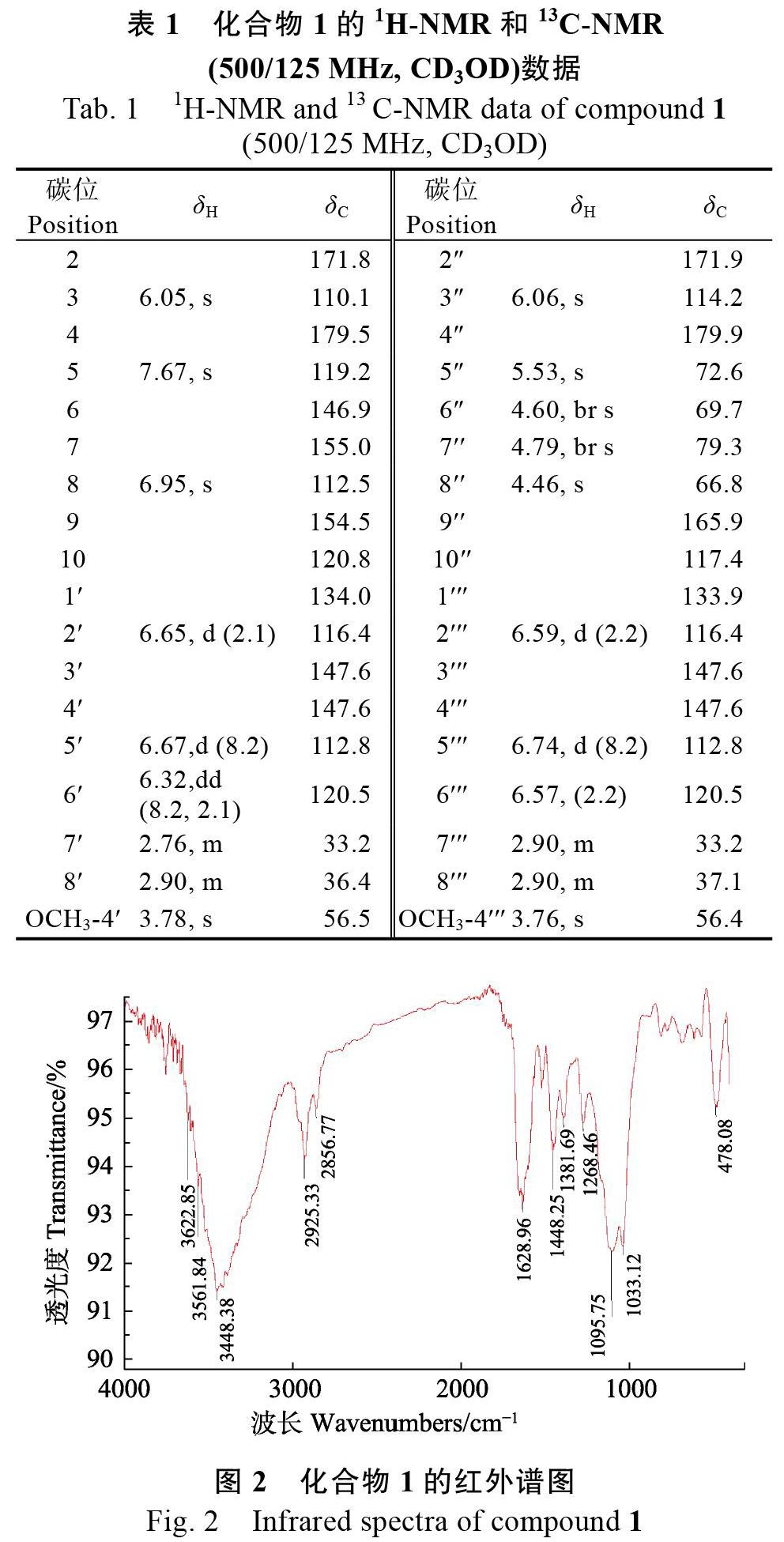
化合物1:白色无定形粉末;C36H32O12;[α] + 81.5 (c 0.130, MeOH);UV (MeOH) λmax (log ε):301 (3.69), 271 (3.99), 205 (4.52)nm;IR (KBr) υmax 3448, 2925, 1628, 1448, 1381, 1268, 1096, 1033 cm–1;1H-NMR (CD3OD, 500 MHz)和13C-NMR (CD3OD, 125 MHz)数据见表1;HR-EI-MS m/z: 679.1753 [M+Na]+(计算值为C36H32NaO12, 679.1786),数据见图1;ECD (c 0.09 M?1cm?1 MeOH) λmax (Δε): 206 (?16.73), 220 (17.26), 250 (17.09), 277 (?8.65), 315 (3.20)nm。
该化合物的红外测试结果如图2所示,化合物结构中存在羟基(3448 cm?1)和α,β-不饱和酮(1628 cm?1)。分析化合物1的1 D和2 D NMR数据(表1、图3)可知,存在2个甲氧基单峰:δH 3.76 (3 H, s)和δH 3.78 (3 H, s);2个双键上的质子:δH 6.05 (1 H, s, H-3)和δH 6.06 (1 H, s, H-3″),4个连续的CH信号:δH 5.53 (1 H, s, H-5″),δH 4.60 (1 H, br s, H-6″),δH 4.79 (1 H, br s, H-7″),δH 4.46 (1 H, s, H-8″);2個ABX芳香环系统:δH 6.65 (1 H, d, J = 2.1 Hz, H-2′),δH 6.67 (1 H, d, J = 8.2 Hz, H-5′),δH 6.32 (1 H, dd, J = 8.2, 2.1 Hz, H-6′)和δH 6.59 (1 H, d, J = 2.2 Hz, H-2′′′),δH 6.74 (1 H, d, J = 8.2 Hz, H-5′′′),δH 6.57 (1 H, 2.2 Hz, H-6′′′);芳香环上的2个对位质子:δH 7.67 (1 H, s, H-5),δH 6.95(1 H, s, H-8);4组亚甲基信号:δH 2.90 (6H, m, H-8′/7′′′/8′′′)和δH 2.76 (2H, m, H-7′)。由以上信息推测出化合物1是由2个2-(2-苯乙基)色酮单体聚合而成的2-(2-苯乙基)色酮二聚体。
经比对1H-NMR和13C-NMR 数据(表1)发现,化合物1中的色酮母核的氢谱、碳谱数据与1类2-(2-苯乙基)色酮二聚体相似,如crassins E-G[18]、(–)-aquisinenone G[19]以及(+)-4′-methox yaquisinenone G[19],因此推测化合物1是5,6,7,8-四氢-2-(2-苯乙基)色酮和fidersia型2-(2-苯乙基)色酮通过C-6-O-C-7′′和C-7-O-C-5′′2个醚键聚合形成,与(+)-4′-methoxyaquisinenone G[19]的区别在于化合物1有2个ABX芳香环系统,推测出化合物1的2个苯乙基片段中苯环的间位(C-3′和C-3′′′)和对位(C-4′和C-4′′′)都存在取代基。又通过甲氧基δH 3.78与δC 147.6 (C-4′)的HMBC相关信号和甲氧基δH 3.78与δH 6.67 (H-5′)的ROESY相关信号确定了甲氧基δH 3.78取代在C-4′位。同理可得,甲氧基δH 3.76取代在C-4′′′位,所以2个苯乙基片段中苯环的间位即C-3′和C-3′′′位被羟基取代。根据ROESY谱上δH 4.60 (H-6″)与δH 4.46 (H-8″),δH 5.53 (H-5″)与δH 4.79 (H-7″)的相关信号,确定了化合物1的5″, 6″, 7″, 8″位的相对构型。化合物1与(+)-4′-methox ya quisinenone G[19]的ECD谱具有相同的Cotton效应(图4)且旋光数据相似,确定二者绝对构型相同,即为5″R,6″S,7″R,8″S。综上化合物1的结构如图5所示,将其命名为(+)-3′,3′′′-dihydroxy- 4′,4′′′-dimethoxyaquisinenone G。
2.2 DPPH自由基清除率
结果如表2所示,化合物1和2在1000 mol/L浓度时都表现出一定的抗氧化活性,对DPPH自由基的清除率分别为39.3%、59.6%,其中化合物2对DPPH自由基的清除效果相对更好,IC50值为(64.6±1.6)mol/L。
3 讨论
目前,从沉香中鉴定了360多种化学成分,主要是倍半萜类(55.86%)和2-(2-苯乙基)色酮类(44.14%)化合物[20],其中2-(2-苯乙基)色酮类化合物大部分为2-(2-苯乙基)色酮单体类化合物。但近年来一系列结构新颖的2-(2-苯乙基)色酮二聚体[15-16, 18-19, 21-23]被国内外学者陆续从沉香中分离鉴定,是沉香中化合物的研究热点。
前期研究已从本样品中分离鉴定了一系列通过一个醚键连接形成的2-(2-苯乙基)色酮二聚体[15-16]。本研究从国产沉香的乙酸乙酯萃取物中分离得到了1个新的2-(2-苯乙基)色酮二聚体(1)和1个已知的2-(2-苯乙基)色酮二聚体(2),并对化合物1和2的分离、结构鉴定和DPPH自由基清除率结果进行了报道。(+)-3′,3″-dihydroxy-4′, 4′′′-dimethoxya quisinenone G (1)是1个5,6,7,8-四氢-2-(2-苯乙基)色酮和1个fidersia型的2-(2-苯乙基)色酮通过2个醚键形成的具有七元二氧环的二聚体,之前报道的通过这种方式聚合而成的2-(2-苯乙基)色酮二聚体只有5个[18-19],且化合物1中苯乙基的苯环间位和对位都具有取代基,结构上具有一定新颖性,丰富了国产沉香中2-(2-苯乙基)色酮二聚体的化学结构,也为国产人工打洞沉香的质量评价提供了参考。
文献报道的色酮二聚体的生物活性主要有抗炎活性、乙酰胆碱酯酶抑制活性、细胞毒活性,未见有关色酮二聚体的抗氧化活性报道[15-16,18-23],仅报道了单体2-(2-苯乙基)色酮类化合物的抗氧化活性[11]。本研究发现2个色酮二聚体(1和2)对DPPH自由基具有一定的清除效果,其中化合物2的IC50值为(64.6±1.6)mol/L。本文为第一次报道色酮二聚体对DPPH自由基的清除能力,为沉香中化学成分后续的抗氧化活性筛选提供了科学依据。
参考文献
国家药典委员会. 中国人民共和国药典: 一部[M]. 北京: 中国医药科技出版社, 2015: 185-186.
Liu Y Y, Wei J H, Gao Z H, et al. A review of quality assessment and grading for agarwood[J]. Chinese Herbal Medicines, 2017, 9(1): 22-30.
Ye W, Wu H Q, He X, et al. Transcriptome sequencing of chemically induced Aquilaria sinensis to identify gene related to agarwood formation[J]. PLoS One, 2016, 11(5): e0155505.
李凯明, 马清温, 孙震晓. 中药沉香主要化学成分与质量评价研究进展[J]. 中国新药杂志, 2017, 26(13): 1538-1545.
杨锦玲, 梅文莉, 董文化, 等. 国产沉香HPLC-MS研究[J]. 中草药, 2018, 49(15): 3583-3592.
杨 林, 郭珮怡, 郭顺星, 等. 国产沉香中1个新的2-(2-苯乙基)色酮[J]. 中草药, 2016, 47(23): 4137-4140.
梅文莉, 左文健, 杨德兰, 等. 沉香结香机理、人工结香及其化学成分研究进展[J]. 热带作物学报, 2013, 34(12): 2513-2520.
中华人民共和国濒危物种进出口管理办公室, 中华人民共和国濒危物种科学委员会. 濒危野生动植物种国际贸易公约附录Ⅱ[Z]. 2007: 11.
李 薇, 梅文莉, 左文健, 等. 国产人工打洞沉香的化学成分研究[J]. 热带亚热带植物学报, 2016, 24(3): 342-347.
Li W, Cai C H, Guo Z K, et al. Five new eudesmane-type sesquiterpenoids from Chinese agarwood induced by artificial holing[J]. Fitoterapia, 2015, 100: 44-49.
向 盼, 曾艷波, 梅文莉, 等. 人工打洞沉香的化学成分及生物活性研究[J]. 中药材, 2017, 40(10): 2339-2343.
Liao G, Mei W L, Dong W H, et al. 2-(2-Phenylethyl) chromone derivatives in artificial agarwood from Aquilaria sinensis[J]. Fitoterapia, 2016, 110: 38-43.
Liao G, Mei W L, Kong F D, et al. 5, 6, 7, 8-Tetrahydro- 2-(2-phenylethyl)chromones from artificial agarwood of
Aquilaria sinensis and their inhibitory activity against acetylcholinesterase[J]. Phytochemistry, 2017, 139: 98-108.
邝彤东, 陈惠琴, 李 薇, 等. 人工打洞沉香中1个新的倍半萜[J]. 中国中药杂志, 2017, 42(23): 4618-4623.
Xiang P, Mei W L, Chen H Q, et al. Four new bi-phenylethylchromones from artificial agarwood[J]. Fitoterapia, 2017, 120: 61-66.
Kuang T D, Chen H Q, Wang H, et al. UPLC-MS-guided isolation of single ether linkage dimeric 2-(2-phenylethyl) chromones from Aquilaria sinensis[J]. RSC Advances, 2019, 9: 17025-17034.
Blois M S. Antioxidant determinations by the use of a stable free radical[J]. Nature, 1958, 181(4617): 1199.
Li W, Yang Y, Dong W H, et al. Dimeric 2-(2-phenylethyl) chromones from the agarwood of Aquilaria crassna in Laos[J]. Fitoterapia, 2019, 133: 12-16.
Huo H X, Zhu Z X, Song Y L, et al. Anti-inflammatory dimeric 2-(2-phenylethyl)chromones from the resinous wood of Aquilaria sinensis[J]. Journal of Natural Products, 2018, 81(3): 543-553.
Gao M, Han X, Sun Y, et al. Overview of sesquiterpenes and chromones of agarwood originating from four main species of the genus Aquilaria[J]. RSC Advances, 2019, 9(8): 4113-4130.
Xia L L, Li W, Wang H, et al. LC-MS guided identification of dimeric 2-(2-phenylethyl)chromones and sesquiterpene-2- (2-phenylethyl) chromone conjugates from agarwood of Aquilaria crassna and their cytotoxicity[J]. Fitoterapia, 2019, 138. doi: 10.1016/j.fitote.2019.104349.
Yang Y, Mei W L, Kong F D, et al. Four new bi-2-(2-phenylethyl)chromone derivatives of agarwood from Aquilaria crassna[J]. Fitoterapia, 2017, 119: 20-25.
Huo H X, Gu Y F, Zhu Z X, et al. LC-MS-guided isolation of anti-inflammatory 2-(2-phenylethyl) chromone dimers from Chinese agarwood (Aquilaria sinensis)[J]. Phytochemistry, 2019, 158: 46-55.
责任编辑:崔丽虹

