培养基中附加6-BA长期继代培养对蝴蝶兰类原球茎活力及生理生化指标的影响
刘福平 陈淳 程小兵 郑明琼

摘 要:為了解培养基中附加6-BA长期继代培养对蝴蝶兰类原球茎(PLB)状态的影响,以只添加3 mg/L的6-BA和不添加植物生长调节剂(对照)培养基分别继代培养PLB 24个月,培养过程中观测PLB活力指标,分析相关氧化、抗氧化和DNA生化指标。结果表明,第8个月2组PLB活力指标没有显著差异,第16个月6-BA组PLB分化率显著升高,第24个月增值倍数和分化率分别显著降低和极显著降低,且PLB的玻璃化率较高;6-BA组PLB氧化胁迫水平在第8、第16个月都较对照低,第24个月较高,培养期间·OH相对含量和POD活性与氧化胁迫水平分别相向和反向消长;6-BA组PLB的DNA甲基化程度始终较对照低,增色效应到第24个月才降低。较强的氧化胁迫,·OH相对含量、H2O2和MDA含量提高,POD和CAT活性降低,以及DNA甲基化程度降低,与6-BA诱导PLB玻璃化有关。综上分析,含6-BA培养基长期继代培养蝴蝶兰类原球茎,在培养中期可减缓类原球茎衰老,培养后期则加剧了衰老退化,所以在蝴蝶兰类原球茎的继代培养中,应适时调整细胞分裂素用量和控制继代次数。
关键词:蝴蝶兰类原球茎;长期继代;6-BA;活力;生理生化
Abstract: To understand the effects of 6-BA in media on the protocorm like body (PLB) of Phalaenopsis hybrida through long-term subculture, PLB was subcultured respectively on the media supplemented with only 6-BA (3 mg/L) and that without plant growth regulator (control) for 24 months. Some indexes of vitality, oxidation, antioxidant and DNA biochemistry of PLB were observed and analyzed during the subculture. The results showed that there was no significant difference in the PLB vitality indexes between the two groups at the 8th month. The differentiation rate of PLB in 6-BA group increased significantly at the 16th month. At the 24th month proliferation multiple and differentiation rate of PLB in 6-BA group decreased significantly and extremely significantly, respectively, meantime the PLB had a higher hyperhydricity rate. The oxidative stress level of PLB in 6-BA group reduced than that in control group at the 8th and 16th months, but increased at the 24th month. Throughout this subculture, changes of relative content of ·OH showed the similar trend with the oxidative stress level, and that of POD activity did conversely. The degree of DNA methylation in 6-BA group remained below that in the control, also the DNA hyperchromic effect was lower only at the 24 months. In addition to this, PLB hyperhydricity induced by 6-BA was connected with the factors including stronger oxidative stress, the increase of the relative content of ·OH, contents of H2O2 and MDA, the decrease of POD and CAT activities, as well as the decrease of degree of DNA methylation. Based on the above analysis, it could be concluded that during the long-term subculture of P. hybrida PLB, 6-BA in media slowed down PLB senescence in the middle stage of subculture, whereas it accelerated the senescence in the later stage. Therefore, the amount of cytokinin in media should be adjusted in time and the times of subculture should be limited in the subculture of P. hybrida PLB.
Keywords: Phalaenopsis hybrida PLB; long-term subculture; 6-BA; vitality; physiology and biochemistry
兰科植物组培类原球茎(PLB)在快速育苗、基因转化、生物反应器的应用、人工种子研制、种质保存等方面具有相当应用潜力,在类原球茎的生产应用中,不可避免地进行频繁继代培养,同其他植物一样,将导致无性系生理和遗传上的衰老变异,一般认为是培养基植物激素在植物体内积累等因素作用的结果[1]。蝴蝶兰或其他兰科植物的组培类原球茎在含高浓度植物激素的培养基上培养,尤其经长期继代培养无性系变异率很高是普遍现象,而且伴随某些生理生化、遗传指标的变化[2-5]。细胞分裂素在蝴蝶兰组织培养中起主要作用,培养基采用单一细胞分裂素6-苄氨基腺嘌呤(6-BA)就足以增殖蝴蝶兰类原球茎,效果理想,所使用或推荐6-BA浓度為1~6 mg/L[6-9],也有研究者发现蝴蝶兰类原球茎继代增殖时外源激素并非必需[8,10-12],刘福平等[8]将蝴蝶兰完整类原球茎分别在含5 mg/L的6-BA和无激素培养基继代,生成物为PLB,诱导率均为100%,顾德峰等[11]在无激素改良狩野培养基对5个品种蝴蝶兰类原球茎扩繁20代,高汝勇等[12]在MS添加0.2%活性炭和10%的香蕉汁的无激素培养基,原球茎可继代30次。为避免或减轻发生无性系变异,有些作者[6,13-15]建议蝴蝶兰类原球茎的继代扩繁培养基不加或少用激素。
目前研究植物长期继代组培无性系各指标变化,一般以观测初代培养物(或母株)的数据为对照。除了培养基的生长调节物质,外植体脱分化的细胞分裂方式、培养物染色体和分子水平自发变异的积累、离体培养条件自身对培养物的非生物胁迫等也是影响长期继代组培无性系变异各指标变化的重要因素[1],常规实验设计无法有针对性地研究某一种因素(如某种植物生长调节物质)对长期继代组培无性系变异的影响。鉴于蝴蝶兰类原球茎继代增殖对外源激素没有严格要求,为研究激素对原球茎繁殖等的作用及机理提供了良好的实验系统。本研究以无激素培养基(对照)和添加细胞分裂素(6-BA)的培养基分别对蝴蝶兰类原球茎进行长期继代培养,能够单纯地了解6-BA调节长期继代类原球茎无性系相关指标变化的影响,较客观地了解6-BA对长期继代类原球茎衰老退化的作用机理。
1 材料与方法
1.1 材料
蝴蝶兰(Phalaenopsis hybrida)瓶苗由福建省亚热带植物研究所组培室提供。类原球茎(PLB)获得方法同参考文献[5]。
1.2 方法
1.2.1 继代培养PLB实验系统 PLB长期继代培养方法,对照组为没有添加植物生长调节剂的培养基,即1/2 MS+CW(椰子汁)20%(体积比,下同)+蔗糖2%,处理组培养基添加6-BA,即1/2 MS+6-BA 3.0 mg/L+ CW 20%+蔗糖2%。继代转接PLB每瓶起始鲜重均为3.00 g,每2个月继代分瓶1次,共继代分瓶11次,PLB共培养24个月。
1.2.2 PLB活力测定 在培养的第8个月(前期)、16个月(中期)、24个月(后期),挑选非玻璃化PLB检验增殖倍率、分化率。随机取9瓶称量每瓶PLB鲜重,除以起始鲜重(3.00 g)得增殖倍数。取PLB团剥离中等大小的单粒PLB,接种到分化培养基1/2 MS+6-BA 3.0 mg/L+NAA 0.5 mg/L+CW 20%+蔗糖2%,每瓶接种10粒,每处理观测9瓶,培养2个月,PLB分化率=出芽长根PLB数/总PLB数×100%。
在实验过程中,同时观察继代培养期间PLB玻璃化情况。从培养24个月的6-BA组PLB,挑选非玻璃化PLB分别接种到上述分化培养基(含6-BA 3.0 mg/L+NAA 0.5 mg/L),培养2个月观察PLB玻璃化情况,PLB玻璃化瓶数的发生率=出现玻璃化PLB的瓶数/观察瓶数×100%,PLB玻璃化发生率=单一瓶内玻璃化的PLB数量/瓶内PLB总数×100%。
上述培养条件均同参考文献[5]。
1.2.3 PLB生理生化指标分析 随机选取培养第0、8、16、24个月的非玻璃化PLB进行生理生化指标分析。
总活性氧(T-ROS)水平、超氧阴离子()生成速率、羟自由基(·OH)相对含量、过氧化氢(H2O2)含量、丙二醛(MDA)含量、总抗氧化(T-AOC)能力、超氧化物歧化酶(SOD)活性、过氧化物酶(POD)活性、过氧化氢酶(CAT)活性、DNA胞嘧啶甲基化水平等10个指标分析方法见文献[4-5]对应指标分析方法及引用文献,单位均以每克鲜重表示。
DNA增色效应。参照曾碧慧等[16]和沈丹艳等[17]的方法稍作修改。取CTAB法提取的DNA 20 μL,溶于2.48 mL 0.08 mol/L的NaC1溶液中,在室温(24.5 ℃)下紫外分光光度计测定A260,然后DNA在94 ℃的水浴上加热,冰浴冷却,测定A260,以[(A260, 94 ℃?A260, 24.5 ℃)/A260, 24.5 ℃]×100%作为DNA增色效应指标。
1.3 数据处理
培养期间同一培养时间点的6-BA组与对照组之间差异显著性比较采用t检验法。对照组在不同培养时间观测数据的组间差异显著性分析按邓肯氏新复极差测验法。采用SPSS19.0软件和Excel 2003软件统计分析。
2 结果与分析
2.1 6-BA对长期继代培养类原球茎活力及生理生化指标的效应
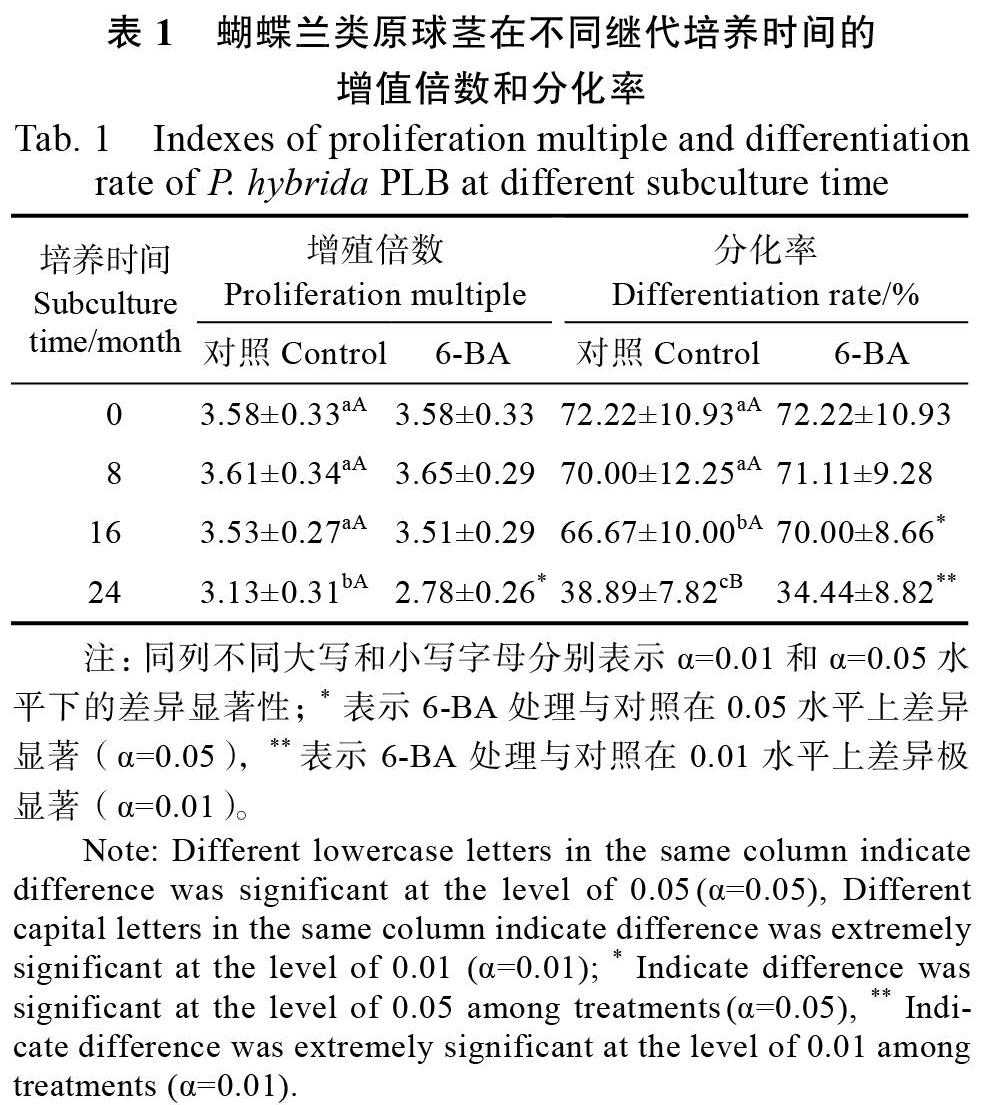
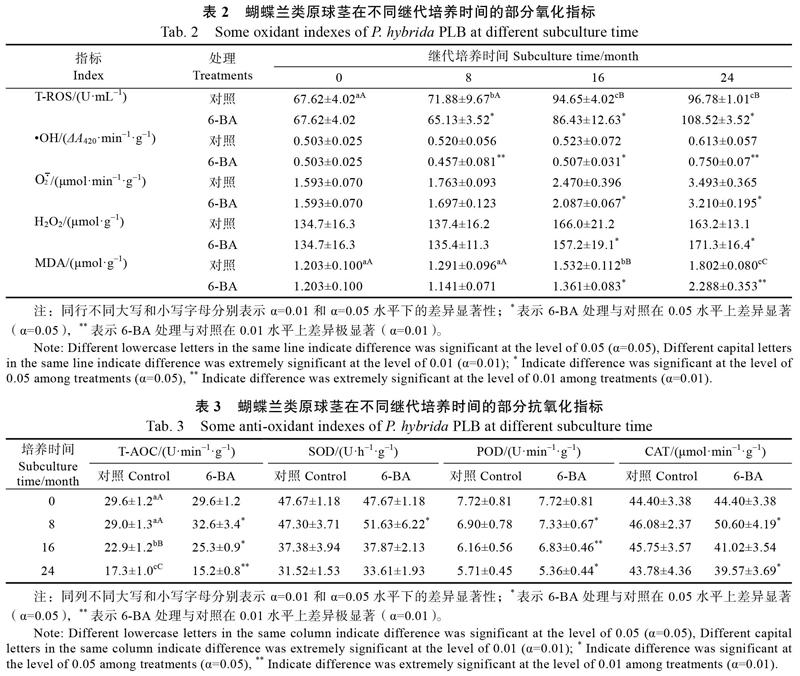
继代培养对照为不添加6-BA的培养基,处理组培养基添加6-BA。蝴蝶兰PLB在不同继代培养时间的增值倍数和分化率见表1,初代PLB的增殖和分化情况见图1A和图1B;继代培养PLB部分氧化指标变化见表2;继代培养PLB的某些抗氧化指标见表3;继代培养期间DNA胞嘧啶甲基化程度、DNA增色效应变化见表4。
根据上述结果,对继代培养期间6-BA组与对照组PLB各指标进行对比分析。
(1)在培养第8个月,对照组PLB增殖倍数和分化率与初代均没有显著差异(表1),总活性氧水平显著提高(表2),总抗氧化能力、DNA生化指标没有显著差异(表3、表4)。6-BA组PLB与对照组相比,增殖倍数和分化率没有明显差异(表1);总活性氧水平、总抗氧化能力分别显著降低和显著升高,对应·OH相对含量较对照极显著降低,3种抗氧化酶活性都显著提高(表2、表3),DNA甲基化程度显著降低(表4)。
(2)在培养第16个月,对照组PLB增殖倍数与第8个月相比没有明显变化,分化率显著降低(表1),总活性氧水平和总抗氧化能力分别极显著提高和极显著降低(表2、表3),MDA含量、DNA甲基化程度也都极显著升高(表3、表4)。6-BA组PLB活力指标仅分化率有变化,较对照显著提高(表1);总活性氧水平、总抗氧化能力分别显著降低和显著升高(表2、表3),对应3种活性氧(包括·OH相对含量)、MDA指标都显著降低(表2),抗氧化酶POD活性极显著提高(表3),DNA甲基化程度极显著降低(表4)。
(3)在培养第24个月,对照组PLB增殖倍数和分化率与第16个月相比分别显著降低和极显著降低(表1),总活性氧水平和总抗氧化能力分别差异不显著和极显著降低(表2、表3),MDA含量、DNA甲基化程度都极显著升高(表3、表4)。6-BA组PLB与对照相比,增殖倍数、分化率分别显著降低和极显著降低(表1);总活性氧水平显著提高(表2),总抗氧化能力极显著降低(表3),·OH相对含量、H2O2含量和MDA含量分别极显著或显著升高(表2),POD和CAT活性显著降低(表3),DNA甲基化程度、增色效应分别较对照显著降低和极显著降低(表4)。
从整个培养过程看,6-BA组PLB总活性氧水平在第8、16个月都较对照显著降低,第24个月显著提高,3个活性氧指标中仅·OH相对含量较对照在第8、16个月都降低,第24个月升高,即与总活性氧水平同向消长。总抗氧化能力方面,6-BA组PLB较对照在第8、16个月都升高,第24个月降低,3个抗氧化酶指标中仅POD活性变化在第8、16个月都升高,第24个月降低,即与总抗氧化能力同向消长。6-BA组的DNA甲基化程度始终较对照降低,增色效应到第24个月极显著降低。
2.2 6-BA对长期继代培养PLB玻璃化的效应
继代培养第8、16个月均没发现PLB有玻璃化现象,第24个月才发现有玻璃化现象。培养第24个月的PLB的玻璃化情况以及培养第24个月的正常PLB进行分化培养的玻璃化情况见表5,6-BA组的玻璃化瓶数的发生率和PLB玻璃化发生率都高于不含激素的对照组(仅1瓶玻璃化),6-BA组PLB的玻璃化情况如图1C所示。取2组非玻璃化PLB在分化培养基继续培养2个月,6-BA组的玻璃化瓶数的发生率(图1D)和PLB玻璃化发生率都较对照组高。
3 讨论
3.1 继代培养期间6-BA对类原球茎衰老退化的效应
根据植物衰老的激素假说,一定浓度细胞分裂素能够减轻组织细胞遭受的氧化胁迫水平,延缓植物衰老,如细胞分裂素能调节内源激素水平,减缓抗氧化酶活性和叶绿素含量的下降,降低自由基水平和丙二醛含量,提高脯氨酸含量水平[18-20],在分子水平,采用基因工程转入促进细胞分裂素合成的基因或转入降解细胞分裂素的基因,研究细胞分裂素对衰老的影响,已有不少报道。过高浓度的细胞分裂素不但导致生理病害影响植物的正常生长和发育,还引起某些微繁殖植株的变异[21-23],细胞分裂素诱发细胞变异机制报道较少,包括染色体变异[1]、转座子活化[24]、DNA甲基化状态改变[25-27]等。长期继代培养物表现出的衰老退化,是生理与遗传因素共同作用的结果。
在本研究中,培养第8个月(前期),对照组PLB较初代总活性氧水平显著提高,总抗氧化能力、MDA含量没有变化,推测PLB遭受氧化胁迫水平有所提高。6-BA组PLB总活性氧水平较对照显著降低,总抗氧化能力显著提高,有毒物质MDA含量没有显著变化,结果有利减轻氧化胁迫,6-BA组PLB的DNA甲基化程度较对照组显著降低,上述指标变化并未导致6-BA组PLB的增值倍数和分化率发生改变。
培养第16个月(中期),对照组PLB分化率与第8个月相比显著降低,总活性氧水平升高、总抗氧化能力降低和MDA含量升高,说明继代16个月使PLB遭受较强氧化胁迫,DNA甲基化程度较初代和第8个月都显著提高,一般认为DNA(主要是5-甲基胞嘧啶)甲基化程度提高关系形态发生能力丧失[28-29]。6-BA组PLB较对照的总活性氧水平、MDA含量显著降低,总抗氧化水平显著提升,即6-BA减轻了PLB遭受的氧化胁迫,抑制了生理衰老。DNA生化指标方面,一些研究表明DNA去甲基化可响应非生物或生物胁迫,常常起到激活特定群体基因表达的作用[30],WUS基因是调控植物再生过程的4个主要基因之一[31],Shemer等[27]报道培养基细胞分裂素使WUS基因启动子去甲基化,可能是导致拟南芥获得较高再生能力的因素。本研究中6-BA组PLB的DNA甲基化程度较对照极显著降低,可能是对继代16个月PLB所遭受氧化胁迫的反应,去甲基化一般有利基因活跃表达和分化[1,27,29],可能导致6-BA組PLB分化率的提高。
培养第24个月(后期),对照组PLB的增值倍数、分化率都较第16个月降低,虽然总活性氧水平没变化,但总抗氧化能力降低、MDA含量升高,表明PLB遭受较强氧化胁迫,DNA甲基化程度升高(其原因如前言所述,除了生长调节物质,培养物遗传物质自发变异的积累、离体培养环境自身的非生物胁迫等也是影响长期继代无性系各指标变化的重要因素),这些指标变化可能也与分化能力降低有关[28-29]。6-BA组PLB的增值倍数、分化率分别较对照显著和极显著降低,PLB总活性氧水平、MDA含量较对照分别显著和极显著提高,总抗氧化能力极显著降低,表明随着继代培养,激素的作用日益累积,6-BA作用到培养后期强化了氧化胁迫,进一步促进PLB的生理衰老。DNA生化指标方面,6-BA组PLB甲基化程度显著降低,可能并不支持PLB分化率降低的结果,增色效应是双链DNA变性后,分开成单链DNA的重要性质,6-BA组PLB的DNA增色效应降低,说明DNA发生链间交联,即DNA双链之间出现共价键联接[17,32],它可妨碍DNA复制、转录等,出现变异细胞。已知活性氧自由基能引起DNA碱基修饰、DNA链断裂以及染色质交联,MDA会引起蛋白质、核酸等生命大分子的交联聚合,培养后期6-BA诱发PLB的总活性氧水平、MDA含量较对照有极显著提高,对DNA链的攻击可能导致DNA链遭受破坏。
笔者曾以无激素培养基(同本文对照组)为对照,添加抗氧化剂半胱氨酸和甘露醇为处理组继代蝴蝶兰PLB作了连续报道,处理组PLB增殖率、萌发率有所提高,培养期间处理组PLB总抗氧化能力均较对照组高[4],总活性氧水平均较对照组低[5],即24个月的整个继代培养期间,处理组PLB遭受的氧化胁迫比对照低。本实验6-BA(3.0 mg/L)组PLB氧化胁迫水平在第8、16个月都较对照组降低,第24个月较对照高,说明在培养前、中期,6-BA与半胱氨酸和甘露醇组合[4]起到类似的抗氧化作用,而在培养后期,6-BA效应则转而增强氧化胁迫。此外,本实验6-BA组PLB氧化胁迫水平在第8、16个月都较对照组降低,第24个月提高,期间伴随·OH相对含量和POD活性分别相向和反向同步变化,·OH是所有活性氧种类中反应活性最高的,能与所有生物分子发生反应从而造成细胞损伤,是DNA氧化损伤的主要来源,POD酶活性变化直接或间接调控IAA的水平,被认为是分化的主要相关性酶[33-34]。细胞分裂素可诱导去甲基化[25,27],本实验6-BA使PLB的DNA甲基化程度在3个时间点都较对照低,上述报道[5]抗氧化剂处理组PLB的DNA甲基化程度在第8个月与对照差异不显著,第16、24个月较对照低,即6-BA对DNA去甲基化的效应表现比抗氧化剂早。本研究处理组PLB的DNA增色效应到第24个月较对照降低,说明6-BA对PLB作用到第24个月才表现对DNA链的诱变效应。
3.2 类原球茎玻璃化诱导因素
培养第24个月,PLB出现玻璃化(超含水)现象。兰科植物组培类原球茎、瓶苗普遍存在玻璃化现象,同其他植物一样,6-BA或其他细胞分裂素浓度过高起到关键性作用,高浓度的细胞分裂素阻碍木质素和纤维素形成,不利于木质化和细胞壁的形成,壁压降低促进被动吸水形成玻璃苗[35]。对于长期继代蝴蝶兰原球茎,同样也是6-BA长期积累导致玻璃化[15,36]。张立全等[36]报道由于培养基长期使用6-BA,蝴蝶兰原球茎内6-BA含量远远高于NAA,体内激素比例严重失调而导致玻璃化现象严重。本实验中,在培养第24个月,6-BA组PLB玻璃化较对照组严重,说明6-BA长期积累促进了PLB玻璃化。
培养第24个月的非玻璃化PLB在相同配方的分化培养基中培养,6-BA组玻璃率化较对照组的高,说明6-BA组PLB对玻璃化敏感。玻璃化苗常伴随氧化胁迫的发生及活性氧、MDA等的积累[37-39],6-BA组PLB较对照经受较强氧化胁迫,该组PLB的·OH相对含量、H2O2和MDA含量都较对照高,POD和CAT活性降低,可能也与诱导玻璃化有关。DNA甲基化方面,玻璃化苗总基因组DNA甲基化高于或低于正常苗有不同报道[38,40],本实验6-BA组PLB的DNA甲基化程度较对照显著降低。
细胞分裂素最明显的生理作用,一是促进细胞分裂和调控其分化,二是延缓蛋白质和叶绿素的降解,延迟衰老。本实验蝴蝶兰类原球茎在6-BA培养基继代培养24个月,前、中期6-BA主要表现减缓类原球茎衰老退化的效应,培养后期6-BA则加剧了这种衰老退化,并导致类原球茎玻璃化,所以在蝴蝶兰类原球茎的继代培养中,应注意调整细胞分裂素用量和控制继代次数。通过培养条件(尤其是培养基激素)优化和继代次数规范等,是高效获得质量均一的大批量类原球茎、实现标准化生产的重要手段。本研究结果将为细胞分裂素在兰科植物组培类原球茎的合理应用提供借鉴,也为进一步研究细胞分裂素对植物组织的生理生化、遗传变异效应提供基础。
参考文献
刘福平. 植物体细胞无性系变异的遗传基础及主要影响因素[J]. 基因组学与应用生物学, 2010, 29(6): 1141- 1151.
Zha X Q, Luo J P. Production stability of active polysaccharides of Dendrobium hulshanense using long-term cultures of protocormlike bodies[J]. Planta Medica, 2008, 74: 90-93.
邱 婧, 樊洪泓, 秦自清, 等. 利用分子标记检测霍山石斛不同继代次数试管苗的遗传稳定性[J]. 分子植物育种, 2008, 6(3): 532-536.
刘福平, 张小杭, 崔寿福. 抗氧化剂减缓长期继代蝴蝶兰类原球茎衰老及生理指标变化[J]. 上海农业学报, 2015, 31(5): 42-46.
刘福平, 陈 淳, 林志楷. 长期继代蝴蝶兰类原球茎对抗氧化剂的生理响应及DNA稳定性分析[J]. 热带作物学报, 2016, 37(1): 80-85.
周俊辉, 叶超宏, 陈旭高. 蝴蝶兰原球茎增殖培养的研究[J]. 仲恺农业技术学院学报, 2002, 15(3): 13-17.
陈 勇, 林开县, 王君晖. 蝴蝶兰的快速繁殖和规模化栽培技术研究[J]. 浙江大学学报(理学版), 2004, 31(11): 84-88.
刘福平, 洪丽萍, 郑明琼. 6-BA、2, 4-D诱导蝴蝶兰类原球茎外植体的研究[J]. 江西农业学报, 2007, 19(8): 69-71.
崔广荣, 张子学, 张从宇, 等. 蝴蝶兰原球茎诱导与增殖研究[J]. 种子, 2016, 25(12): 20-23.
胡海英, 王建宇. 蝴蝶兰的离体培养与快繁技术研究[J]. 宁夏大学学报(自然科学版), 2002, 23(4): 367-369.
顧德峰, 赵春莉, 宋彦君, 等. 蝴蝶兰无性快繁规模化生产的研究[J]. 园艺学报, 2007, 34(1): 193-196.
高汝勇, 李会芬, 骆冬洁. 蝴蝶兰的快速繁殖研究[J]. 衡水学院学报, 2007, 9(1): 27-29.
徐文华, 范燕萍. 蝴蝶兰再生体系优化的研究[J]. 安徽农业科学, 2005, 3(6): 1030-1031.
魏 琪, 李凤兰, 胡国富, 等. 蝴蝶兰快速繁殖研究进展[J]. 园艺学报, 2006, 33(4): 915-920.
顾德峰, 赵春莉, 张红伟, 等. 蝴蝶兰无性快繁规模化生产中玻璃化原球茎状体产生的原因及其恢复[J]. 东北林业大学学报, 2007, 35(9): 55-56.
曾碧慧, 张志刚. 盐浓度、酸碱度及DNA浓度对增色效应实验的影响[J]. 实验室研究与探索, 2001, 20(1): 43-45, 52.
沈丹艳, 梅笑漫, 姚巧美, 等. 铝对荞麦根系DNA损伤的效应研究[J]. 水土保持学报, 2013, 27(5): 244-248.
Munguatosha N, Emerald M, Patrick N. The Effects of auxins and cytokinin on growth and development of (Musa sp.) var. “Yangambi” explants in tissue culture[J]. American Journal of Plant Sciences, 2013, 4: 2174-2180.
Zardo D M, Zielinski A A F, Alberti A. Phenolic compounds and antioxidant capacity of brazilian apples[J]. Food and Nutrition Sciences, 2015(8): 727-735.
罗淑芬, 孙凤杰, 胡花丽, 等. 6-苄基腺嘌呤对鲜莲子活性氧代谢及能量水平的影响[J]. 核农学报, 2018, 32(5): 916-923.
Corley R H V, Lee C H, Law L H, et al. Abnormal flower development in oil palm clones[J]. Planter, 1986, 62: 233-240.
Vuylsteke D, Swennen R. Somaticlonal variation in African plantains[J].ⅡTA Res, 1990(1): 4-10.
丁爱萍, 史正军. 6-BA对红掌组织培养中红叶变异的影响[J]. 植物生理学通讯, 2010, 46(6): 571-574.
李 胜, 李 唯. 植物组织培养原理与技术[M]. 北京: 化学工业出版社, 2008: 64.
Arnholdt-Schmitt B. Rapid changes in amplification and methylation pattern of genomic DNA in cultured carrot root explants (Daucus carota L.)[J]. Theoretical & Applied Genetics, 1993, 85: 793-800.
Vlasova T I, Demidenko Z N, Kirnos M D, et al. In vitro DNA methylation by wheat nuclear cytosine DNA methytransferase: effect of phytohormones[J]. Gene, 1995, 157: 279-281.
Shemer O, Landau U, Candela H, et al. Competency for shoot regeneration from Arabidopsis root explants is regulated by DNA methylation[J]. Plant Science, 2015, 238: 251-261.
Peredo E L, Arroyo-García R, Revilla M. Epigenetic changes detected in micropropagated hop plants[J]. Plant Physiol, 2009, 166: 1101-1111.
石 鹏, 王 永, 金龙飞, 等. 植物组织培养过程中的DNA甲基化研究进展[J]. 热带作物学报, 2019, 40(1): 199-207.
李 艳, 钱伟强. 植物中DNA甲基化及去甲基化研究进展[J]. 生命科学, 2017, 29(3): 302-309.
Horstman A, Li M, Heidmann I, et al. The BABY BOOM transcription factor activates the LEC1-ABI3-FUS3-LEC2 network to induce somatic embryogenesis[J]. Plant Physiology, 2017, 175(2): 848-857.
Koch C J, Giandomenico A R.The alkaline elution technique for measuring DNA single strand breaks:increased reliability and sensitivity[J]. Anal Biochem, 1994, 220: 58-65.
Hausman O B, Potter J R. Rooting of apple, Rhododendron, and mountain laurel cutting from stockplants etiolated under two temperatures[J]. Hortscience, 1997, 32: 304-306.
龐碧滢, 冯 杏, 黄俊文, 等. PBU和6-BA对尾叶桉愈伤组织POD基因表达及酶活性的影响[J]. 分子植物育种, 2019, 17(1): 283-287.
王 菲, 冯立娟, 杨雪梅, 等. 我国果树玻璃化试管苗特征、成因、机理及控制研究进展[J]. 北方园艺, 2016(23): 195-199.
张立全, 田松英, 张元国, 等. 蝴蝶兰原球茎的增殖研究[J]. 北方园艺, 2007(3): 172-175.
Wu Z, Chen L J, Long Y J. Analysis of ultrastructure and reactive oxygen of hyperhydric garlic (Allium sativum L.) shoots[J]. In Vitro Cellular & Developmental Biology-Plant, 2009, 45: 483-490.
王宏伟. 豆梨组织培养过程中玻璃化形成机制及其恢复技术研究[D]. 南京: 南京农业大学, 2011.
孔祥宇, 刘 敏, 蒋芳玲, 等. 外源ABA对大蒜试管苗玻璃化发生和抗氧化系统的影响[J]. 西北植物学报, 2017, 37(12): 2410-2418.
吕 敏. 蓝莓试管苗玻璃化特性及DNA与MSAP分析[D]. 大连: 大连理工大学, 2014.
责任编辑:沈德发

