乳酸通过GPR81介导的Nrf2/LDHA通路促进非小细胞肺癌H1299细胞的迁移
曹玉祥,张志坚,周辰康,魏慧君,吴志浩*
(1.皖南医学院检验学院,安徽 芜湖 241002;2.基础医学院;3.安徽省活性大分子研究重点实验室)
肺癌是全球发病率和病死率增长最快的恶性肿瘤,目前5年相对生存率仅为15%[1],是一种以细胞异常增殖为特点的疾病之一,造成肺癌患者远期生存率较低的主要原因是肿瘤的侵袭和转移。全球80%以上的肺癌死亡病例是由非小细胞肺癌(non-small cell lung cancer,NSCLC)转移引起的[2]。NSCLC在肺癌中最常见,其发生、发展机制一直是肿瘤学研究的热点。
G蛋白偶联受体81(G protein-coupled receptor 81,GPR81)被鉴定为乳酸的受体[3],其在脂肪细胞和骨骼肌细胞中高表达,目前发现在包括肺癌细胞在内的多种肿瘤细胞中同样高水平表达[4],有研究强调了GPR81在肿瘤生长和迁移过程中的重要性,在乳腺癌中高表达的GPR81以PI3K/Akt途径依赖的方式促进增殖并刺激血管生成[5]。Roland等[6]的研究表明GPR81表达水平与胰腺癌肿瘤生长速度相关,抑制GPR81表达可显著降低肿瘤生长和体内转移。在我们的前期研究中发现GPR81可以介导肺癌细胞的侵袭迁移和免疫逃逸[7-8]。
核因子E2相关因子2(nuclear factor erythroid 2-related factor 2,Nrf2)是一种细胞存活的调节因子并可以启动细胞防御机制,在氧化应激和外源性应激条件下,能引起Nrf2对细胞的保护作用[9],防止肿瘤的发生发展。然而Nrf2不仅可以保护正常细胞,在肿瘤细胞中表达量较正常细胞高,维持肿瘤细胞的氧化还原平衡状态,在保护肿瘤细胞的增殖、侵袭和迁移等过程中扮演着重要角色,但 其 分 子 机 制 并 不 清 楚[10]。乳 酸 脱 氢 酶A(lactate dehydrogenase A,LDHA)是糖酵解途径中的关键酶之一,对丙酮酸具有较强的亲和力,LDHA的表达又会促进糖醇解产生大量乳酸[11]。本文探究GPR81介导的乳酸通过Nrf2/LDHA通路促进NSCLC迁移的信号通路,并探索其分子机制。
1 材料与方法
1.1 材料与试剂 NSCLC细胞系H1299由上海生科院细胞库提供;高糖DMEM培养基购自美国Hyclone公司;10%小牛血清购自南京博全科技有限公司;基因组DNA提取试剂盒、DNA marker、2×Taq PCR MasterMix购自北京天根生化科技有限公司;DNA上样缓冲液、感受态大肠杆菌DH5α购自日本TaKaRa公司;琼脂糖凝胶、2×Leammli Sample Buffer细胞裂解液、抗β-actin抗体购自美国Sigma公司;PCR纯化试剂盒、质粒大量提取试剂盒购自德国Qiagen公司;限制性内切酶KpnⅠ、HindⅢ,T4 DNA连接酶购自美国NEB公司;胰蛋白胨、酵母提取物购自英国Oxoid公司;质粒小量抽提试剂盒购自上海碧云天生物技术有限公司;PolyJet转染试剂购自美国SignaGen公司;pGL3-Basic载体、pRL-CMV载体、Passive Lysis Buffer细胞裂解液、双荧光素酶报告基因检测试剂盒、双荧光素酶报告基因检测系统购自美国Promega公司;Nrf2质粒购自美国Addgene公司;siLDHA、siNrf2购自广州锐博生物科技有限公司;紫外分光光度计、PCR仪购自德国Eppendorf公司;凝胶成像仪购自美国Protein Simple公司;抗Nrf2抗体购自英国Abcam公司;抗LDHA抗体购自美国CST公司;Amersham Imager 600成像仪购自美国GE公司,荧光倒置显微镜购自日本Olympus公司。
1.2 细胞培养 用含10%小牛血清的DMEM培养基于37℃、5%CO2孵育箱中培养H1299细胞,培养基中含青霉素、链霉素100 U/ml。
1.3 细胞转染 取对数生长期的H1299细胞,于转染前1 d接种到6孔板(105个/孔)或者12孔板(5×104个/孔)中继续培养,待细胞生长融合度达到30%~50%时进行转染,根据Lipofectamine 2000说明书,将siRNA转入细胞中,在37℃、5%CO2孵育箱中培养48 h后,用于相关检测实验。
1.4 Western blot检测蛋白表达水平 将已处理完成的细胞使用PBS洗涤,加入细胞裂解液,迅速将细胞刮下收集细胞。100℃热变性5 min,使用10% SDS-PAGE电泳后电转移至硝酸纤维素膜(NC膜)上,5%牛奶室温封闭1 h,按照1∶1 000比例稀释并孵育一抗,4℃过夜,按照1∶2 000比例稀释并室温孵育二抗1 h,ECL发光显影。使用Amersham Imager 600系统对目的条带进行成像分析,测定灰度值,用β-actin作为内参对照,来检测相关蛋白的相对表达量。
1.5 质粒构建 用DNA提取试剂盒提取细胞基因组DNA,根据UCSC Genome Browser数据库中Genomic Sequence报道的人源LDHA基因启动子序列(NR-028500.1)利用oligo 7软件设计单链引物,并在上游引物和下游引物中分别添加KpnⅠ和HindⅢ两种酶切位点,引物由上海生工生物工程股份有限公司合成。引物序列如下:LDHA-luc(238 bp)上游引物:5′-GGGGTACC ACGTGGAGCAGTCTGCCGGTCGGTTG-3′(下 划 线 部 分 为KpnⅠ酶切位点),下游引物:5′-GGGAAGCTT TCG TCGGGGGCGCGTGGCAATGAGAT-3′(下划线部分为HindⅢ酶切位点);LDHA-luc(1 249 bp)上游 引 物:5′-GGGGTACC GGCAATGGAATCAGCAAGAATACAGG-3′(下划线部分为KpnⅠ酶切位点),下游引物:5′-GGGAAGCTT TCGTCGGGGGC GCGTGGCAATGAGAT-3′(下划线部分为HindⅢ酶切位点)。经扩增、酶切、连接、测序,完成质粒构建。
1.6 双荧光素酶活性测定 LDHA-luc是由LDHA基因启动子控制的表达萤火虫荧光素酶的质粒,pRL-CMV是由CMV启动子控制的表达海肾荧光素酶的质粒(作为转染效率的对照)。按照双荧光素酶报告基因检测试剂盒说明书进行操作,弃去孔内培养基,使用PBS洗涤2次,每孔加入Passive Lysis Buffer裂解液100 μl,室温摇动20 min后收取样品,4℃离心15 min进行检测。取20 μl上清液与20 μl Luciferase Assay Buffer混合,检测萤火虫荧光素酶的活性;继续加入20 μl Stop&Glo Buffer混合,检测海肾荧光素酶活性,计算2种荧光素酶活性的比值。
1.7 细胞迁移划痕实验 在H1299细胞中分别共转染Nrf2+control siRNA、Nrf2+LDHA siRNA,以pcDNA3.1+control siRNA作为对照。48 h后,用无血清培养基同步化处理,用无菌的10 μl枪头对细胞进行划痕实验,PBS清洗2次后换上无血清培养基并一直使用无血清培养基培养,立即使用荧光倒置显微镜进行拍照,记为0 h,每隔24 h拍一次照,分别记为24、48、72、96 h。实验重复3次,重复照相,并计算平均值。
1.8 Transwell实验 将0 mmol/L和20 mmol/L乳酸处理过的细胞经胰酶消化后调整浓度为1×105个/ml,700 μl含10%小牛血清的DMEM培养基加入Transwell下室,300 μl细胞悬浮液加入Transwell上室,在37℃、5%CO2孵育箱中培养48 h后,取出Transwell小室,吸去废液,用棉签擦净基底膜,PBS清洗,甲醛固定10 min,结晶紫染色20 min,清水漂洗,显微镜下观察、拍照并计数。
1.9 统计学方法 采用GraphPad Prism 6软件进行统计学分析作图,计量资料采用均数±标准差表示,2组均数的比较采用t检验;多组均数的比较采用方差分析,组间比较采用Dunnet t检验,以P<0.05为差异有统计学意义;细胞迁移划痕实验采用Image-Pro Plus 6.0软件分析细胞的平均迁移速率。
2 结果
2.1 乳酸促进H1299细胞的迁移及相关蛋白水平的上升 Transwell实验结果显示,利用20 mmol/L乳酸处理过的H1299细胞穿膜比例明显高于未处理过的细胞,是对照组10倍,差异有统计学意义(P<0.05) (图1A、图1B);Western blot结果显示,不同浓度乳酸处理H1299细胞,GPR81、Nrf2和LDHA蛋白表达水平随着乳酸浓度的递增而成上升趋势(图1C、图1D)。
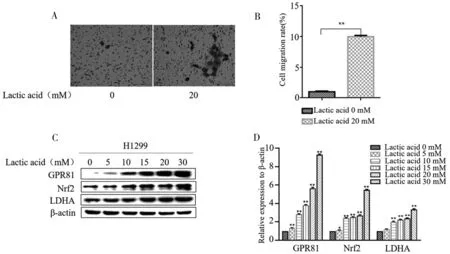
图1 乳酸促进H1299细胞的迁移及相关蛋白水平的上升
2.2 GPR81介导乳酸对Nrf2/LDHA通路的上调
Western blot结果显示,在H1299细胞中转染GPR81 siRNA,Nrf2和LDHA的蛋白表达水平明显下降,同时也观察到p-AKT蛋白水平的降低(图2A、图2B);当在H1299细胞中加入PI3K-AKT通路抑制剂LY294002时,p-AKT蛋白水平降低,Nrf2和LDHA蛋白表达水平随之降低(图2C、图2D)。

图2 GPR81介导乳酸对Nrf2/LDHA通路的上调
2.3 Nrf2对LDHA促进作用的分子机制 Western blot结果显示,在H1299细胞中转染Nrf2 siRNA,不同浓度乳酸处理,LDHA蛋白表达水平降低,并随着乳酸浓度的递增而成上升趋势(图3A、图3B);构建完成不同片段长度的LDHA启动子质粒LDHA-luc(1 249 bp)和LDHA-luc(238 bp)(图3C、图3D);在H1299细胞中转染pcDNA3.1+LDHA-luc(238 bp)、Nrf2+LDHA-luc(238 bp)、pcDNA3.1+LDHA-luc(1 249 bp)和Nrf2+LDHA-luc(1 249 bp),与对照组相比,Nrf2对LDHA启动子活性有促进作用,并且LDHA-luc(1 249 bp)活性比LDHA-luc(238 bp)活性高(图3E)。
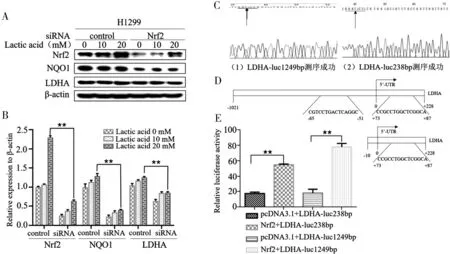
图3 Nrf2对LDHA促进作用的分子机制
2.4 LDHA的表达影响H1299细胞的迁移速率细胞迁移划痕实验结果显示,在H1299细胞中转染Nrf2+LDHA siRNA实验组的迁移速率明显比转染Nrf2+control siRNA实验组的迁移速率慢(图4A);且在96 h内的平均迁移速率分别为(15.4±0.5)μm/d、 (38.7±0.5)μm/d和(19.0±0.5)μm/d(图4B)。

图4 LDHA的表达影响H1299细胞的迁移速率
3 讨论
肺癌侵袭转移的动态过程是多因素、多环节、连续渐进的,涉及到多个基因的突变和功能变化,引起许多信号通路功能的异常,进而引发有助于肿瘤生长的生物学效应[12]。有研究显示,肿瘤细胞的侵袭迁移与肿瘤微环境中乳酸的不断积累有密切联系[13]。有氧糖酵解是由肿瘤细胞内基因突变而诱发的代谢重编程,即在氧气充足条件下,将丙酮酸转化为乳酸,而不是进入三羧酸循环[14],其主要功能是使糖酵解产物通过旁路途径合成核酸、蛋白质及脂肪酸的前体[15],从而满足肿瘤生长的需要,在肿瘤细胞迁移过程中起了关键作用。Nrf2作为对氧化还原敏感的核转录因子,在受到氧化剂等物质刺激时,会由细胞质转移到细胞核中,启动ARE调控氧化应激蛋白和多种Ⅱ相解毒酶基因转录[16]。从而探索Nrf2对LDHA的诱导为进一步探索肿瘤代谢和微环境对癌细胞生长的影响做出了铺垫。
在高浓度的乳酸环境中,乳酸水平的稳定是靠单羧酸转运蛋白(MCTs)来调控。在体外模拟肿瘤微环境,当用乳酸作为癌细胞的主要能源时,GPR81表型缺失的癌细胞,对乳酸水平变化不敏感,线粒体活性受到抑制,细胞的生长和增殖受到影响,而正常的癌细胞中,MCTs和过氧化物酶体增殖物激活受体-γ共激活因子-1α(PGC-1α)的水平相应增加[6],因此,GPR81在癌细胞的生存中起重要作用。本文将GPR81作为乳酸介导Nrf2/LDHA信号通路的关键因素进行探索研究,并进行了证明。
综上所述,本研究通过乳酸对H1299细胞迁移的影响,探索了核转录因子Nrf2对LDHA促进作用的分子机制,进而明确了乳酸通过GPR81调控Nrf2/LDHA的信号通路,为后期临床癌细胞侵袭迁移的相关研究奠定了基础。
——一道江苏高考题的奥秘解读和拓展

