玉米秸秆低温降解复合菌的筛选及其菌种组成
张鑫,青格尔,2,高聚林,2*,于晓芳,2*,胡树平,张必周,韩升才,冯彪
(1.内蒙古农业大学农学院,呼和浩特 010019;2.内蒙古自治区作物栽培与遗传改良重点实验室,呼和浩特 010019;3.内蒙古农业大学园艺与植保学院,呼和浩特 010019;4.内蒙古农业大学职业技术学院,包头 014100)
作物秸秆是一种高效、经济、具有丰富营养元素的可再生有机资源[1]。据统计,我国作物秸秆年产量近8.5亿t,其中玉米秸秆产量最大,约为2.8亿t[2−3],有研究表明,长期秸秆还田可以增加土壤有机碳,改善土壤理化性质[4];秸秆还田还可以使秸秆中的矿质营养返还到土壤中,促进养分平衡[5],但秸秆中含有纤维素、半纤维素、木质素等物质形成的坚固复杂的组织,使秸秆天然降解难度高[6−7]。我国北方地区低温持续时间长,大量农作物秸秆未能得到及时有效的利用,造成资源的浪费[8]。目前,木质纤维素类物质的处理方法主要有物理方法、化学方法和生物降解,其中生物降解具有降解率高、安全环保、成本低、可再生等优点。因而,微生物降解技术成为提高低温地区还田玉米秸秆快速、高效腐解的有效措施之一[9−10],而筛选低温玉米秸秆降解菌是添加外源微生物促进秸秆原位腐化的关键。自然界中广泛存在具有高效降解木质纤维素酶系统的微生物,如王春芳等[11]以堆肥为菌源采用外淘汰方法获得的复合菌系F1在40 ℃条件下培养10 d 后秸秆总降解率为52.55%,其中Bacillus、Pet⁃rimonas、Pusillimonas为秸秆降解关键物种;WANG等[12]从芦苇池塘污泥中获得的复合菌系LDC 培养15 d后,芦苇秸秆木质素降解率达60.9%,半纤维素降解率达43.0%;苏鑫等[13]通过限制性富集培养技术从腐烂芦苇秸秆根部土壤中筛选获得木质素降解复合菌系LDC,在32 ℃条件下培养7 d,木质素最大降解率为44.5%,其优势菌种为Pseudomonas、Pannonibacter、Thauera。
本团队长期从事玉米秸秆低温高效降解微生物筛选研究,前期筛选出的复合菌系GF−20以滤纸作为碳源进行筛选,玉米秸秆降解率达32.29%[14],具有良好的稳定性[15],对纤维素和半纤维素降解效果较好,但对木质素组分的降解效果不理想。且内蒙古地区秋冬季气温低,周期长,中高温菌及其酶的应用受到了较大限制,因此本研究在前人研究基础上,将玉米秸秆作为碳源,以内蒙古不同地区多年秸秆还田土壤、牛羊粪等菌源样品为材料,经多层次递进式筛选获得玉米秸秆低温高效降解菌系,并对获得的复合菌系进行玉米秸秆降解效率和菌种组成多样性分析,旨在为原位还田玉米秸秆低温腐解提供功能菌系,促进玉米秸秆的合理利用及耕地保护和生态安全,实现农业废弃物秸秆的资源化利用和农业可持续发展。
1 材料与方法
1.1 试验材料
试验于2018—2019 年在内蒙古农业大学玉米中心微生物实验室(内蒙古自治区包头市土默特右旗沟门镇)进行。供试菌源样品为实验室4 ℃下保存的采集自内蒙古自治区呼伦贝尔、兴安盟、通辽和赤峰地区多年秸秆还田土壤、牛羊粪、森林腐殖质等57 份菌源材料,供秸秆降解菌的筛选。对照复合菌GF−20为本团队以简单纤维素材料滤纸为碳源筛选获得的低温降解菌,主要由Cellvibrio mixtussubsp.、Azospira oryzae、Arcobacter defluyii、Bacillussp.等组成,10 ℃下培养15 d秸秆降解率为32.29%[14]。
玉米秸秆取自内蒙古农业大学玉米中心试验田(内蒙古自治区包头市土默特右旗沟门镇北只图村)收获的玉米秸秆(纤维素、半纤维素和木质素含量分别为53.46%、27.32%和11.71%),挑选粗细、大小适中的玉米秸秆,取回后用流水冲洗干净,在65 ℃的烘箱中烘至恒质量,烘干后的玉米秸秆再剪成2~3 cm的小段,灭菌备用。
1.2 培养基
基础培养基(AO 培养基):尿素0.2 g、(NH3)2SO40.8 g、K2HPO40.5 g、CaCO31.0 g、NaCl 0.1 g、MgSO40.025 g、500 mL蒸馏水,pH值6.5。
蛋白胨纤维素培养基(PCS 培养基):蛋白胨5.0 g、酵母粉5.0 g、NaCl 5.0 g、CaCl22.0 g、K2HPO40.5 g、MgSO4·7H2O 0.5 g、1 L蒸馏水,pH值6.7。
Mandels 培养基(M 培养基):K2HPO43.0 g、NaNO33.0 g、CaCl20.5 g、MgSO4·7H2O 0.5 g、Fe2SO4·7H2O 7.5 mg、MnSO4·H2O 2.5 mg、ZnSO42.0 mg、CoCl23.0 mg、1 L蒸馏水,pH值6.8。
产酶培养基:尿素0.6 g、蛋白胨0.5 g、(NH3)2SO42.0 g、K2HPO41.0 g、MgSO4·7H2O 0.05 g、MnSO4·7H2O 0.016 g、ZnSO4·7H2O 0.017 g、CaCl20.02 g、NaCl 0.2 g、蒸馏水1 L。
于100 mL 三角瓶中加入40 mL 培养液和1.0 g 玉米秸秆,121 ℃灭菌20 min,备用。
1.3 试验设计
1.3.1 复合菌系的筛选
初筛:分别称取2 g 菌源样品接种到装有玉米秸秆的M 培养基、PCS 培养基和AO 培养基中,置于20 ℃恒温培养箱中进行富集培养,当三角瓶中液体变浑浊、玉米秸秆出现腐解现象时开始转接,如此转接2代。
复筛:吸取F2 代培养液按5%(V/V)的接种量重新转接到M 培养基、PCS 培养基和AO 培养基中,且秸秆降解表现稳定时每转接一代温度降低1 ℃,直至降低到15 ℃。在限制性继代培养低温驯化过程中,淘汰分解能力减弱的样品,如此连续培养8 代。根据不同培养代数秸秆降解率判断复合菌系秸秆降解能力,选取降解效果好的复合菌系进行下一步研究。
1.3.2 复合菌系玉米秸秆降解性能检测
将复筛获得的复合菌系以5%(V∶V)的接种量接入产酶培养基和M 培养基中,在15 ℃恒温条件下静置培养,第1、5、10、15、20 d测定纤维素、半纤维素、木质素酶活性以及玉米秸秆降解率及木质纤维素降解率,明确复合菌系降解特性。
1.4 测定指标与方法
1.4.1 酶活性的测定
将复合菌系接种于产酶培养基中,15 ℃下分别在培养第1、5、10、15、20 d 时取各复合菌系发酵液10 mL,4 ℃、5 000 r·min−1条件下离心10 min,取上清液(粗酶液)5 mL,测定酶活性。采用《纤维素酶制剂》(QB/T 2583—2003)中DNS 法测定滤纸酶活性和内切−1,4−β−葡聚糖酶活性;采用《饲料添加剂木聚糖酶活力的测定分光光度法》(GB/T 23874—2009)中DNS法测定木聚糖酶活性;采用ABTS 法[16]测定漆酶的活性,藜芦醇法[16]测定木素过氧化物酶活性,3次重复。
1.4.2 玉米秸秆降解率的测定
接种后第1、5、10、15、20 d 取出秸秆,用水洗净,于65 ℃烘箱中烘干至恒质量,采用下列公式计算玉米秸秆降解率,3次重复。
式中:W0 为接种前培养基中的秸秆质量,g;W1 为培养结束烘干后降解剩余的秸秆质量,g;W2 为玉米秸秆降解率,%。
1.4.3 玉米秸秆木质纤维素含量的测定
接种后第1、5、10、15、20 d取出秸秆,用蒸馏水洗净,将降解后的秸秆烘干粉粹后过1 mm筛,采用纤维素分析仪(ANKOM A200i)测定木质素、纤维素、半纤维的含量,并计算木质纤维素降解率,3次重复。
1.4.4 复合菌系微生物组成多样性分析
将供试菌系15 ℃静置培养21 d 后取发酵液5 mL,4 ℃、5 000 r·min−1离心10 min,弃上清液,留沉淀,如此反复多次,确保已完全沉淀,后交由上海美吉生物医药科技有限公司进行16S rRNA 基因测序,PCR 引物为338F(5′−ACTCCTACGGGAGGCAGCAG−3′)和806R(5′−GGACTACHVGGGTWTCTAAT−3′),GF−20 由北京奥维森基因科技有限公司完成MiSeq高通量测序[15]。
1.5 数据处理
理化特性数据采用SPSS 22.0 软件进行方差分析,采用SigmaPlot 12.5 作图。微生物菌种组成测序数据采用RDP classifier 贝叶斯算法(Version 2.2,http://source forge.net/projects/rdp−classifier/),在Qi⁃ime 平 台(http://qiime.org/scripts/assign_taxonomy.ht⁃ml)下,以0.7 为置信度阈值,将OTU 代表序列与Silva数据库(Release128,http://www.arb−silva.de)进行比对,获得OTU代表序列的分类学信息。
2 结果与分析
2.1 玉米秸秆低温高效降解复合菌系的筛选
57 份菌源材料经富集培养和初筛,获得22 份可高效降解玉米秸秆的材料,并对其进一步低温驯化和限制性培养后,获得9 份降解玉米秸秆的复合菌系,分别 为M44、M14、M2、P22、A14、M1、M36、M38 和M55。
各复合菌系不同代数秸秆降解率如图1 所示,菌系M44、M14 和M2 在各培养代数中秸秆降解率均显著高于其他菌系,15 ℃培养20 d,F11 代秸秆降解率分别为34.89%、34.77%和34.44%。培养至F9、F10和F11 代时,菌系M44、M14 和M2 的秸秆降解率趋于稳定,各代数降解率无显著差异。各复合菌系酶活性如表1 所示,复合菌M44 的内切葡聚糖酶活性为1.90 U·mL−1,与M14 和M2 无显著差异,但显著高于其他菌系;滤纸酶活性表现为M44、M14、M2、P22 间无显著差异,但均显著高于除A14 外的其他菌系,酶活性分别为2.74、2.44、2.43 U·mL−1和2.58 U·mL−1;木聚糖酶活性表现为M44、M14、M2、P22、M1 和M36 间无显著差异,但与M38 差异显著,其中M44 酶活性最高,为10.40 U·mL−1;漆酶的活性表现为M44 与M14 间差异不显著,但均显著高于除P22 外的其他菌系,酶活性分别为57.19 U·L−1和61.77 U·L−1;木素过氧化物酶活性表现为P22和M14显著高于其他菌系,酶活性分别为97.16 U·L−1和93.71 U·L−1。
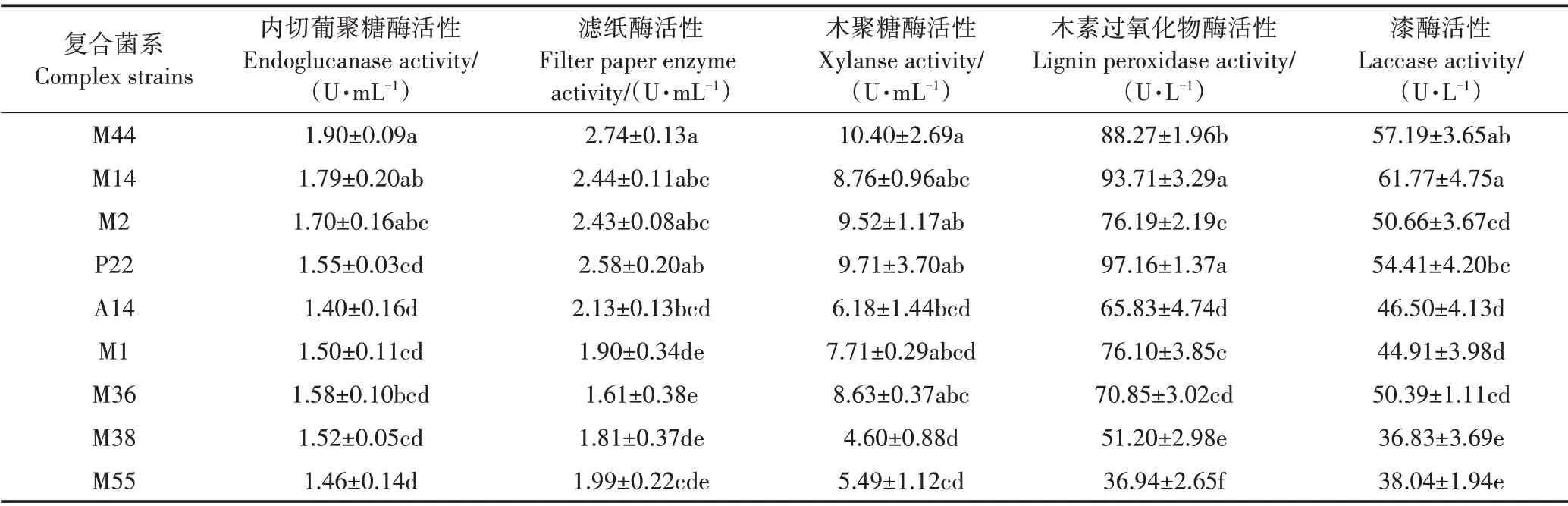
表1 复合菌系酶活性分析Table 1 Enzyme activity analysis of complex strains
根据秸秆降解率及酶活性指标进行复筛,对复合菌系M44、M14和M2进一步分析,并以团队之前筛选获得的复合菌系GF−20 为对照。供试菌系来源见表2。

表2 供试菌系来源Table 2 Strains collecting site
2.2 复合菌系酶活性动态分析
2.2.1 复合菌系滤纸酶、内切葡聚糖酶活性动态
由图2 可知,各复合菌系纤维素酶活性均随培养时间呈先升高后降低的单峰曲线变化。其中,各复合菌系滤纸酶活性在培养5 d 或10 d 时达到峰值,M44的最高酶活性显著高于其他菌系,为2.53 U·mL−1,较GF−20 高出6.72%。在培养5 d 时复合菌系M44 和GF−20的内切葡聚糖酶活性均表现最高,酶活性分别为2.33 U·mL−1和2.29 U·mL−1,无显著差异。
2.2.2 复合菌系木聚糖酶活性动态
由图3 可知,各复合菌系木聚糖酶活性呈先升高后降低的单峰曲线变化。在培养5 d 时,各复合菌系达到最高值,其中复合菌M44 的木聚糖酶活性最高,为4.08 U·mL−1,较GF−20高13.97%。
2.2.3 复合菌系漆酶活性动态
各复合菌系漆酶活性如图4 所示,漆酶活性与木聚糖酶活性变化一致。酶活性于培养第5 d 时达到峰值,复合菌M44、M14 和M2 漆酶活性分别为126.94、117.82、113.28 U·L−1,其中,复合菌M44 酶活性较GF−20高17.88%,且差异显著。
2.3 复合菌系玉米秸秆降解特性变化动态
2.3.1 复合菌系玉米秸秆降解率变化动态
各复合菌玉米秸秆降解率如图5所示,随培养时间的增加,秸秆降解率呈增加趋势,各复合菌系从培养1 d到5 d的秸秆降解率增幅最大,培养5 d后降解速率减缓。培养20 d时,复合菌M44、M14、M2和GF−20的秸秆降解率分别为35.33%、33.34%、31.33%和31.48%,M44降解率较GF−20显著高出3.85个百分点。
2.3.2 复合菌系木质纤维素降解率变化动态
由图6 可知,随着玉米秸秆的分解,各复合菌系的木质纤维素组分含量逐渐降低,且纤维素降解率显著高于半纤维素和木质素降解率。从培养1 d 到20 d,GF−20处理的秸秆纤维素降解率增加了39.69个百分点,显著高于其他菌系;M44 和GF−20 处理的秸秆半纤维素降解率分别为30.34%和28.77%,高于菌系M14 和M2;菌系M44 处理的木质素降解率增加了14.63个百分点,较GF−20高3.28个百分点,且差异显著。
2.4 复合菌系微生物群落多样性和结构组成差异分析
由玉米秸秆降解特性数据可知,筛选驯化所得的复合菌具有较强的玉米秸秆降解能力,为了进一步明确该复合菌系的优势菌种,对其进行微生物组成多样性分析,结果如图7 所示。基于门分类水平(Others<1%),各复合菌系的细菌群落主要隶属4 个门,分别为Proteobacteria(变形菌门)、Firmicutes(厚壁菌门)、Bacteroidetes(拟杆菌门)和Actinobacteria(放线菌门)。其中,Proteobacteria 是菌系中最丰富的细菌类群,在M44、M14、M2 和GF−20 中相对丰度分别为53.67%、60.52%、70.10%和65.48%;Firmicutes 在M44中所占比例最高,为26.99%,与M2 和GF−20 差异极显著,与M14 差异不显著;Bacteroidetes 在M44、M14、M2 和GF−20 菌系中相对丰度分别为12.78%、9.93%、20.29%和10.67%,菌系间差异达极显著水平;Actino⁃bacteria 在菌系M44 和M14 中相对丰度分别为3.03%和6.79%,在M2和GF−20中的比例接近于0。
进一步分析复合菌系M44、M14、M2 和GF−20 组成细菌属水平(Others<5%)分类(图8)得知,菌系M44、M14、M2 与GF−20 在细菌群落多样性和组成丰度上均具有显著差异。菌系M44 中优势菌属主要有Trichococcus(毛球菌属)和Acinetobacter(不动杆菌属),分别占细菌群落总量的19.65%和13.24%,菌系M14 细菌群落结构中占比最多的是Azospirillum(固氮螺旋菌,13.23%)、Enterococcus(肠球菌属,8.27%)和Brevundimonas(短波单胞菌属,7.34%);菌系M2 细菌群落组成主要包括Delftia(代尔夫特菌属,15.33%)、Sphingobacterium(鞘氨醇杆菌属,12.02%)和Brevun⁃dimonas(短波单胞菌属,7.13%);菌系GF−20 细菌群落结构中占比最多的是Pseudomonas(假单胞菌属,50.84%)、Dysgonomonas(微生长单胞菌属,5.86%)、Achromobacter(无色杆菌属,4.94%)。其中,Pseudo⁃monas在GF−20 中最丰富,显著高于其他菌系,Dys⁃gonomonas在菌系M44、M14、M2 和GF−20 细菌群落结构中占比分别为3.73%、3.51%、4.04%和5.86%,菌系间差异不显著。
3 讨论
3.1 玉米秸秆低温降解复合菌的筛选
为提高低温地区还田作物秸秆腐解速率,低温秸秆降解菌的筛选研究逐渐成为热点。王春芳等[11]从秸秆堆肥样品中获得复合菌系F2,40 ℃下培养10 d,秸秆降解率为40.95%;郭夏丽等[17]复配获得的秸秆降解复合菌在30 ℃培养14 d,玉米秸秆降解率为45.7%;刘尧等[18]筛选的复合菌系22 ℃培养16 d,玉米秸秆降解率达38.5%;杨梦雅等[19]从腐叶土中筛选出的复合菌系PLC−8,在20 ℃下培养30 d,玉米秸秆的降解率为43.65%。近年来有关低温降解菌的报道较多,萨如拉等[20]从腐烂树叶和高原腐烂锯末中筛选出两组低温玉米秸秆降解菌系1 号和8 号,15 ℃培养15 d,玉米秸秆降解率分别为30.21%和32.21%;胡海红等[10]研究表明复合菌系GF−S72 在10 ℃条件下培养15 d,玉米秸秆降解率为25.6%。本研究在QIN⁃GGEER 等[14]的试验基础上,将碳源由简单纤维素材料滤纸替换为天然木质纤维素材料玉米秸秆,增加了筛选的针对性和准确性,缩短了筛选时间。其中,从内蒙古呼伦贝尔风干羊粪中筛选获得一组低温秸秆降解菌M44,15 ℃培养15 d 后秸秆降解率为33.33%,较中、高温菌具有更强的低温降解秸秆能力,且在同等低温条件(15 ℃下培养15 d)下,较前人研究的秸秆降解率高出3.47%~10.32%,为低温地区还田玉米秸秆的快速腐解提供优良的菌系资源。秸秆中木质素是由聚合的芳香醇构成的物质[21],不易被分解,本研究中复合菌M44 在15 ℃时漆酶活性较高,且培养20 d木质素降解率达17.44%,在降解木质纤维素类物质方面具有明显优势,具有进一步开发利用的价值。
3.2 复合菌系微生物组成多样性分析
基于门分类水平,菌系M44 主要由Proteobacte⁃ria、Firmicutes、Bacteroidetes 等组成,研究表明,Fir⁃micutes 门是污泥堆肥和玉米秸秆堆肥中重要的细菌类群之一,能利用可发酵碳水化合物产生大量乳酸等代谢产物,并具有抵抗极端环境的能力[22];Bacteroide⁃tes 能够分解蛋白胨或葡萄糖,产生琥珀酸、乙酸、甲酸、乳酸和丙酸等秸秆中间代谢产物,具有降解纤维素的能力[23]。本研究中复合菌系M44 能够在低温条件下快速高效地降解玉米秸秆,其中起主要作用的细菌可能为Trichococcus、Acinetobacter、Pseudomonas、Azospirillum、Flavobacterium、Rhizobium和Brevundimo⁃nas。有研究表明Trichococcus可以在低温(低至−5 ℃)下生长,分解多糖,产生乳酸、甲酸和乙醇等,参与有机物的分解[24],为微生物生长提供所需要的营养物质。Azospirillum是一种与根相关的固氮螺菌菌株,表现为具有单一极性的弧菌细胞,分泌过氧化氢酶、氧化酶、酪蛋白酶、羧甲基纤维素酶等[25−26];Rhizo⁃biumYS−1r具有木质素降解能力,能够降解各种木质素单体、二聚体以及柳枝草和紫花苜蓿的天然木质素,并且分泌木质素过氧化物酶(LiP)[27−28],这两种细菌相对丰度的增加,可能是菌系M44具有远高于对照菌系的秸秆降解效率和能力的原因之一。孟建宇等[29]研究表 明,Arthrobacter、Flavobacterium、Rhizobi⁃um、Pseudomonas、Sphingomonas、Acinetobacter等是内蒙古大兴安岭森林土壤中的耐低温降解纤维素细菌,菌系M44 中Acinetobacter相对丰度仅次于Trichococ⁃cus,具有高效产生胞外纤维素酶和半纤维素酶的能力,能够降解木质纤维素类物质[30−32];此外Flavobacte⁃rium johnsoniae可以有效地降解果胶、几丁质、葡聚糖等生物大分子物质[33],与菌系中其他微生物协同降解木质纤维素,由此推断,菌系M44 在15 ℃条件下具有更高的秸秆降解能力是由于耐低温降解木质纤维素细菌在群落组成中更占优势。菌系M44 中还含有相对丰度较高的Brevundimonas和Pseudomonas,这一结果与罗立津等[23]研究中耐低温降解纤维素菌群A25−3 细菌群落组成相似,均可产生纤维素酶,具有降解纤维素的能力。此外,复合菌系M44菌系组成中还有一些微生物不具有木质纤维素降解能力,但它们可能与降解纤维素的微生物之间存在协同作用,使得复合菌系能够稳定存在并且有效地降解秸秆。
4 结论
(1)通过低温限制性继代培养技术从风干羊粪、鲜牛粪和草原草甸土壤中筛选出3 个具有稳定降解玉米秸秆潜力的复合菌系M44、M14 和M2,15 ℃条件下秸秆降解率分别为35.33%、33.34%和31.33%。其中,复合菌系M44 漆酶活性较对照GF −20 高17.88%,木质素降解率高出3.28 个百分点,具有良好的应用潜力。
(2)复合菌系M44 中优势菌属Trichococcus、Aci⁃netobacter、Azospirillum、Rhizobium等能够协同降解玉米秸秆,提高秸秆降解能力。本研究为木质纤维素类生物质的转化与利用提供一定的理论指导。

