早产儿早发败血症与胸腺大小及功能之间的关系*
刘亚兰, 宋 越, 陈 燕, 刘亚玲△
华中科技大学同济医学院附属协和医院 1儿科 2超声科,武汉 430022
胸腺是胎儿和新生儿T细胞池建立的来源,正常情况下,胸腺随年龄增长逐渐出现生理性退化。在胚胎后期和初生时,胸腺重量占机体体重是一生中最大的时期,是新生儿免疫系统的重要组成[1]。目前研究发现,各种病理因素会损伤胸腺功能,导致其形态和功能提前出现退化[1-2]。近十年,国外学者越来越关注影响胎儿和新生儿胸腺发育的研究[1-3],而国内少见报道。本文通过B超测量早发败血症(early-onset sepsis,EOS)早产儿的胸腺大小,探讨EOS对早产儿免疫功能的影响。
1 资料与方法
1.1 研究对象
采用前瞻性临床病例研究,收集2019年1月至2019年12月华中科技大学同济医学院附属协和医院新生儿重症监护病房收治的胎龄<32周的早产儿。纳入标准:①败血症组为确诊EOS患儿,诊断标准符合第5版《实用新生儿学》EOS确诊标准,出生后3 d内发病,血培养或脑脊液培养阳性[4]。对照组为非败血症患儿,按照我们以前研究方法,采用2∶1的比例与败血症组患儿配对,匹配胎龄(±1周)和出生体重(±100 g)[5];②临床资料完整者。排除标准:①住院时间小于72 h;②患儿合并有先天性免疫缺陷、先天性心脏病、先天性发育畸形者;③母亲患免疫性疾病者。本研究获得家长知情同意及华中科技大学同济医学院伦理委员会批准。
1.2 研究方法
1.2.1 临床资料收集 收集符合纳入标准患儿的临床信息。①围产期资料:包括胎膜早破、分娩方式、孕期合并糖尿病、产前激素、绒毛膜羊膜炎等;②一般资料:包括胎龄、出生体重、Apgar评分、是否为小于胎龄儿(small for gestational age,SGA)、新生儿呼吸窘迫综合征(neonatal respiratory distress syndrome,NRDS)等;③出生24 h内血常规结果。
1.2.2 胸腺检查方法 所有早产儿胸腺检查均在出生24 h内进行。超声仪器使用迈瑞M9便携式超声设备(中国,深圳,Mindray公司),应用频率3~10 MHz。按照文献报道方法,早产儿取仰卧位,于胸骨后窗测量胸腺大小,记录胸腺最大横径及其长轴矢状截面积,并计算胸腺指数(thymic index,TI)和胸腺/体重指数(thymus weight index,TWI)[6]。TI=最大横径×长轴截面积,TWI= TI/体重。床旁超声全部由同一位经验丰富的超声科医生完成,每次测量均进行2次。
1.3 统计学处理
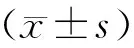
2 结果
2.1 基本临床资料
排除住院时间<72 h病例4例,早产儿合并先天性免疫缺陷1例、先天性心脏病3例、先天性发育畸形1例,母亲患免疫性疾病2例。共收集胎龄<32周、符合早发败血症诊断的早产儿病例24例,为败血症组;按前述方法行病例配对,收集胎龄<32周非感染病例48例,为对照组。比较两组的胎龄和出生体重差异无统计学意义。两组在性别、Apgar评分、分娩方式、SGA发生率、胎膜早破、母亲妊娠期糖尿病、产前激素使用率和NRDS发生率的差异均无统计学意义(表1)。与对照组相比,败血症组绒毛膜羊膜炎发生率显著增高(29.2%vs.8.3%,P<0.05),淋巴细胞计数明显降低[(3.338±1.540)×109/Lvs.(4.290±1.852)×109/L,P<0.05]。
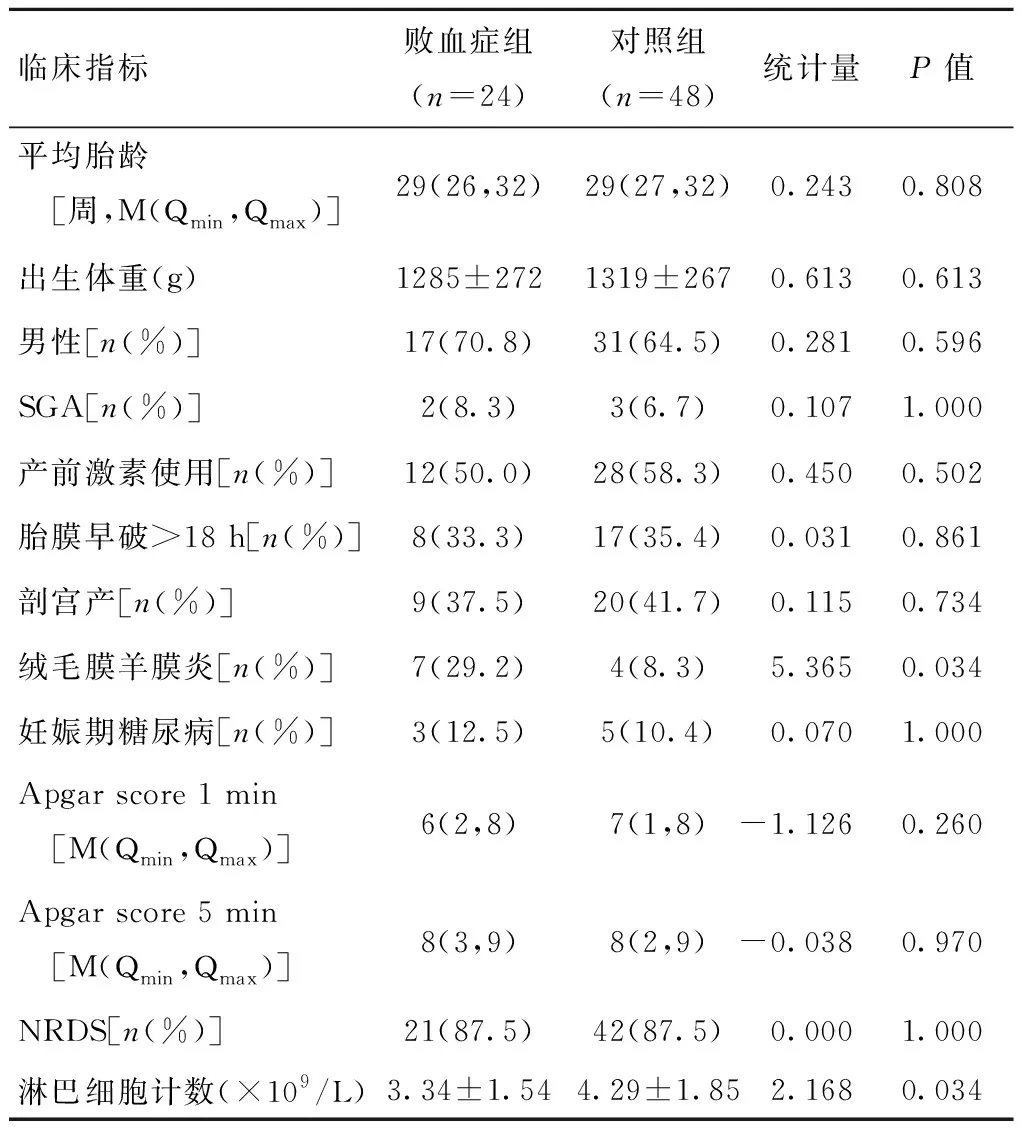
表1 败血症组与对照组早产儿一般情况比较Table 1 Demographic characteristics of sepsis preterm neonates and the controls
2.2 早产儿胸腺大小比较
应用B超于胸骨后窗测量胸腺最大横径和长轴矢状截面积(图1),计算TI和TWI。TI为胸腺绝对体积,TWI为胸腺相对体积。所有早产儿胸腺均可探及(100%)。败血症组胸腺与对照组相比,最大横径[(1.209±0.156) cmvs.(1.501±0.235) cm]和长轴截面积[(1.222±0.234)cm2vs.(1.504±0.266) cm2]明显减小(均P<0.05)。败血症组TI[(1.496±0.439) cm3]和TWI[(1.164±0.232) cm3/kg]较对照组[(TI:(2.304±0.790) cm3,TWI:(1.748±0.438) cm3/kg]也明显减小(均P<0.05)(见表2)。提示败血症组早产儿胸腺较对照组减小。
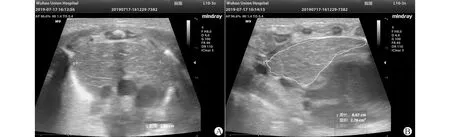
A:胸腺最大横径;B:胸腺长轴矢状截面积图1 B超在胸骨后窗测量胸腺大小示意图Fig.1 Ultrasonic assessment of thymic size
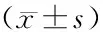
表2 两组早产儿胸腺大小比较Table 2 Comparison of thymus size between the two
2.3 淋巴细胞数目和胸腺大小的相关性分析
为了进一步探讨胸腺大小和淋巴细胞计数之间的关系,我们使用Pearson相关及线性回归分析TI与淋巴细胞数目的关系,发现淋巴细胞数目和胸腺大小呈线性正相关r=0.238,P=0.044。见图2。
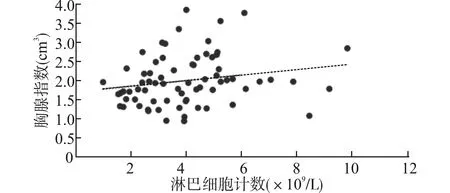
图2 胸腺大小与淋巴细胞数目相关性分析散点图Fig.2 Scatter plot showing correlation analysis between the thymus size and lymphocyte number
3 讨论
胸腺是免疫系统的主要器官,参与分化和介导T细胞免疫,其大小是反映机体免疫功能的重要预测指标[2]。胸腺随着胎儿生长而逐渐发育成熟。早产儿,尤其是胎龄越小的早产儿,胸腺发育越不成熟。目前国外对新生儿胸腺在新生儿疾病中作用的研究较多[2-3,6-8],而国内较少见。本研究通过B超测量早产儿胸腺大小,探究早发败血症的早产儿胸腺特点,有助于评价早产儿的免疫功能,为保护胸腺的免疫功能提供依据。
胸腺形态个体差异很大,胸片X线投影只能粗略估计胸腺外形,无法准确描述,而超声检查是一种安全有效的技术,可用于测量胸腺的大小[3,6]。我们用床边B超测量早产儿胸腺指数(TI)较Jeppesen等[3]的研究偏小。不同临床研究之间新生儿出生时TI的差异很大[2-3,8],这种差异可能与研究人群种族、遗传、环境、地理或气候差异均有关。新生儿胸腺大小与胎龄、出生体重密切相关[3],并且宫内发育迟缓或低出生体重新生儿的胸腺比正常体重新生儿小[2,8],提示出生体重对胸腺大小的影响。因此我们采取配对病例研究,两组早产儿胎龄和体重差异无统计学意义,消除了胎龄和出生体重对结果的影响。
我们纳入研究的早产儿(胎龄<32周)一般临床资料,包括出生情况和围生期情况,与国内多中心发表的最新研究临床特点基本一致[7]。早产/极低出生体重、胎膜早破和羊膜腔内感染是新生儿早发败血症的三大危险因素[4]。我们研究证实,与对照组相比,败血症组绒毛膜羊膜炎发生率明显增高,胎膜早破和产前激素使用率无明显差异。胸腺在机体免疫状态发生改变时,如应激、感染、营养不良等,可出现急剧退化,体积缩小[1-3]。我们发现败血症组的胸腺是萎缩减小的。孕母和子宫内早期环境影响胎儿生命后期免疫系统发育。一方面,母亲绒毛膜羊膜炎可导致胎儿急性胸腺退化[9]。国外临床研究证实胸腺退化可作为新生儿感染的一个诊断指标[3,10]。我们前期的动物实验也证实新生鼠败血症时胸腺明显退化萎缩[11]。这些都有力证实了感染导致胎儿和早产儿胸腺的萎缩。另一方面,产前激素的应用可以预防早产儿NRDS的发生,但同时也会抑制胎儿的胸腺发育[9,12]。以上证实了产前感染和激素的应用对胎儿胸腺的发育都有影响。羊膜炎发生前应用激素,可部分减弱感染对胸腺发育的抑制作用,但增加胎儿胸腺的细胞凋亡,而羊膜炎发生后应用激素并不能抑制感染对胎儿胸腺的作用[9]。本研究没有统计羊膜炎和产前激素的关系,且两组早产儿产前激素的应用没有差异,因此激素对败血症早产儿胸腺的影响需要进一步研究。
胸腺的大小和功能相互关联[6]。我们通过外周血淋巴细胞计数和胸腺大小的相关性分析证实,淋巴细胞数目和胸腺大小呈正相关,并发现败血症组的淋巴细胞计数较对照组低。未成熟的T细胞发育时,首先从骨髓迁移到胸腺,在胸腺分化成熟,而后再释放至外周免疫器官。胸腺退化时胸腺皮层变薄发生萎缩,幼稚T细胞的输出减少[1]。我们曾证实新生鼠败血症胸腺出现退化,胸腺细胞减少,胸腺上皮细胞数量也减少,影响胸腺细胞阴性和阳性选择过程,导致T细胞输出减少[12]。根据胸腺退化的程度,循环血淋巴细胞数目和比例显著不同,这与胸腺退化导致循环血液中T和B淋巴细胞的比例减少、淋巴细胞耗竭相关。因此,淋巴细胞水平降低可以间接反映败血症组早产儿胸腺功能损伤。我们临床实践中,在关注败血症患儿炎症指标的同时,可以关注淋巴细胞的数目,以评估患儿的胸腺免疫功能状态。后期我们将随访这些早产儿的胸腺大小和免疫功能状态。
综上所述,早发败血症早产儿胸腺退化,影响机体的免疫功能。胸腺退化更增加了早产儿感染的易感性[3]。因此,早期监测胸腺大小和功能将有利于及早发现败血症,及早治疗,缩短病程,保护胸腺的免疫功能,有助于胸腺结构和功能的恢复,提高机体免疫能力。

