靶向温度管理对重型脑损伤患者脑细胞功能、吞咽功能及神经功能重建介质的影响
王巧琳,何芙蓉,简福霞
(1.成都医学院第一附属医院神经外科,四川 成都 610500;2.陆军军医大学大坪医院战创伤医学中心重症医学科,重庆 400042)
重型脑损伤(STBI)为神经外科常见疾病,患者多病情危重,且进展迅速,若治疗不当,患者常易留下残疾或在短时间内死亡[1]。颅内压(ICP)升高及神经功能损伤是STBI进展并导致患者死亡的重要因素,控制ICP、保护并促进神经功能恢复是STBI临床治疗的关键[2]。资料显示,靶向温度管理(TTM)是经降低核心体温到特定温度以保护组织器官的物理疗法,对于STBI也具有较高的治疗价值[3]。成都医学院第一附属医院于2016年7月至2020年6月将TTM应用于STBI的临床治疗,以评价其对患者脑细胞功能、吞咽功能及神经功能重建介质的影响,结果符合预期,报道如下。
1 资料与方法
1.1 一般资料选取2016年7月至2020年6月于成都医学院第一附属医院神经外科接受治疗的STBI患者92例,纳入标准:①经影像学及临床症状诊断为STBI者;②预期生存>90天者;③病情稳定者;④治疗依从性良好;⑤经医学伦理委员会批准,患者或家属签署知情同意书。排除标准:①颅脑开放性损伤者;②既往颅脑损伤或(和)颅脑手术者;③合并重要脏器损伤或其功能衰竭者;④肝肾功能异常者;⑤中途放弃治疗或自愿要求出院者;⑥恶性肿瘤者。92例中男56例,女36例;年龄22~69岁[(43.47±4.53)岁];GCS评分3~8分[(5.46±0.56)分];损伤类型:脑挫裂伤74例,颅内血肿16例,其他2例;损伤因素:交通伤44例,高坠伤23例,摔伤21例,打击伤4例;受伤至入院时间1~3.5 h[(1.49±0.17)h]。按照随机数字表法分为TTM组与对照组各46例,两组患者性别、年龄、GCS评分、损伤类型、损伤因素、受伤至入院时间等基线资料比较,差异无统计学意义(P>0.05)。见表1。
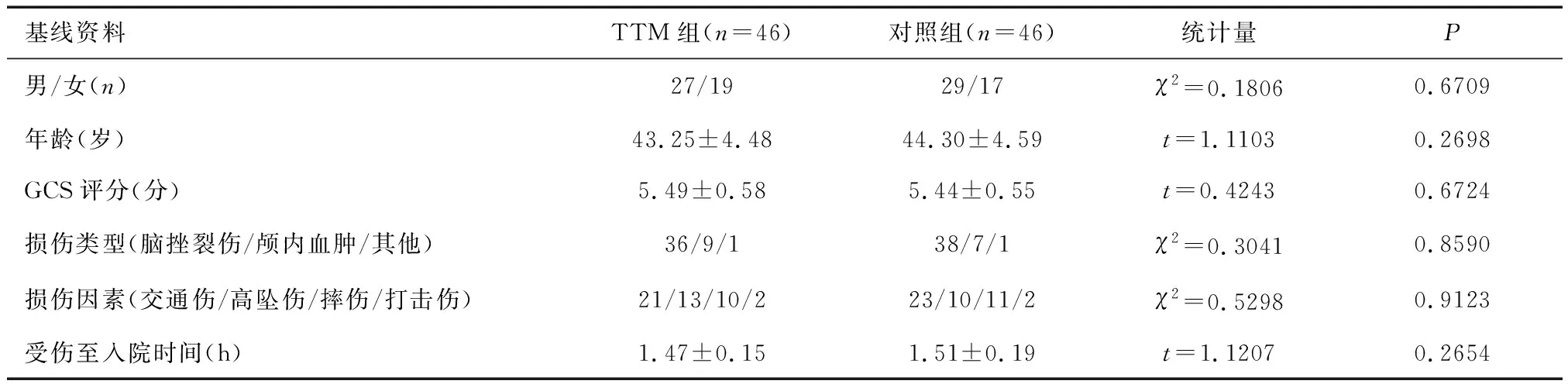
表1 两组患者基线资料比较
1.2 方法两组均行大骨瓣减压+血肿清除术、脱水、抗感染、维持水电解质平衡等治疗。对照组:给予常规管理,监测血气、ICP、体温,保持氧气供应及呼吸通畅,发生异常立即对症处理。TTM组:在对照组基础上行TTM。以冰毯、亚低温治疗仪全身降温,微量泵泵入冬眠合剂,泵入速度6 ml/h,将患者肛温控制于32~35 ℃,共5 d。5 d后以自然复温法复温,依次停止使用冬眠合剂、冰毯、亚低温治疗仪,自然复温时间为24 h。
1.3 观察指标观察两组治疗前及治疗1、3、5天颅内压(ICP);治疗前后两组血清髓鞘碱性蛋白(MBP)、神经元特异性烯醇化酶(NSE)、胶质纤维酸性蛋白(GFAP)等脑细胞功能指标;血清神经生长因子(NGF)、脑源性神经生长因子(BDNF)等神经功能重建介质。吞咽功能以标准功能评定量表(SAA)[4]进行评价,量表共包括三部分,共18~46分,得分越高,提示吞咽功能越差。
1.4 统计学方法应用SPSS 19.0统计软件分析,计量资料以均数±标准差表示,比较行t检验或重复测量数据的方差分析;计数资料以例数描述,行χ2检验。检验水准α=0.05。
2 结果
2.1 两组患者治疗前后ICP比较治疗前两组ICP比较,差异无统计学意义(P>0.05);治疗1、3、5天两组ICP均较治疗前降低,且TTM组ICP低于对照组(P<0.01)。见表2。

表2 两组治疗前后ICP比较 (mmHg)
2.2 两组脑细胞功能指标比较治疗前两组血清MBP、NSE、GFAP水平差异均无统计学意义(P>0.05);治疗后,两组血清MBP、NSE、GFAP水平均降低,且TTM组指标均低于对照组(P<0.05)。见表3。

表3 两组脑细胞功能指标比较
2.3 两组SAA评分、神经功能重建介质比较治疗前,两组SAA评分及血清NGF、BDNF水平差异均无统计学意义(P>0.05);治疗后,两组SAA评分均减小,血清NGF、BDNF水平均升高,且TTM组SAA评分小于对照组,血清NGF、BDNF水平高于对照组(P<0.05)。见表4。
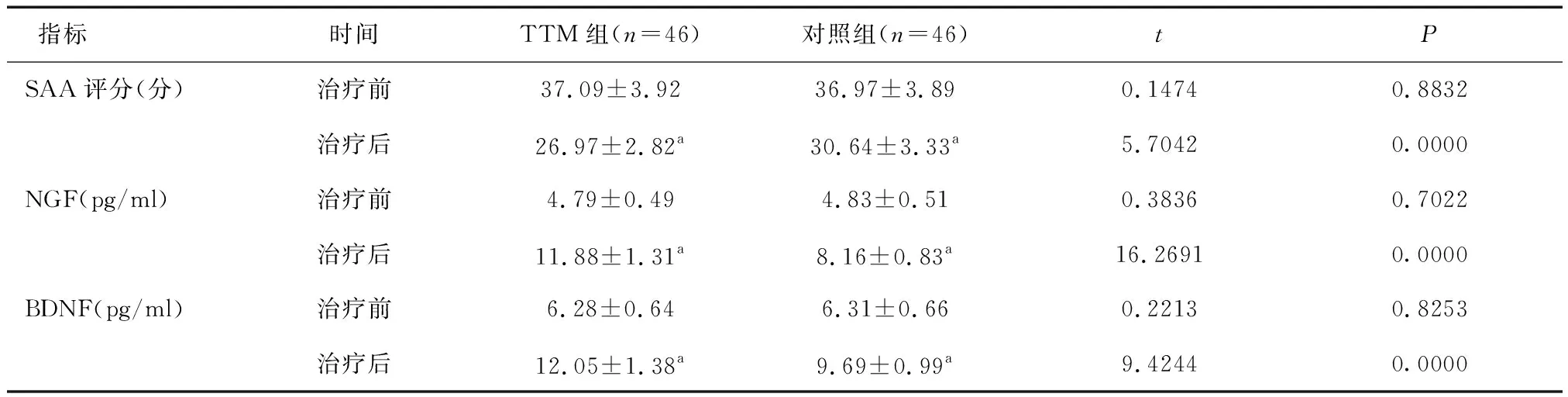
表4 两组SAA评分、神经功能重建介质比较
3 讨论
STBI是外界暴力作用于颅脑导致的急危重症[5]。目前,尽管针对STBI的研究成果较为丰富,且多已应用于临床,但其疗效仍不尽满意[6]。TTM是通过靶向降低患者体温,保护脑组织,改善患者预后的物理疗法[7]。研究证明,TTM应用于STBI具有下述优势[8~12]:减少脑组织氧耗及能耗,使脑组织处于休眠状态,抑制多种病理生理反应,保护血脑屏障,缓解脑水肿,降低ICP,避免脑组织发生继发性损伤;抑制免疫炎症反应及机体应激,抑制免疫炎症介质及应激介质生成,缓解其导致的神经及细胞毒性,在保护STBI患者脑细胞的同时促进其功能恢复;经抑制释放兴奋性氨基酸抑制表达凋亡蛋白,进而影响凋亡信号通道,避免缺血半暗带区域脑细胞凋亡;经抑制钙内流抑制其毒性作用,维护脑细胞膜正常结构;降低脑代谢水平,避免乳酸大量生成导致的脑损伤;减少分泌凝血活酶,降低其神经毒性作用,抑制出现高凝状态,缓解脑组织继发性损伤。本研究治疗1、3、5天TTM组ICP均低于对照组,提示TTM可有效降低STBI患者ICP,避免加重脑组织损伤。
MBP、NSE、GFAP是脑细胞功能损伤的重要标志物[13]。MBP为强碱性蛋白,多存在于髓鞘及脑白质中,是髓鞘及神经元的重要组成。MBP主要由血旺细胞及少突细胞分泌,且其分泌能力随年龄增长逐渐降低,故其在成人颅脑中极少表达[14]。NSE为特异性蛋白,分泌于神经细胞,是神经细胞损伤的重要标志物[15]。GFAP是构成星形胶质细胞骨架的丝状蛋白,对星形胶质细胞形态及功能的维持具有的重要作用。GFAP特异性存在于脑组织中,极少存在于外周血中[16]。患者发生STBI后,血脑屏障会受到严重的损害,髓鞘、神经元、星形胶质细胞崩解,MBP、NSE、、GFAP被大量释放进入血液循环。资料显示,血清MBP、NSE、GFAP水平升高是脑细胞功能损伤的重要反映,且其水平与脑细胞功能损伤程度正相关。本研究治疗后,TTM组血清MBP、NSE、GFAP水平均低于对照组,说明TTM有助于保护STBI患者脑组织,对于维持脑细胞功能具有重要作用。
吞咽功能失常是STBI患者神经功能低下的重要表现之一[17]。吞咽功能失常导致患者无法正常进食,进而导致其营养不良,影响患者康复[18]。本研究治疗后,TTM组SAA评分小于对照组,说明STBI患者接受TTM治疗后可改善其吞咽功能。神经功能重建是改善STBI患者预后的重要因素[19]。NGF可营养神经细胞,诱导神经细胞增殖,促进神经修复。NGF可经与神经细胞膜上相关受体相结合,激活细胞膜酶,缓解神经水肿[20]。BDNF可促进神经细胞分裂、分化并提高其活性。BDNF可经激活神经祖细胞及调节天冬氨酸蛋白水解酶-3,促进神经功能修复。缺血缺氧状态下,BDNF可经代偿性增生保护神经细胞,避免其损伤[21]。本研究治疗后,两组血清NGF、BDNF水平,TTM组均高于对照组,说明TTM可提高神经功能重建介质水平。
总之,TTM可降低STBI患者ICP,维持其脑细胞功能、吞咽功能,促进分泌神经功能重建介质,诱导患者神经功能重建。

