DWI和动态对比增强MRI多参数鉴别腮腺Warthin瘤与多形性腺瘤
胡涛,方学文*,刘琼,邹玉坚,姚兆友,高云,张坤林
作者单位:1.广东省东莞市人民医院放射科,东莞 523000;2.广东省东莞市人民医院亚健康管理中心,东莞 523000;3.广东省东莞市人民医院口腔颌面外科,东莞 523000
Warthin 瘤(又称腺淋巴瘤)和多形性腺瘤(pleomorphic adenoma,PA)是腮腺最常见的两种良性肿瘤,分别占腮腺良性肿瘤的80%和10%[1],但二者在生物学行为、临床手术方案及预后上不尽相同,PA 术后复发率及恶变率高于Warthin 瘤[2],因此术前准确诊断尤为重要。临床表现、CT、MRI 常规表现鉴别二者有时会有一定困难。笔者探讨扩散加权成像(diffusion weighted imaging,DWI)、动态对比增强磁共振成像(dynamic contrast-enhanced magnetic resonance imaging,DCE-MRI)多参数对二者的鉴别价值,旨在提高对Warthin瘤与PA的鉴别诊断水平。
1 材料与方法
1.1 一般资料
回顾性分析我院2018 年2 月至2020 年12 月收集的经病理证实的腮腺Warthin 瘤及PA 患者。入组标准:成功行常规MRI 检查,并有DCE-MRI 和或DWI;图像无明显伪影,满足诊断要求;肿块直径>1 cm。排除标准:图像有明显金属伪影或头动伪影,影响腮腺肿块评估。入组的24 例Warthin 瘤中男24 例,女0 例,年龄(61.0±9.3)岁;其中18 例单发病灶,4 例2 个病灶,2 例3 个病灶,共32 个病灶;32 个病灶中浅叶13 个,深叶1 个,跨深浅叶18 个;右侧14 个,左侧18 个;肿块最大截面面积(5.0±4.2) cm2。入组的24 例PA 中男性8 例,女性16 例,年龄(36.5±8.9)岁,发生在浅叶16 例,深叶0 例,跨深浅叶8 例;右侧11 例,左侧13 例;最大截面 面积(3.9±2.1) cm2。48个病例临床多表现为耳后无痛性肿块,病程1周至20 年。本研究经过本单位医学伦理委员会批准(批准文号:KYKT2021-002),免除受试者知情同意。
1.2 检查方法
MRI 检查采用西门子3.0 T Skyra MR 扫描仪及20 通道相控阵头颈联合线圈。48 例患者依次行MRI平扫、DWI、DCE-MRI 及常规增强MRI 轴位、冠状位、矢状位,其中2 例患者DCE-MRI 因患者头动较明显,DCE-MRI 图像不符合入组标准被剔除,但DWI 图像满足入组要求继续入组。
常规MRI 扫描参数:轴位T1WI (TR 400 ms,TE 10 ms,矩阵384×288,FOV 22 cm×22 cm,扫描时间1 min 48 s)、轴位T2WI (TR 5000 ms,TE 90 ms,矩阵512×384,FOV 22 cm×22 cm,扫描时间2 min 35 s)、冠状位STIR (TR 3700 ms,TE 80 ms,矩阵320×256,FOV 26 cm×26 cm,扫描时间2 min 30 s),层厚3 mm,间距0.3 mm;在完成动态增强后行常规增强轴位(参数与轴位平扫一致)、冠状位(TR 400 ms,TE 10 ms,矩阵320×320,FOV 26 cm×26 cm,层厚3 mm,间距0.3 mm,扫描时间1 min 37 s)、矢状位(TR 400 ms,TE 10 ms,矩阵320×320,FOV 24 cm×24 cm,层厚3 mm,间距0.3 mm,扫描时间1 min 31 s)。对比剂应用马根维显,0.1 mmol/kg,经肘正中静脉注入,流率3 mL/s,注射完对比剂后生理盐水15 mL冲管。
DWI 扫描参数:采用西门子多b 值高清弥散序列(resolve-diff)扫描,TR 3050 ms,TE 59 ms,层厚3.0 mm,层间距0.3 mm,矩阵186×150,FOV 25 cm×16.7 cm,最后仅取b 值0、800 s/mm2计算平均ADC 图,总采集时间5 min 22 s。
DCE-MRI 扫描参数:采用西门子的t1-fl3D dynaviews-spair 序列,TR 4.3 ms,TE 1.5 ms,NEX 1 次,矩阵224×190,轴位扫描,层厚3 mm,层间距0.3 mm,FOV 25 cm×16.7 cm,共采集24 个时相,预扫描2~3期,每一个时相扫描时间为9 s,总扫描时间约为3 min 33 s。
1.3 图像分析及后处理
常规图像观察肿块部位、测量最大截面积。选择每个肿块最大截面,测量最大横径和纵径,计算最大截面面积。DWI 及DCE-MRI 图像传至工作站(Simens syngo MR E11)后处理,获得ADC图。参考平扫及增强图像,选取肿块实性区域,避开坏死囊变区,在ADC图上手动勾画ROI,ROI大小约30~50 mm2,测量3次取平均ADC值。DCE-MRI用同样方法选择ROI,记录T1初始信号强度值(previous signal intensity,SIpre)、增强后最大信号强度值(maximum signal intensity,SImax)、增强期末信号强度值(signal intensity of the end of enhancement,SIend)、达峰时间(time to peak,TTP),自动绘制时间信号强度曲线(time intensity curve,TIC)并计算廓清率(wash-out ratio,WR)。WR=(SImax-SIend)/(SImax-SIpre)×100。TIC 形态可分四个类型:Ⅰ型,即持续上升型(TTP>120 s);Ⅱ型,即速升速降型(TTP≤120 s,WR 值≥30%);Ⅲ型,速升缓降型(TTP≤120 s,WR值<30%);Ⅳ型,平坦型,无强化。
1.4 统计分析
所有数据应用SPSS 22.0 统计软件进行处理。Warthin瘤与PA比较时,侧别比较采用χ2检验,性别、TTP、TIC 类型、分布位置采用Fisher 精确概率法,年龄、肿块最大截面面积、ADC 值、SIpre、SImax、SIend、WR 采用两独立样本t检验。ADC 值、TIC 类型及采用二元Logistic回归将二者线性拟合形成的联合指标的鉴别诊断效能采用ROC曲线分析,根据约登指数选取阈值,计算鉴别诊断的敏感度、特异度及AUC。P<0.05认为差异有统计学意义。
2 结果
2.1 一般资料
Warthin 瘤与PA 的发病年龄差异有统计学意义(t=9.33,P<0.05,表1),Warthin 瘤发病年龄更大。Warthin 瘤与PA 的性别差异有统计学意义,Warthin瘤男性更多见(P<0.05,表1)。肿块最大截面面积、侧别及分布位置差异无统计学意义(P>0.05,表1;图1,2)。
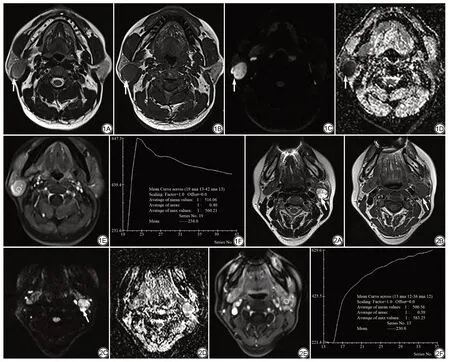
图1 男,49 岁,右侧腮腺浅叶Warthin 瘤。轴位T2WI(A)、轴位T1WI(B)、轴位DWI(C)示病变呈明显高信号。D:轴位ADC 图,病变呈明显低信号,ADC 值=0.377×10-3 mm2/s;E:动态增强图像上选取ROI;F:肿瘤的TIC 曲线呈速升速降型(Ⅱ型) 图2 女,45 岁,左侧腮腺跨深浅叶多形性腺瘤。轴位T2WI(A)、轴位T1WI(B)、轴位DWI(C)示呈高信号。D:轴位ADC 图,病变呈高信号,ADC 值=1.581×10-3 mm2/s;E:动态增强图像上选取ROI;F:肿瘤的TIC 曲线呈持续上升型(I型)
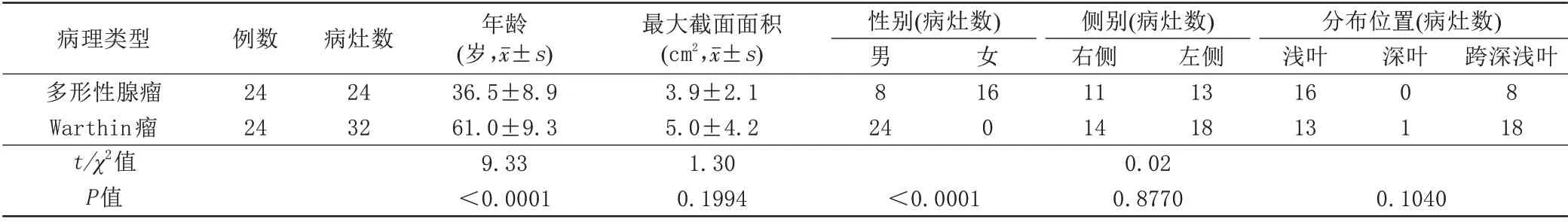
表1 Warthin瘤与多形性腺瘤的发病年龄、肿块最大截面面积、性别、侧别、肿块分布位置比较
2.2 DWI资料
Warthin 瘤与PA 的ADC 值差异有统计学意义,前者ADC 值更低(t=-4.996,P值<0.05,表2;图1D,图2D)。
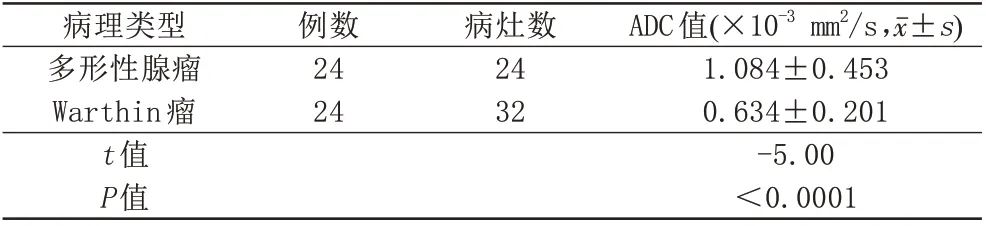
表2 Warthin瘤与多形性腺瘤ADC值的比较
2.3 DCE-MRI资料
Warthin瘤与PA在SIpre、WR、TTP、TIC的差异有统计学意义,Warthin瘤的SIpre、WR高于PA,Warthin瘤的TTP显著小于PA,Warthin瘤TIC以Ⅱ、Ⅲ型为主,更多为Ⅱ型,多形性腺瘤TIC 以Ⅰ型为主(P<0.05,表3;图1F,图2F);二者在SImax及SIend的差异无统计学意义(P>0.05,表3)。
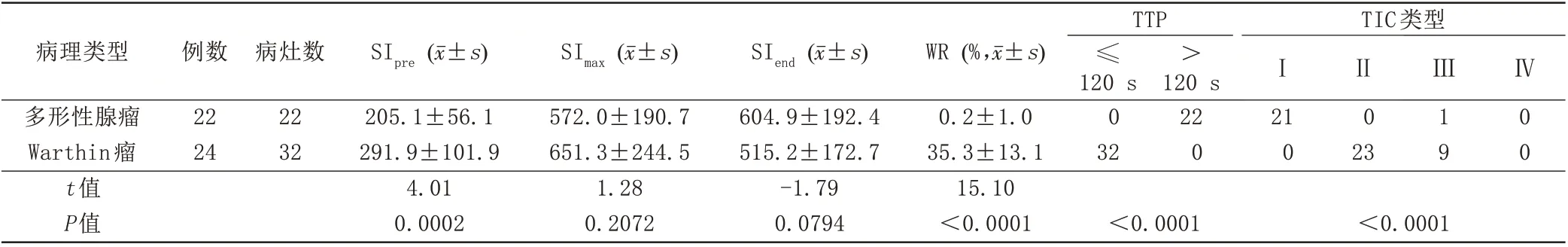
表3 Warthin瘤与多形性腺瘤动态增强各参数的比较
2.4 DWI、DCE-MRI参数鉴别诊断Warthin瘤与多形性腺瘤的效能
ROC曲线分析显示ADC值区分Warthin瘤与PA的AUC 为0.845,95%置信区间为0.718~0.972,以ADC值的阈值为0.811×10-3mm2/s
诊断为Warthin 瘤,ADC 鉴别诊断的敏感度为83.3%,特异度为90.63%;TIC 类型区分Warthin 瘤与PA 的AUC 为0.961,95%置信区间为0.886~1.000,其敏感度为95.45%,特异度为100%。以ADC 值<0.811×10-3mm2/s,Ⅱ或Ⅲ型TIC诊断为Warthin 瘤,ADC 与TIC 类型联合区分Warthin 瘤与PA 的AUC 为0.984,95% 置 信 区间 为0.949~1.000,敏 感度为100%,特异度为96.88% (图3)。
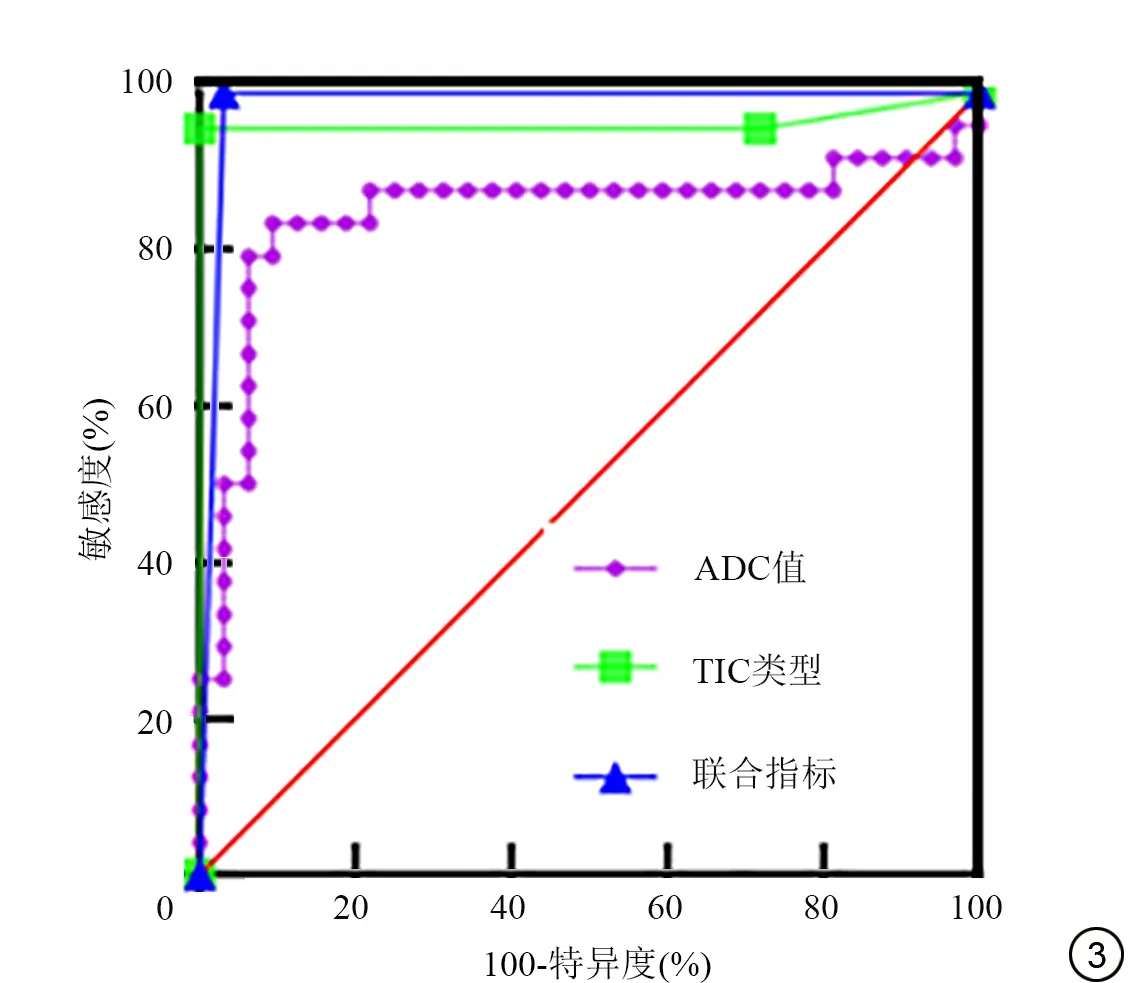
图3 ADC 值、TIC 类型及二者联合鉴别诊断Warthin 瘤与多形性腺瘤的ROC 曲线。ADC 值:AUC=0.845,P<0.05;TIC 类型:AUC=0.9609,P<0.05;联合指标:AUC=0.9844,P<0.05
3 讨论
磁共振多参数对腮腺肿瘤良恶性的鉴别诊断的研究较多[3-5],对Warthin 瘤与PA 的鉴别诊断研究相对较少[6]。Warthin 瘤和PA 是腮腺最常见的良性肿瘤,多参数的联合应用对于二者鉴别有一定价值[7]。本研究结果显示,Warthin 瘤发病年龄偏大,多为中老年人,PA 年龄跨度大,年轻人为主,这与文献报道一致[8]。本研究中,Warthin瘤以男性更常见,PA以女性更多见,与文献报道一致[9-10],也有学者发现PA 中男女差异无统计学意义,而Warthin 中男性多于女性[7]。
DWI 成像后可以获得ADC 值,ADC 值可以反映细胞内外水分子运动受限的情况,值的大小间接反映肿瘤组织的细胞密度及核浆比例,细胞密度大、核浆比例高的组织中,水分子运动受限,ADC 值较低,反之则ADC 值较高。Warthin 瘤因为由上皮细胞、滤泡样淋巴组织及蛋白囊腔组成,水分子扩散明星受限,ADC值较低,而PA细胞核浆比小,间质丰富,且囊变较多,水分子扩散受限轻微,故ADC 值较高[11]。本研究结果显示Warthin 瘤ADC 值明显低于PA,与文献报道一致[12-13],ADC值可以帮助鉴别Warthin瘤与PA[14]。
动态增强MRI 能获得多参数,如SIpre、SImax、SIend、WR、TTP、TIC 等,可以反映肿瘤组织的微血管分布、血流灌注、血管通透性等特性,能对肿瘤的血流动力学进行半定量分析。SIpre反映肿瘤T1WI 时的初始信号强度,SImax反映增强后的最大信号强度值,SIend反映扫描终末时的信号强度。WR 反映肿瘤细胞与间质比例,细胞与间质比例越小,细胞外间隙相对越大,保留对比剂时间越长,WR 值越小,相反则WR 值越大。TTP 反映肿瘤的微血管密度,肿瘤的微血管密度越小,TTP 值越大,相反则TTP 越小[15]。TIC 曲线能直观、准确地反映肿瘤的动态强化特征,是反映肿瘤血供情况的最佳指标之一。本研究结果显示,Warthin 瘤T1 初始信号强度值要高于PA,这可能同Warthin 瘤富有腺管样囊腔结构、腔内富含黏蛋白及胆固醇堆积等,导致T1 信号较高有关[16-17],而PA 具有丰富的黏液样基质成分,富含自由水,具有较长的T1 信号[18]。PA 的TTP 大,WR 小,TIC 曲线类型主要为Ⅰ型,Warthin 瘤TTP 小、WR 大,TIC 曲线类型主要为Ⅱ、Ⅲ型,以Ⅱ型更多,与文献报道相仿[19-20]。这是因为PA 血管密度低,细胞-间质比例小,细胞外间隙相对大,对比剂进入慢,保留时间长,而Warthin瘤具有较高的血管密度、高细胞-间质比例,细胞外间隙相对小,对比剂进入快,保留时间短。多参数联合应用,有助于提高腮腺肿瘤的诊断效能[21-22]。本研究结果显示,ADC 值区分Warthin 瘤与PA 的AUC 为0.845,95%置信区间为0.718~0.972,以ADC 值=0.811×10-3mm2/s 为诊断阈值,小于该阈值诊断为Warthin瘤的敏感度83.3%,特异度为90.63%;TIC 类型区分Warthin 瘤 与PA 的AUC 为0.961,95% 置 信 区 间 为0.886~1.000,Ⅱ或Ⅲ型TIC 诊断Warthin 瘤的敏感度为95.45%,特异度达100%;联合ADC 值与TIC 类型鉴别Warthin 瘤与PA 曲线下面积为0.984,95%置信区间为0.949~1.000,其敏感度达100%,特异度达96.88%。从AUC 95%置信区间来看,TIC 与ADC、联合预测指标与ADC、联合预测指标与TIC 的鉴别诊断效能差异均没有统计学意义,但在数值上鉴别诊断效能确实表现为:联合预测指标>TIC>ADC。这表明多参数及联合应用,能高效鉴别Warthin 瘤与PA,与文献报道相仿[11,23]。
本研究存在的不足:(1)研究时间相对较短,样本量相对偏小,可能会影响Warthin 瘤与PA 鉴别特征的归纳、统计分析;(2) DCE-MRI 采用半定量分析,不够定量分析准确。
总之,Warthin 瘤与PA 在发病年龄、性别、ADC值、SIpre、WR、TTP、TIC曲线类型之间有所不同,当常规影像鉴别二者困难时,磁共振多参数联合应用对于鉴别二者有很重要价值。
作者利益冲突声明:全体作者均声明无利益冲突。

