不同年龄结节性甲状腺肿合并甲状腺癌患者甲状腺超声特征对比分析
何华新
(桂平市人民医院超声科 广西 桂平 537200)
结节性甲状腺肿作为临床常见的癌前病变,其患病率已达到4%~10%左右;而甲状腺癌属于恶性肿瘤,主要发生在患者甲状腺上皮细胞,其发生机制与结节性甲状腺肿的不断发展或者恶化存在密切相关性[1-2]。曾有研究[3]表明,结节性甲状腺肿癌变的原因较多,年龄是一关键因素,其年龄越小,结节性甲状腺肿合并甲状腺癌的风险越大,因此加强对青年者的甲状腺筛查具有重要意义。临床多选择甲状腺超声进行检查,若能够完全掌握不同年龄患者的甲状腺超声特征,可尽早提供针对性干预,为预后提供保障[4-5]。本文选取我院2017年6月—2020年2月收治的85例结节性甲状腺肿合并甲状腺癌患者进行分组验证,现报道如下。
1 资料与方法
1.1 一般资料
将我院2017年6月—2020年2月纳入的85例结节性甲状腺肿合并甲状腺癌患者按年龄差异进行分组。A组男18例,女12例,年龄24~39岁,平均(30.55±1.24)岁,滤泡细胞癌14例,乳头状癌11例,鳞癌5例;B组男14例,女11例,年龄40~57岁,平均(51.26±1.10)岁,滤泡细胞癌10例,乳头状癌8例,鳞癌7例;C组男17例,女13例,年龄61~80岁,平均(72.34±1.33)岁,滤泡细胞癌12例,乳头状癌9例,鳞癌9例。除了年龄之外,三组基本资料相比无差异(P>0.05)。
纳入标准:(1)患者与家属签订知情书;(2)符合疾病诊断标准;(3)病历资料完整,均在我院接受甲状腺超声检查。
排除标准:(1)存在脑外伤、颅内肿瘤、全身免疫性疾病或者其他神经系统疾病者;(2)存在精神类疾病或者听力障碍者。
1.2 方法
三组均选择甲状腺超声检查,仪器是彩色超声诊断仪(Philips HDI 5 000),先后执行二维超声与彩色多普勒超声,调整探头频率6 MHz~13 MHz线阵探头,对患者病灶回声、钙化与病灶中血流分布情况进行仔细观察。
1.3 观察指标
记录三组病灶回声、钙化、血流结果,测定RI(阻力指数)、SPV(平均收缩期流速)指标。
血流分型[6]:病灶内与周围无血流信号为Ⅰ型;病灶内无血流,周围血流丰富为Ⅱ型;病灶内与周围血流信号丰富为Ⅲ型。
1.4 统计学方法
2 结果
2.1 三组病灶回声的对比
A组在高回声、低回声、无回声、混合回声上与B组、C组相比差异显著(P<0.05),见表1。

表1 三组病灶回声的对比[n(%)]
2.2 三组病灶钙化情况的对比
A组在粗钙化、微小钙化、无钙化上与B组、C组相比差异显著(P<0.05),见表2。
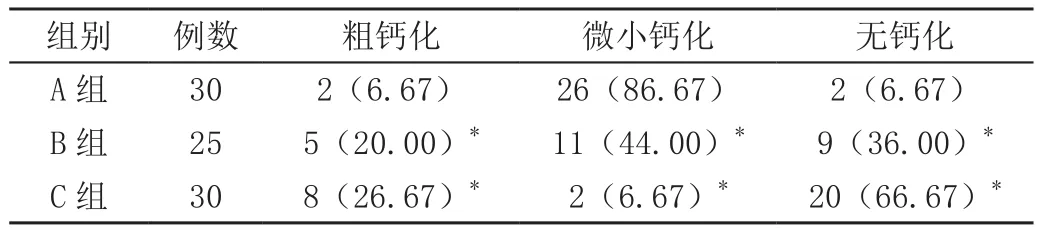
表2 三组病灶钙化情况的对比[n(%)]
2.3 三组血流情况的对比
A组在Ⅰ型血流、Ⅱ型、Ⅲ型上与B组、C组相比差异显著(P<0.05),见表3。
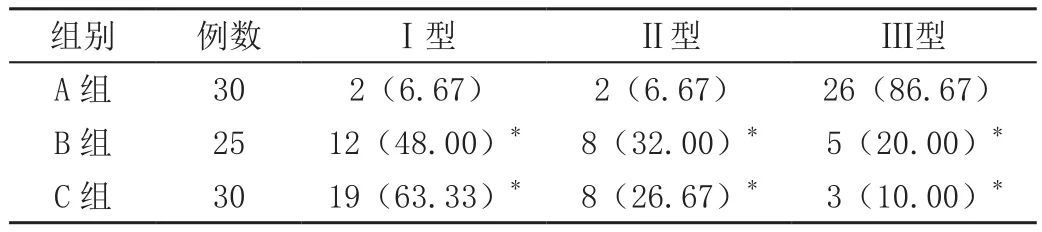
表3 三组血流情况的对比[n(%)]
2.4 三组RI、SPV指标的比较
A组的RI、SPV指标均高出B、C组(P<0.05),见表4。
表4 三组RI、SPV指标的比较()

表4 三组RI、SPV指标的比较()
注:*为与A组进行比较,P<0.05。
组别 例数 RI/% SPV/(cm·s-1)A组 30 0.98±0.22 33.02±4.12 B组 25 0.76±0.15* 24.76±3.90*C组 30 0.63±0.11* 19.31±3.56*
3 讨论
结节性甲状腺肿属于甲状腺癌的风险因素之一,除了激素、放射性物质、遗传、碘摄入量等因素之外,年龄是影响结节性甲状腺肿癌变的关键[7]。随年龄不断增长,甲状腺激素水平呈降低趋势,同时可造成垂体甲状腺激素分泌增加,最终使甲状腺反复性增生,引发结节样变,加上上皮细胞的过度增生,导致甲状腺癌[8-9]。
目前临床多选择甲状腺超声进行结节性甲状腺肿诊断,但合并甲状腺癌后,极易因为病灶较小或者处于结节内部时造成漏诊或者误诊现象,因此完全掌握结节性甲状腺肿合并甲状腺癌的超声特征具有重要意义[10-11]。本文结果中三组在回声、钙化、病灶血流分型上相比差异显著(P<0.05);A组的RI、SPV指标均显著高于B、C组(P<0.05),其中青年患者的超声特征以病灶低回声、微小钙化、血流信号丰富为主。与正常甲状腺相比,甲状腺癌细胞的体积更大且间质少,因此利用超声检查时,其中超声波极易穿过,并造成反射弱,进而出现低回声,这种方法成为判断甲状腺恶性疾病的主要方式之一[12]。另外微钙化率在癌变特异性表现中具有重要意义,并与局灶性梗死、肿瘤增生、钙盐堆积存在一定关联,在临床诊断良恶性病灶中运用极为广泛[13]。最后血管内皮因子不断释放后,恶性肿瘤可促进其内部血管增生,以此来得到充足的养分供应,因此甲状腺癌以血流信号丰富为主[14-15]。另外随着年龄的不断增加,RI、SPV指标呈现降低趋势,Ⅲ型血流患者的肿瘤组织内部新生血管的管壁较为薄弱,且弹性较低,加上形状不规则,可能增加血管阻力,甚至提升血流阻力以及平均收缩期流速,与本文结果一致,证实超声检查的价值,尤其在诊断不同年龄患者中效果突出,为临床制定针对性治疗提供指导意义。
综上所述,各年龄段结节性甲状腺肿合并甲状腺癌患者的甲状腺超声特征存在较大差异,应受到重点关注。

