辣椒秸秆生物质炭对喀斯特石灰土有机碳矿化的影响
熊佰炼 黄俊 申杰


摘要:【目的】探索短時间尺度下辣椒秸秆生物质炭添加对喀斯特石灰土地区土壤有机碳(SOC)矿化和SOC库的直接影响,为评估西南喀斯特石灰土地区辣椒秸秆生物质炭还田利用的生态环境效应提供科学依据。【方法】采用广口瓶进行恒温、恒湿密封培养试验,以不添加生物质炭为对照(CK),设置0.1%、0.5%、1.0%、2.0%和4.0%共5个辣椒秸秆生物质炭添加处理,用NaOH溶液吸收法测定63 d培养期内喀斯特石灰土有机质矿化过程释放的CO2,培养结束后测试各形态SOC含量的变化情况。【结果】培养63 d后,0~4.0%添加处理石灰土SOC累积矿化量为473.05±78.60~673.74±102.66 mg C/kg,4.0%添加处理可明显提高累积矿化量。各添加处理SOC矿化过程均可用双库一级动力学模型进行拟合,0.1%~0.5%和1.0%~4.0%添加处理条件下易降解SOC矿化速率常数(ka)分别为0.021±0.001~0.034±0.004/d和0.248±0.021~0.343±0.033/d,对易降解SOC的矿化分别起抑制和促进作用;所有添加处理对难降解SOC矿化起促进作用。1.0%~4.0%添加处理可显著提高易降解SOC库储量(Ca)和土壤微生物量碳(MBC)含量(P<0.05,下同),其值范围分别为238.19±20.72~937.48±71.75 mg/kg和368.22±12.19~449.52±18.91 g/kg。2.0%和4.0%添加处理显著提高土壤易氧化有机碳(ROC)含量,其值分别为2849.97±184.21和3163.92±107.16 mg/kg。生物质炭添加对土壤水溶性有机碳(WSOC)含量无显著影响(P>0.05,下同)。添加辣椒秸秆生物质炭的处理中,MBC与Ca、ka、难降解SOC矿化速率常数(ks)和ROC呈极显著正相关(P<0.01,下同),与难降解SOC库储量(Cs)呈极显著负相关,与WSOC无显著相关性。【结论】辣椒秸秆生物质炭对喀斯特石灰土SOC矿化速率的影响与添加量有关,1.0%~4.0%添加处理可提高矿化速率,同时增加Ca、MBC和ROC含量,但对WSOC含量无影响,4.0%添加处理在63 d培养期内可提高土壤累积矿化量。为减少土壤碳排放,建议辣椒秸秆生物质炭改良西南喀斯特石灰土的添加量应低于4.0%。
关键词: 辣椒秸秆生物质炭;喀斯特;石灰土;有机碳库;有机碳矿化
中图分类号: S153.61 文献标志码: A 文章编号:2095-1191(2021)03-0743-10
Effects of pepper straw biochar on karst limestone soil
organic carbon mineralization
XIONG Bai-lian1,2, HUANG Jun1, SHEN Jie1
(1College of Resources and Environment,Zunyi Normal University, Zunyi, Guizhou 563006, China; 2Key Laboratory of Soil Resources and Environment in Qianbei of Guizhou Province, Zunyi, Guizhou 563006, China)
Abstract:【Objective】To explore the direct effect of pepper straw biochar addition on soil organic carbon(SOC) mi-neralization and organic carbon pool in limestone soil in karst areas on a short-term time scale,and provide a scientific basis for evaluation of the ecological environmental effect of pepper straw biochar returned to cropland in limestone soil in karst areas in southwestern China. 【Method】Conducted the sealed incubation experiment in a jar at constant temperature and humidity, no biochar treatment was as control(CK),set 5 levels of pepper straw biochar addition,0.1%,0.5%,1.0%,2.0% and 4.0%, measured the CO2 release during mineralization of SOC within the incubation period of 63 d with the method of NaOH solution absorption,and tested the change of SOC of various forms at the end of incubation. 【Result】After 63 d of incubation,the cumulative amount of mineralization of SOC in limestone soil with 0-4.0 % additives was 473.05±78.60-673.74±102.66 mg C/kg; 4.0% addition could increase the cumulative amount of mineralization. At different levels of addition,SOC mineralization could be fitted by the two-compartment first order kinetic model. Under 0.1%-0.5% and 1.0%-4.0% treatments,easily biodegradable SOC mineralization rate constant (ka) was 0.021±0.001-0.034±0.004/d and 0.248±0.021-0.343±0.033/d,the effect on mineralization of easily biodegradable SOC was suppressing and facilitating,respectively. All addition levels could promote mineralization of hard-to-degrade SOC. The addition level of 1.0%-4.0% could significantly increase reserves of labile SOC(Ca) and microbial biomass carbon(MBC) content in the soil(P<0.05, the same below),the scope ranges were 238.19±20.72-937.48±71.75 mg/kg and 368.22±12.19-449.52±18.91 g/kg respectively. The addition levels of 2.0% and 4.0% significantly increased the content of readily oxidized carbon (ROC) in soil,the value being 2849.97±184.21 and 3163.92±107.16 mg/kg respectively. Biochar addition had no significant effect on water soluble organic carbon(WSOC) in soil(P>0.05, the same below). According to the process of pepper straw biochar addition,MBC was of extremely significantly positive correlation with Ca,ka,constant of the mineralization rate of recalcitrant SOC(ks) and ROC(P<0.01, the same below),of extremely significantly negative correlation with reserves of recalcitrant SOC(Cs),and no significant correlation to WSOC. 【Conclusion】The effect of pepper straw biochar on the minerali-zation rate of limestone soil in karst areas is related to the level of addition; 1.0%-4.0% addition can enhance the SOC mineralization rate while increase Ca and the content of MBC and ROC,but has no effect on WSOC content. The addition level of 4.0% can increase the cumulative emissions of mineralization during the incubation period of 63 d. To reduce soil carbon emissions,it is recommend the level of pepper straw biochar addition should be lower than 4.0% in improving limestone soil in karst areas in southwestern China.
Key words: pepper straw biochar; karst; limestone soil; soil organic carbon pool; organic carbon mineralization
Foundation item: Project of Department of Science and Technology of Guizhou(QKHPTRC〔2017〕5727-12);Pro-ject of Key Laboratory of Soil Resources and Environmental Characteristics in Northern Guizhou of Guizhou Department of Education(Qianjiaohe KY〔2017〕010)
0 引言
【研究意义】土壤有机碳(SOC)库是陆地生态系统最大的碳库,SOC矿化是SOC周转的重要过程和土壤温室气体排放的主要来源(Lal,2004)。生物质炭是由农作物秸秆、畜禽粪便等材料在250~750 ℃限氧条件下发生热裂解生成,能改善土壤结构,提高保水保肥能力,促进作物生长(黄雁飞等,2020;涂保华等,2020)。由于在土壤中极难降解,生物质炭还田可将植物光合作用获得的约20%碳封存在土壤中,是一条有效的碳汇途径(Lehmann,2007)。石灰土是一种发育于碳酸盐岩母质,广泛分布于我国热带、亚热带喀斯特山区的非地带性土壤,有机质含量相对较高(郑永春和王世杰,2002)。贵州省石灰土分布面积为278.56万ha,是种植辣椒的主要土壤类型之一,将辣椒秸秆生物质炭还施于石灰土是绿色环保利用辣椒秸秆的重要备选途径。研究表明,生物质炭对SOC的矿化分解有激发和抑制作用,从而增加或减少土壤碳排放量并影响土壤肥力,不同类型生物质炭施入不同类型土壤的碳矿化效应尚无法预测(葛晓改等,2016)。探明辣椒秸秆生物质炭对喀斯特石灰土SOC矿化和土壤碳库结构的影响是科学利用其改良石灰土的重要前提,也可为定量评估该类生物质炭输入喀斯特石灰土后的碳汇效应提供科学依据。【前人研究进展】生物质炭随前体材料类型、土壤类型和进入土壤时长等因素的不同,对SOC的矿化降解起激发或抑制作用。玉米、黑麦秸秆、柞木和芒草等制成的生物质炭可促进微生物生长,加速SOC降解,增加土壤碳排放(Hamer et al.,2004;Wardle et al.,2008;Luo et al.,2011)。混合木屑生物质炭添加到粉砂壤土中、玉米芯生物质炭添加到碱性土壤中则降低土壤微生物群落活性和土壤微生物量碳(MBC)含量,从而抑制SOC降解矿化,降低土壤碳排放(Spokas et al.,2009;Riaz et al.,2017)。而桉树生物质炭对粘性土壤和砂质壤土中SOC的矿化作用分别起抑制和促进作用(Fang et al.,2015)。生物质炭的输入会影响SOC的组成和转化。柳桉生物质炭施入可增加大田难降解SOC储量(Kimetu and Lehmann,2010),混合秸秆生物质炭则增加大田易降解SOC储量(Liu et al.,2015)。胡桃壳生物质炭和水稻秸秆生物质炭能促进SOC向活性SOC的转化,提高土壤水溶性有机碳(WSOC)和MBC含量(Wang et al.,2016;Yang et al.,2020)。刘燕萍等(2011)发现水稻秸秆生物质炭在培养前期(0~7 d)促进SOC的降解矿化,后期(7~112 d)则抑制。总的来看,生物质炭输入会影响土壤中有机质组成与矿化行为,从而改变土壤的碳排放。【本研究切入点】尽管生物质炭对SOC矿化的影响已有大量研究,但由于影响因素复杂且尚未完全掌握相关机理,目前有关辣椒秸秆生物质炭还田利用对土壤环境影响的研究也较少,其对石灰土SOC矿化降解和SOC库的影响尚不清楚。【拟解决的关键问题】通过恒温、恒湿密封培养,探索短时间尺度(63 d)、无其他碳源条件下,不同辣椒秸秆生物质炭添加量处理对石灰土SOC矿化和SOC库的影响,以期为评估西南喀斯特石灰土地区辣椒秸秆生物质炭还田利用的生态环境效应提供科学依据。
1 材料与方法
1. 1 试验材料
选择贵州省遵义市红花岗区新蒲镇弃耕的石灰土荒草坡地为采样地,采用棋盘式法确定采样点,去除杂草和凋落物后,挖取表层0~20 cm土层土样。将各样点采集的土样混合,四分法取足所需土壤样品。剔除土壤中植物残体,捡出石块、落叶和根等杂物,风干,过2 mm土壤筛。土壤基本理化性质见表1。
供试辣椒秸秆品种为遵辣9号,将其洗净风干,破碎,用锡箔纸密封包裹,放入坩锅,在马弗炉内以20 ℃/min的速度加热升温至550 ℃并保持45 min,自然冷却后取出,过2 mm筛,密封备用。辣椒秸秆生物质炭的性质与主要成分:pH 9.79,灰分21%,总碳(TC)786.84 g/kg,总氮(TN)16.57 g/kg,总磷(TP)1.12 g/kg,总钾(TK)0.85 g/kg。
1. 2 試验方法
采用室内恒温、恒湿培养,碱液吸收法测定SOC矿化与CO2排放:称取100 g供试土样置于1 L广口瓶中,添加0(CK)、0.1%(T1)、0.5%(T2)、1.0%(T3)、2.0%(T4)和4.0%(T5)的生物质炭,混匀,调节含水量至田间饱和持水量的60%;用小烧杯盛20 mL 1 mo1/L NaOH溶液,放入横置的广口瓶中吸收土壤呼吸释放的CO2;在广口瓶中放置10 mL去CO2水,以维持瓶内空气饱和湿度,橡皮塞密封广口瓶,25 ℃生化培养箱中恒温黑暗培养。每处理设3次重复。在培养的第3、7、12、18、25、33、42、52和63 d取出广口瓶中NaOH溶液,经稀释处理后测定土壤释放的CO2,并换上新配制的NaOH溶液,继续培养。设置不加土壤和生物质炭的空白对照组,用于扣除碱液对空气中CO2的吸收。
1. 3 测定项目及方法
将从广口瓶中取出的NaOH溶液稀释后用总碳分析仪(岛津TOC-LCPH)测定分析碳含量。培养结束后,取适量土壤,分析测试各形态SOC含量。SOC用重铬酸钾外加热法测定;WSOC用0.5 mol/L K2SO4浸提(水土质量比5∶1),用TOC分析仪测定(王战磊等,2014);MBC采用氯仿熏蒸浸提法测定,以熏蒸和未熏蒸土样含碳量之差除以系数0.45得到(吴金水等,2006);易氧化有机碳(ROC)采用高锰酸钾氧化法测定(赵世翔等,2017)。
1. 4 计算公式
日均矿化速率[mg C/(kg·d)]以单位质量土壤(1 kg)单位时间(1 d)内矿化释放的碳量表示;累积矿化量(mg C/kg)以单位质量土壤(1 kg)在63 d培养期内矿化释放的总碳量表示。土壤微生物商(Soil microbial quotient)=MBC/SOC,碳库活度(Lability of carbon,L)=ROC/(SOC-ROC)(Blair et al.,1995)。
运用双库一级动力学方程对土壤易降解碳库和难降解碳库大小进行拟合(Ci et al.,2015):
Ct=Ca×(1-e-kat)+(CSOC-Ca)×(1-e-kst)
式中,Ct为培养t时的累积矿化量(mg/kg),Ca和ka分别为易降解SOC库储量(mg/kg)及其矿化速率常数(/d),CSOC为SOC含量,Cs(Cs=CSOC-Ca)和ks分别为难降解SOC库储量(mg/kg)及其矿化速率常数(/d),t为培养时间(d)。生物质炭输入后SOC的半衰期(T1/2)由难降解SOC库的降解速率ks通过公式计算得出:T1/2=ln2/ks。
1. 5 统计分析
采用SPSS 19.0对试验数据进行单因素方差分析(One-way ANOVA)、Pearson相关分析和显著性分析,以Origin 8.5绘图。
2 结果与分析
2. 1 SOC矿化特征
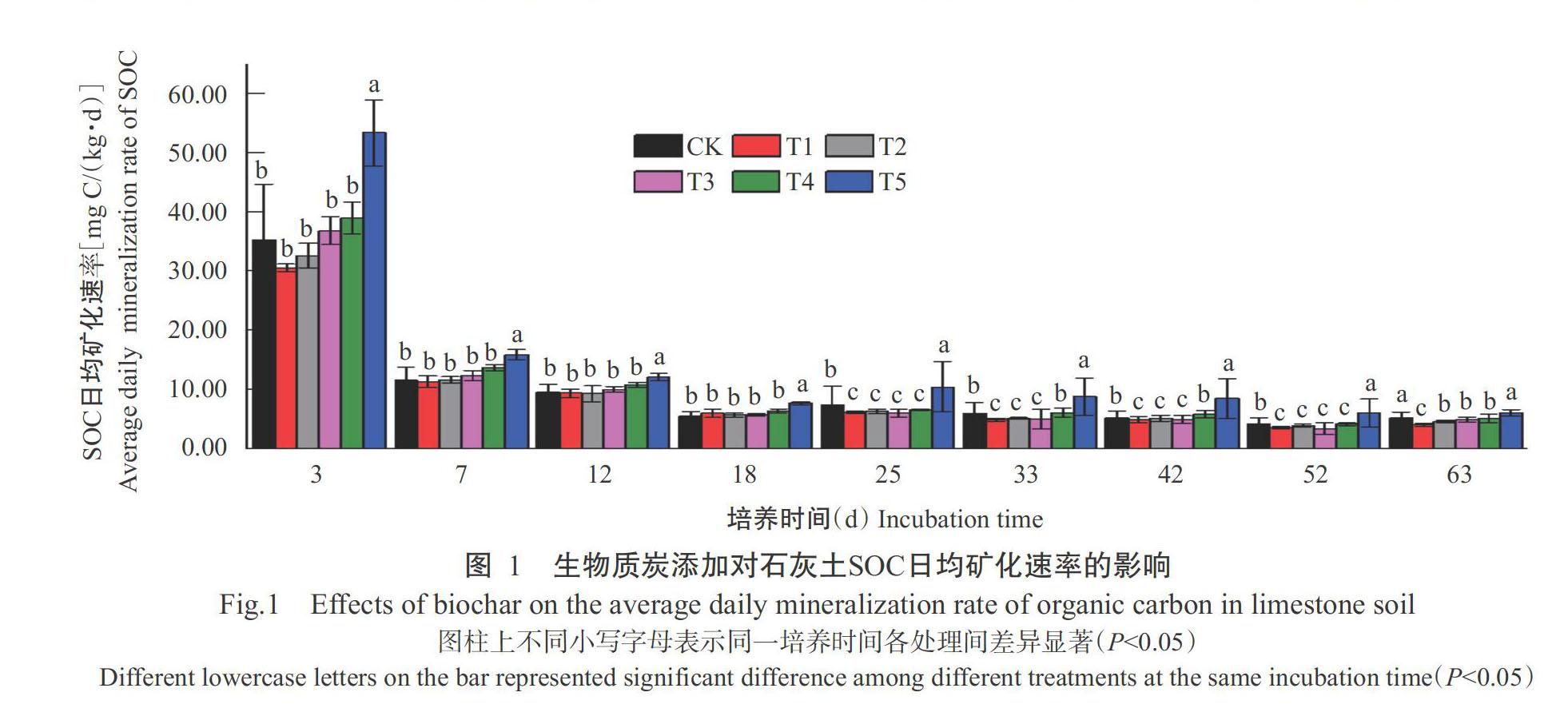
由图1可知,各生物质炭处理的SOC日均矿化速率均随培养时间的延长而降低。培养0~3 d,CK和T1~T5处理的SOC日均矿化率分别为35.31±9.43、30.51±0.63、32.63±2.11、36.85±2.31、38.99±2.67和53.39±5.61 mg C/(kg·d)。培养至第4~7 d,各处理SOC日均矿化速率大幅降低至11.33±0.97~15.83±0.89 mg C/(kg·d)。培养0~18 d,CK和T1~T4处理之间日均矿化速率无显著差异(P>0.05,下同)。表明培养的前18 d,添加0.1%~2.0%的辣椒秸秆生物质炭对SOC日均矿化速率影响不大。培养25~63 d,T1~T3处理日均矿化速率显著小于CK(P<0.05,下同),表明在此时间段内,添加0.1%~1.0%的辣椒秸秆生物质炭对SOC的矿化表现出一定的抑制作用。T5处理在整个培养期内SOC日均矿化速率均显著高于其他添加处理,在0~52 d培养期内显著高于CK,表明添加4.0%辣椒秸秆生物质炭能提高SOC日均矿化速率。
由图2-A可知,CK和T1~T5处理培养63 d后SOC累积矿化量分别为473.05±78.60、427.03±30.12、442.27±23.45、454.44±43.73、503.77±33.51和673.74±102.66 mg C/kg,其中T5处理累积矿化量高于其他处理,CK和T1~T4处理间无明显差异。SOC矿化率是矿化生成的CO2-C占SOC的比例。由图2-B可知,CK和T1~T5处理培养63 d后SOC累积矿化率分别为(2.18±0.36)%、(1.97±0.11)%、(2.04±0.13)%、(2.09±0.19)%、(2.32±0.15)%和(3.11±0.47)%, 其中T5处理SOC累积矿化率显著高于其他处理,CK和T1~T4处理间无显著差异。
2. 2 SOC矿化的动力学特征
本研究中SOC矿化过程可用双库一级动力学模型进行拟合(P<0.01),估算出Ca、Cs和相应的降解速率常数,结果见表2。除CK、T1和T2处理的Ca无显著差异外,Ca随辣椒秸秆生物质炭添加量的增加而显著增大。CK的ka显著大于T1和T2处理,表明0.1%~0.5%的辣椒秸秆生物质炭添加处理抑制石灰土中易降解SOC的矿化速率;T3~T5处理的ka是CK的3.59~4.97倍,表明1.0%~4.0%的辣椒秸秆生物质炭添加处理可显著提高石灰土中易降解SOC的矿化速率。T1~T5處理的ks均显著大于CK,其中T5处理最大,表明辣椒秸秆生物质炭添加可提高难降解SOC库的降解速率。CK石灰土SOC降解半衰期为11.74±0.62年,随着生物质炭的增加而显著降低,T5处理半衰期降至5.19±0.50年。Ca/SOC表征SOC的矿化潜力,该值越高,SOC的可矿化能力越强。CKCa/SOC为(0.76±0.06)%,与T1和T2处理间无显著差异,表明0.1%~0.5%的辣椒秸秆生物质炭添加量对石灰土SOC的矿化能力影响不明显,T3~T5处理Ca/SOC是CK的1.43~5.68倍,表明1.0%~4.0%的辣椒秸秆生物质炭添加能较大幅度提升SOC的矿化潜力。
2. 3 易降解SOC含量变化特征
由图3-A可知,未培养前石灰土WSOC含量为94.89±5.41 mg/kg,培养63 d后各处理土壤WSOC含量均较未培养前显著下降。其中,CK土壤WSOC含量降至44.34±2.79 mg/kg,T1~T5处理的含量降至42.39±2.46~43.08±2.49 mg/kg,CK和T1~T5处理间WSOC含量无显著差异。
由图3-B可知,未培养前石灰土MBC含量为357.62±10.09 mg/kg,培养63 d后CK、T1和T2处理土壤MBC含量均较未培养前显著下降,分别降至316.72±10.12、318.65±15.49和333.38±4.14 mg/kg,且3个处理间无显著差异;T3处理土壤MBC含量为368.22±12.19 mg/kg,与未培养前的含量无显著差异,但显著高于CK、T1和T2处理;T4和T5处理土壤MBC含量分别为386.68±9.81和449.52±18.91 mg/kg,较CK分别显著增加22.09%和41.93%。总的来看,63 d培养期内,不添加辣椒秸秆生物质炭的CK土壤MBC含量较未培养前显著减少,0.1%和0.5%的辣椒秸秆生物质炭添加与CK间无显著差异,对喀斯特石灰土中MBC含量影响较小;添加1.0%~4.0%的辣椒秸秆生物质炭显著提高土壤MBC含量,且随着添加量的增加土壤中MBC含量越高。
由图3-C可知,未培养前石灰土ROC含量为4062.67±243.33 mg/kg,培养63 d后各处理土壤ROC含量均显著下降。其中,CK土壤ROC含量降至2162.25±204.89 mg/kg,T1~T3处理的含量分别降至2010.72±114.65、2156.42±179.45和2342.92±149.39 mg/kg,CK和T1~T3处理间无显著差异;T4和T5处理土壤ROC含量分别降至2849.97±184.21和3163.92±107.16 mg/kg,但较CK分别提高31.81%和46.33%,也显著高于T1~T3处理。总的来看,63 d培养期内,与CK相比,添加0.1%~1.0%的辣椒秸秆生物质炭对喀斯特石灰土中ROC含量影响较小,2.0%~4.0%的添加量可显著提高土壤中ROC含量。
土壤微生物商能灵敏地指示SOC的微生物可利用性,其值越大,SOC矿化周转越快(Melero et al.,2009)。由表3可知,CK、T1和T2土壤微生物商无显著差异,T3~T5处理较CK处理显著提高土壤微生物商。表明63 d培养期内,在未种植植物和施肥的条件下,1.0%~4.0%的辣椒秸秆生物质炭处理可加速喀斯特石灰土中SOC周转速率,提高碳素矿化能力。土壤碳库活度越大,表示SOC越易被微生物分解,土壤肥力质量也就越高(戴全厚等,2008)。由表3可知,CK和T1~T3处理碳库活度无显著差异,T4和T5处理显著提高碳库活度。表明添加2.0%~4.0%辣椒秸秆生物质炭能提高SOC的微生物可降解性,不利于SOC的固持。
微生物是SOC矿化排放的决定性因素。对辣椒秸秆添加处理条件下土壤MBC与土壤有机质碳化指标的相关性进行分析,结果(表4)表明,土壤Ca和Ka均与MBC呈极显著正相关(P<0.01,下同)。1.0%~4.0%添加处理可促进土壤MBC含量的增加,故1.0%~4.0%辣椒秸秆生物质炭添加处理在加速易降解SOC矿化分解速率的同时提高Ca,对SOC的矿化起促进作用。Cs和ks分别与MBC呈极显著负相关和正相关,表明1.0%~4.0%的辣椒秸秆生物质炭处理能加速喀斯特石灰土中难降解SOC的矿化降解,加速土壤碳排放,减少难降解SOC含量。MBC与ROC呈极显著正相关,与WSOC无显著相关性,说明1.0%~4.0%生物质炭添加在提高土壤微生物生物量的同时可增加ROC含量。
3 讨论
3. 1 辣椒秸秆生物质炭对石灰土SOC矿化的影响
生物质炭输入对土壤有机质的矿化排放存在激发、抑制和无显著影响3种效应(Spokas et al.,2009;Smith et al.,2010)。本研究结果显示,低添加量处理(0.1%~1.0%)前期(0~18 d)對石灰土SOC矿化无影响,后期(19~63 d)为抑制效应,从整个培养期(0~63 d)来看为无显著影响;高添加量处理(4.0%)前期表现为激发效应,后期无显著影响,从整个培养期来看为激发效应;而2.0%添加量处理前、后期均无显著影响。可见,辣椒秸秆生物质炭对石灰土SOC矿化的影响会随添加量的不同表现出激发、抑制和无显著影响3种效应,且对SOC矿化的效应还会随时间发生改变。Orlova等(2019)研究发现,桦木和白杨木制成的生物质炭添加量为0.1%时对土壤有机质矿化无影响,添加量增至1.0%时可使有机质矿化率显著提高15%~18%。曹坤坤等(2020)研究发现,3%玉米秸秆生物质炭处理对SOC矿化前期(0~14 d)激发和后期(15~161 d)抑制。上述前人研究结果表明,添加量和培养时间的不同可能会使生物质炭对土壤有机质矿化产生截然不同的效应,本研究结果与之基本一致。生物质炭对SOC矿化的影响与土壤微生物密切相关。生物质炭中丰富的不稳定碳和营养元素可为微生物的生长提供养料(Xu et al.,2016),孔隙结构可作为微生物栖息的微环境,避免微生物间的竞争,从而增加土壤微生物生物量和多样性(Palansooriya et al.,2019),促进土壤有机质矿化分解。由于生物质炭对土壤微生物活性或丰度难以形成持久刺激作用(Ameloot et al.,2014),因而本研究中4.0%辣椒秸秆生物质炭添加处理只在前期(0~18 d)对石灰土SOC矿化起激发作用,而后期(19~63 d)则无显著影响。此外,生物质炭能将土壤有机质吸附到孔隙和外表面,形成包封和吸附保护作用,有效隔离微生物及其产生的胞外酶与有机质的接触,降低有机质的可利用性,从而抑制被吸附有机质的矿化分解(Zimmerman et al.,2004;Cheng and Reinhard,2008)。生物质炭对SOC的吸附过程需要一定的时间,添加前期吸附量少,随着培养时间的增加吸附逐渐增大,对SOC矿化的抑制作用也逐渐增强。这可能是本研究中0.1%~1.0%辣椒秸秆生物质炭添加处理前期(0~18 d)对石灰土SOC矿化无显著影响,而后期(19~63 d)则显著抑制的原因;2.0%添加处理可能是抑制与激发作用效应相当,因而整体表现出对SOC矿化无显著影响。
3. 2 辣椒秸秆生物质炭对石灰土SOC库及碳化速率的影响
生物质炭的输入会影响土壤碳库组成,并进一步影响SOC的矿化排放。研究发现,生物质炭输入会提高土壤中Cs,而对Ca起降低或无明显影响的作用(Hernandez-Soriano et al.,2016;Tsai and Chang,2020)。本研究中,1.0%~4.0%的辣椒秸秆生物质炭显著提高Ca,相应降低Cs,体现了辣椒秸秆生物质炭对SOC库储量影响的独特之处。难降解SOC决定着SOC的储备,在提升土壤碳库稳定性方面有重要作用(Schmidt et al.,2011)。结合1.0%~4.0%和2.0%~4.0%添加处理分别显著提高土壤微生物商和土壤碳库活度的结果,推测1.0%~4.0%辣椒秸秆生物质炭添加处理可能会减弱喀斯特石灰土有机库的稳定性。研究表明,生物质炭添加通常提高ka,降低ks,使得易降解SOC加快降解,难降解SOC更难降解(Hernandez-Soriano et al.,2016;Tsai and Chang,2020)。本研究中,1.0%~4.0%的辣椒秸秆生物质炭添加处理同时提高ka和ks,与上述研究结果不同;1.0%~4.0%处理中生物质炭添加量越大,MBC含量越高,MBC与ks和Ca呈极显著正相关,微生物生物量的增加应是土壤难降解生物质炭矿化加速的主要原因。微生物对SOC的利用主要包括真菌和细菌2种途径,真菌和细菌的生活史策略分别为K对策和r对策(徐嘉晖等,2018)。r型微生物倾向于降解活性SOC,而K型微生物主要降解相对难降解的SOC。可合理推测,辣椒秸秆生物质炭添加到喀斯特石灰土中促进了土壤真菌生长,加快了对难降解SOC的矿化分解,使难降解SOC呈现出易降解SOC的降解特性而使得Ca增加。
值得注意的是,雖然1.0%~4.0%添加处理可同时提高ka和ks,但63 d累积矿化量表明,只有4.0%添加处理明显提高土壤累积矿化量。其原因可能是,本研究除了土壤和生物质炭所含的SOC,没有外来碳源,土壤中能被矿化的SOC在63 d培养期内已被矿化降解,导致1.0%~2.0%生物质炭添加处理虽然可加快有机质的矿化速率,但不能增加累积矿化量。4.0%添加处理对累积矿化量的提升可能与生物质炭所含的可降解SOC有关,但具体原因有待进一步研究。为减少土壤碳排放,建议辣椒秸秆生物质炭改良西南喀斯特地区石灰的添加量应低于4.0%。
3. 3 辣椒秸秆生物质炭对石灰土易降解SOC含量的影响
易降解SOC主要由WSOC、MBC和ROC等组成,由于其稳定性较低,矿化速率较快,虽然仅占SOC总量的较小部分,却是产生温室气体的主要碳源(赵世翔等,2017)。SOC的溶解是被微生物利用并将其矿化的先决条件,WSOC含量动态和周转与SOC的矿化密切相关(Demisie et al.,2014)。Mitchell等(2015)研究发现,糖枫木生物质炭添加到土壤中可显著提高WSOC含量。Wang等(2016)研究发现胡桃壳生物质炭在干湿循环条件下可促进SOC向WSOC转化。本研究中,辣椒秸秆生物质炭添加对石灰土WSOC含量无显著影响。SOC矿化是一个以微生物学过程为主的复杂过程,MBC对其影响较大(谢国雄和章明奎,2014)。研究发现,随炭化温度和在土壤中存在时间的不同,生物质炭对土壤MBC含量影响会呈现出提高和降低2种不同的效应(Zhang et al.,2014;Li et al.,2018)。本研究中,550 ℃下炭化的辣椒秸秆生物质炭在1.0%~4.0%添加处理时可显著提高喀斯特石灰土MBC含量。ROC对外部环境变化的响应非常敏感,可反映出SOC的有效性和时效性(张哲等,2019)。Demisie等(2014)研究表明,0.5%添加量的橡木和竹生物质炭就能显著提高土壤中ROC含量。本研究中只有2.0%和4.0%添加量的辣椒秸秆生物质炭能显著提高土壤中ROC含量,与Jien等(2015)发现2%和4%稻壳生物质炭添加量能显著提高土壤中ROC含量的结果类似。
3. 4 辣椒秸秆生物质炭施入石灰土的碳环境效应
根据前述对研究结果的分析讨论,将恒温恒湿,不种植作物、不施肥、室内短时间尺度培养下的辣椒秸秆生物质炭添加到喀斯特石灰土后的碳环境效应以图4进行总结表达:由于生物质炭的碳化学结构以芳香碳为主,具有高度的生物化学和热稳定性,生物质炭中绝大部分非活性碳被封存于土壤环境中,起到固碳作用;生物质炭的输入可促进微生物生长,在封闭培养的条件下,其碳源主要来自于SOC;微生物生物量的增加可加快难降解和易降解SOC矿化速率,在较短时间内可增加土壤碳矿化排放量;同时,辣椒秸秆生物质炭添加提高了易降解SOC库储量,降低了难降解SOC库储量,在微生物的作用下部分难降解SOC转化为易降解SOC。
4 结论
辣椒秸秆生物质炭对喀斯特石灰土SOC矿化速率的影响与添加量有关,1.0%~4.0%添加处理可提高矿化速率常数,同时增加Ca、MBC和ROC含量,但对WSOC含量无影响,4.0%添加处理在63 d培养期内可提高土壤累积矿化量。为减少土壤碳排放,建议辣椒秸秆生物质炭改良西南喀斯特石灰土的添加量应低于4.0%。
参考文献:
曹坤坤,张沙沙,胡学玉,黄洋. 2020. 生物质炭影响下土壤呼吸温度敏感性及细菌群落结构的变化[J]. 环境科学,41(11):5185-5192. doi:10.13227/j.hjkx.202004160. [Cao K K,Zhang S S,Hu X Y,Huang Y. 2020. Effect of biochar on changes of the temperature sensitivity of soil respiration and bacterial community structure[J]. Environmental Science, 41(11):5185-5192.]
戴全厚,刘国彬,薛萐,余娜,张超,兰雪. 2008. 不同植被恢复模式对黄土丘陵区土壤碳库及其管理指数的影响[J]. 水土保持研究,15(3):61-64. [Dai Q H,Liu G B,Xue S,Yu N,Zhang C,Lan X. 2008. Effect of different vegetation restoration on soil carbon and carbon management index in eroded hilly Loess Plateau[J]. Research of Soil and Water Conservation,15(3):61-64.]
葛晓改,周本智,肖文发,王小明,曹永慧. 2016. 生物质炭输入对土壤碳排放的激发效应研究进展[J]. 生态环境学报,25(2):339-345. doi:10.16258/j.cnki.1674-5906.2016. 02.023. [Ge X G,Zhou B Z,Xiao W F,Wang X M,Cao Y H. 2016. Priming effect of biochar addition on soil carbon emission:A review[J]. Ecology and Environmental Sciences,25(2):339-345.]
黄雁飞,陈桂芬,熊柳梅,刘斌,刘永贤,黄玉溢,唐其展. 2020. 不同秸秆生物炭对水稻生长及土壤养分的影响[J]. 南方农业学报,51(9):2113-2119. doi:10.3969/j.issn. 2095-1191.2020.09.008. [Huang Y F,Chen G F,Xiong L M,Liu B,Liu Y X,Huang Y Y,Tang Q Z. 2020. Effects of different straw biochars on rice growth and soil nutrients[J]. Journal of Southern Agriculture,51(9):2113-2119.]
刘燕萍,高人,杨玉盛,尹云锋,马红亮,薛丽佳. 2011. 黑碳添加对土壤有机碳矿化的影响[J]. 土壤,43(5):763-768. doi:10.13758/j.cnki.tr.2011.05.017. [Liu Y P,Gao R,Yang Y S,Yin Y F,Ma H L,Xue L J. 2011. Effect of black carbon addition on soil organic carbon mineralization[J]. Soils,43(5):763-768.]
涂保华,胡茜,张艺,符菁,肖娴,孙悦,赵远. 2020. 基于不同类型秸秆制备的生物炭对稻田土壤温室气体排放的影响[J]. 江苏农业学报,35(6):1374-1380. doi:10.3969/j.issn.1000-4440.2019.06.015. [Tu B H,Hu Q,Zhang Y,Fu J,Xiao X,Sun Y,Zhao Y. 2020. Effects of biochar based on different types of straw on greenhouse gas emission from paddy soil[J]. Jiangsu Journal of Agricultural Sciences,35(6):1374-1380.]
王战磊,李永夫,姜培坤,周国模,刘娟. 2014. 施用竹叶生物质炭对板栗林土壤CO2通量和活性有机碳库的影响[J]. 应用生态学报,25(11):3152-3160. doi:10.13287/j.1001-9332.20140918.001. [Wang Z L,Li Y F,Jiang P K,Zhou G M,Liu J. 2014. Effect of bamboo leaf biochar addition on soil CO2 efflux and labile organic carbon pool in a Chinese chestnut plantation[J]. Chinese Journal of Applied Ecology,25(11):3152-3160.]
吴金水,林启美,黄巧云,肖和艾. 2006. 土壤微生物生物量的测定方法及其应用[M]. 北京:气象出版社. [Wu J S,Lin Q M,Huang Q Y,Xiao H A. 2006. Determination of soil microbial biomass and its application[M]. Beijing: China Meteorological Press.]
谢国雄,章明奎. 2014. 施用生物质炭对红壤有机碳矿化及其组分的影响[J]. 土壤通报,45(2):413-419. doi:10.19336/ j.cnki.trtb.2014.02.027. [Xie G X,Zhang M K. 2014. Influence of biochar application on mineralization and fractions of organic carbon in red soils with different land use[J]. Chinese Journal of Soil Science,45(2):413-419.]
徐嘉晖,孙颖,高雷,崔晓阳. 2018. 土壤有机碳稳定性影响因素的研究进展[J]. 中国生态农业学报,26(2):222-230. doi:10.13930/j.cnki.cjea.170627. [Xu J H,Sun Y,Gao L,Cui X Y. 2018. A review of the factors influencing soil organic carbon stability[J]. Chinese Journal of Eco-Agriculture,26(2):222-230.]
张哲,王邵军,李霁航,曹润,陈闽昆,李少辉. 2019. 土壤易氧化有机碳对西双版纳热带森林群落演替的响应[J]. 生态学报,39(17):6257-6263. doi:10.5846/stxb201806021230. [Zhang Z,Wang S J,Li J H,Cao R,Chen M K,Li S H. 2019. Response of soil readily oxidizable carbon to community succession of Xishuangbanna tropical forests[J]. Acta Ecologica Sinica,39(17):6257-6263.]
趙世翔,于小玲,李忠徽,杨艳,刘丹,王旭东,张阿凤. 2017. 不同温度制备的生物质炭对土壤有机碳及其组分的影响:对土壤活性有机碳的影响[J]. 环境科学,38(1):333-342. doi:10.13227/j.hjkx. 201604058. [Zhao S X,Yu X L,Li Z H,Yang Y,Liu D,Wang X D,Zhang A F. 2017. Effects of biochar pyrolyzed at varying temperatures on soil organic carbon and its components:Influence on the soil active organic carbon[J]. Environment Science, 38(1):333-342.]
郑永春,王世杰. 2002. 贵州山区石灰土侵蚀及石漠化的地质原因分析[J]. 长江流域资源与环境,11(5):461-465. doi:10.3969/j.issn.1004-8227.2002.05.014. [Zheng Y C,Wang S J. 2002. Geological cause of calcareous soil erosion and land rocky desertification in karst area,Guizhou Province[J]. Resources and Enuironment in the Yangtza Basin,11(5):461-465.]
Ameloot N,Sleutel S,Case S D C,Alberti G,McNamara N P,Zavalloni C,Vervisch B,Vedove G D,Neve S D. 2014. C mineralization and microbial activity in four biochar field experiments several years after incorporation[J]. Soil Biology & Biochemistry,78:195-203. doi:10. 1016/j.soilbio.2014.08.004.
Blair G J,Lefroy R D B,Lisle L. 1995. Soil carbon fractions based on their degree of oxidation and the development of a carbon management index for agricultural systems[J]. Australian Journal of Agricultural Research,46(7):1459-1466. doi:10.1071/AR9951459.
Cheng H,Reinhard M. 2008. The rate of 2,2-dichloropropane transformation in mineral micropores:Implications of sorptive preservation for fate and transport of organic contaminants in the subsurface[J]. Environmental Science & Technology, 42(8):2879-2885. doi:10.1021/es702888h.
Ci E,Al-Kaisi M M,Wang L G,Ding C H,Xie D T. 2015. Soil organic carbon mineralization as affected by cyclical temperature fluctuations in a karst region of Southwestern China[J]. Pedosphere,25(4):512-523. doi:10.1016/S1002- 0160(15)30032-1.
Demisie W L,Liu Z Y,Zhang M K. 2014. Effect of biochar on carbon fractions and enzyme activity of red soil[J]. CATENA,121:214-221. doi:10.1016/j.catena.2014.05.020.
Fang Y Y,Singh B,Singh B P. 2015. Effect of temperature on biochar priming effects and its stability in soils[J]. Soil Biology and Biochemistry,80:136-145. doi:10.1016/j.soilbio.2014.10.006.
Hamer U,Marschner B,Brodowski S,Amelung W. 2004. Interactive priming of black carbon and glucose mineralization[J]. Organic Geochemistry,35(7):823-830. doi:10. 1016/j.orggeochem.2004.03.003.
Hernandez-Soriano M C,Kerré B,Kopittke P M,Horemans B,Smolders E. 2016. Biochar affects carbon composition and stability in soil:A combined spectroscopy-microscopy study[J]. Scientific Reports,6:25127. doi:10.1038/srep 25127.
Jien S H,Wang C C,Lee C H,Lee T Y. 2015. Stabilization of organic matter by biochar application in compost-amended soils with contrasting pH values and textures[J]. Sustainability,7(10):13317-13333. doi:10.3390/su 71013317.
Kimetu J M,Lehmann J. 2010. Stability and stabilisation of biochar and green manure in soil with different organic carbon contents[J]. Australian Journal of Soil Research,48(7):577-585. doi:10.1071/SR10036.
Lal R. 2004. Soil carbon sequestration impacts on global climate change and food security[J]. Science,304(5677):1623-1627. doi:10.1126/science.1097396.
Lehmann J. 2007. A handful of carbon[J]. Nature,447:143-144. doi:10.1038/447143a.
Li Q,Lei Z F,Song X Z,Zhang Z T,Ying Y Q,Peng C H. 2018. Biochar amendment decreases soil microbial biomass and increases bacterial diversity in Moso bamboo(Phyllostachys edulis) plantations under simulated nitrogen deposition[J]. Environmental Research Letter,13(4):044029. doi:10.1088/1748-9326/aab53a.
Liu C,Wang H L,Tang X Y,Guan Z,Reid B J,Rajapaksha A U,Ok Y S,Sun H. 2015. Biochar increased water hol-ding capacity but accelerated organic carbon leaching from a sloping farmland soil in China[J]. Environmental Science and Pollution Research,23(2):995-1006. doi:10. 1007/s11356-015-4885-9.
Luo Y,Durenkamp M,De Nobili M,Lin Q,Brookes P C. 2011. Short term soil priming effects and the mineralization of biochar following its incorporation to soils of different pH[J]. Soil Biology and Biochemistry,43(11):2304-2314. doi:10.1016/j.soilbio.2011.07.020.
Melero S,López-Garrido R,Madejón E,Murillo J M,Vanderlinden K,Ordó?ez R,Moreno F. 2009. Long-term effects of conservation tillage on organic fractions in two soils in southwest of Spain[J]. Agriculture Ecosystems & Environment,133(1):68-74. doi:10.1016/j.agee.2009.05.004.
Mitchell P J,Simpson A J,Soong R,Simpson M J. 2015. Shifts in microbial community and water extractable organic matte composition with biochar amendment in a temperate forest soil[J]. Soil Biology and Biochemistry,81:244-254. doi: 10.1016/j.soilbio.2014.11.017.
Orlova N,Abakumov E V,Orlova E,Yakkonen K,Shahna-zarova V. 2019. Soil organic matter alteration under biochar amendment:Study in the incubation experiment on the Podzol soils of the Leningrad region(Russia)[J]. Journal of Soils and Sediments,19(1-2):2708-2716. doi:10.1007/s11368-019-02256-z.
Palansooriya K N,Wong J T F,Hashimoto Y,Huang L B,Rinklebe J,Chang S X,Bolan N,Wang H L,Ok Y S. 2019. Response of microbial communities to biochara-mended soils:A critical review[J]. Biochar,1(1):3-22. doi:10.1007/s42773-019-00009-2.
Riaz M,Roohi M,Arif M S,Hussain Q,Yasmeen T,Shahzad T,Shahzad S M,Muhammad H F,Arif M,Khalid M. 2017. Corncob-derived biochar decelerates mineralization of native and added organic matter(AOM) in organic matter depleted alkaline soil[J]. Geoderma,294:19-28. doi:10.1016/j.geoderma.2017.02.002.
Schmidt M W I,Torn M S,Abiven S,Dittmar T,Guggenber-ger G,Janssens I A,Kleber M. K?gel-Knabner I,Lehmann J,Manning D A C,Nannipieri P,Rasse D P,Weiner S,Trumbore S E. 2011. Persistence of soil organic matter as an ecosystem property[J]. Nature,478:49-56. doi:10. 1038/nature10386.
Smith J L,Collins H P,Bailey V L. 2010. The effect of young biochar on soil respiration[J]. Soil Biology & Biochemistry,42(12):2345-2347. doi:10.1016/j.soilbio.2010. 09.013.
Spokas K A,Koskinen W C,Baker J M,Reicosky D C. 2009. Impacts of woodchip biochar additions on greenhouse gas production and sorption /degradation of two herbicides in a Minnesota soil[J]. Chemosphere,77(4):574-581. doi:10.1016/j.chemosphere.2009.06.053.
Tsai C C,Chang Y F. 2020. Kinetics of C mineralization of biochars in three excessive compost-fertilized soils:Effects of feedstocks and soil properties[J]. Agronomy,10(11):1749-1767. doi:10.3390/agronomy10111749.
Wang D Y,Griffina D E,Parikha S J,Scow K M. 2016. Impact of biochar amendment on soil water soluble carbon in the context of extreme hydrological events[J]. Chemosphere,160:287-292. doi:10.1016/j.chemosphere.2016. 06.100.
Wardle D A,Nilsson M C,Zackrisson O. 2008. Fire-derived charcoal causes loss of forest humus[J]. Science,320(5876):629. doi:10.1126/science.1154960.
Xu N,Tan G C,Wang H Y,Gai X P. 2016. Effect of biochar additions to soil on nitrogen leaching,microbial biomass and bacterial community structure[J]. European Journal of Soil Biology,74:1-8. doi:10.1016/j.ejsobi.2016.02. 004.
Yang S H,Chen X,Jiang Z W,Ding J,Sun X,Xu J Z. 2020. Effects of biochar application on soil organic carbon composition and enzyme activity in paddy soil under water-saving irrigation[J]. International Journal of Environmental Research and Public Health,17(1):333. doi:10. 3390/ijerph17010333.
Zhang Q Z,Dijkstra F A,Liu X R,Wang Y D,Huang J,Lu N. 2014. Effects of biochar on soil microbial biomass after four years of consecutive application in the North China Plain[J]. PLoS One,9(7):e102062. doi:10.1371/journal.pone.0102062.
Zimmerman A R,Chorover J,Goyne K W,Brantley S L. 2004. Protection of mesopore-adsorbed organic matter from enzymatic degradation[J]. Environmental Science & Technology,38(17):4542-4548. doi:10.1021/es035340+.
(責任编辑 罗 丽)

