加减黄连温胆汤对血管性痴呆模型大鼠炎症反应的影响
窦金金 齐珊 张喜武

摘要 目的:观察加减黄连温胆汤对血管性痴呆(Vascular Dementia,VD)模型大鼠脑组织白细胞介素-1β(Interleukin-1β,IL-1β)mRNA、肿瘤坏死因子-α(Tumor Necrosis Factor-α,TNF-α)mRNA和环氧合酶-2(Cyclooxygenase-2,COX-2)mRNA的影响,明确炎症反应对VD的影响,探讨加减黄连温胆汤对VD大鼠的炎症作用机制。方法:采用大鼠双侧颈总动脉间断性结扎的方法,复制VD大鼠模型。通过逆转录-聚合酶链反应(Reverse Transcription-polymerase Chain Reaction,RT-PCR)法试剂盒检测TNF-αmRNA、IL-1βmRNA和COX-2 mRNA,并描绘各验证因子数据表达变化。结果:模型组与空白组、假手术组比较,模型组脑组织IL-1βmRNA和TNF-αmRNA及COX-2mRNA的表达明显增多,有显著性差异;加减黄连温胆汤与模型组比较,加减黄连温胆汤可使IL-1βmRNA和TNF-αmRNA及COX-2mRNA的表达下调,有显著性差异。结论:加减黄连温胆汤可通过抑制炎症介质IL-1βmRNA、TNF-αmRNA及COX-2 mRNA的表达,发挥对VD模型大鼠的治疗作用。
关键词 加减黄连温胆汤;血管性痴呆;炎症反应;逆转录-聚合酶链反应;白细胞介素-1βmRNA;肿瘤坏死因子-αmRNA;环氧合酶-2 mRNA
Effects of Modified Huanglian Wendan Decoction on Inflammation Reaction in Rats with Vascular Dementia
DOU Jinjin1,QI Shan2,ZHANG Xiwu2
(1 The First Affiliated Hospital,Heilongjiang University of Chinese Medicine,Harbin 150040,China; 2 Heilongjiang University of Chinese Medicine,Harbin 150040,China)
Abstract Objective:To observe the effects of modified Huanglian Wendan Decoction on interleukin-1β(IL-1β)mRNA,tumor necrosis factor-α(TNF-α) mRNA and cyclooxygenase-2(COX-2)mRNA in the brain tissue of vascular dementia(VD)model rats.To clarify the influence of inflammation on VD,and to explore the inflammatory mechanism of modified Huanglian Wendan Decoction on VD rats.Methods:The rat model of VD was replicated by intermittent ligation of bilateral common carotid arteries in rats.TNF-αmRNA,IL-1βmRNA and COX-2 mRNA were detected by reverse transcription-polymerase chain reaction(RT-PCR)kit,and the expression changes of each verification factor data were depicted.Results:Compared with the blank group and the sham operation group,the expression of IL-1βmRNA,TNF-αmRNA and COX-2mRNA in the brain tissue of the model group was significantly increased,and there was a significant difference.Compared with the model group,modified Huanglian Wendan Decoction,can down-regulate the expression of IL-1βmRNA,TNF-αmRNA and COX-2mRNA,with significant differences.Conclusion:Modified Huanglian Wendan can reduce the inhibition of inflammatory factor the expression of IL-1βmRNA,TNF-αmRNA and COX-2mRNA,and play a role in inhibiting inflammation.
Keywords Modified Huanglian Wendan Decoction; Vascular dementia; Inflammation reverse transcription-polymerase chain reaction; Interleukin-1βmRNA; Tumor necrosisfactor-α; TNF-αmRNA; Cyclooxygenase-2mRNA
中圖分类号:R289.5文献标识码:Adoi:10.3969/j.issn.1673-7202.2021.09.012
血管性痴呆指由各类脑血管疾病导致的脑功能障碍而产生的一种获得性智能损害综合征[1],患病者有不同程度的记忆、认知、行为等认知障碍[2]。中药方剂可通过抑制神经细胞凋亡、改善血流变、调节神经递质、激活脑细胞、抗氧化损伤等作用治疗VD,尤其是抑制炎症反应作用[3-4]。众多中医大家普遍认为VD病机为髓海虚空、脏腑衰退、痰瘀互结、浊毒化生,导致脑络痹阻、络脉瘀滞、神志失统[5-7]。黄连温胆汤是化痰的经典方,在此基础上加用活血化瘀类药物,可共奏化痰活血之功。本研究应用RT-PCR等技术,在VD模型基础上完成VD模型大鼠炎症反应影响研究,以利于指导临床应用,以期为VD的治疗提供新思路。
1 材料与方法
1.1 材料
1.1.1 動物
选取清洁级健康雄性Wistar大鼠100只,体质量(200±20)g,由黑龙江中医药大学实验动物中心提供,生产许可证号为2017023521,伦理审批号为2017031001。所有大鼠在同一动物房中饲养,室温为22~26 ℃,相对湿度为55%左右,正常光照。适应性饲养2周,饲料及饮水均经过高温蒸汽灭菌。
1.1.2 药物
加减黄连温胆汤(modified Huanglian Wendan,HLWD):HLWD饮片购于哈尔滨松茂药材公司。中药饮片加水煎煮,分别制备成浓度为1 g/mL(高剂量)、0.5 g/mL(低剂量)的药液,于4 ℃冰箱保存备用。大鼠给药剂量依据人与大鼠用药换算关系计算,给药体积按2 mL/100 g体质量计算。阳性对照药盐酸多奈哌齐片(安理申,法国PFIZER PGM公司,进口药品注册证号:BH20040114,分包装批准文号:国药准字J20160020),5 mg/片。
1.1.3 试剂与仪器
1)试剂:硝普钠(批号:20170405):北京制药工业研究所实验药厂;TRIzol试剂(批号:269201):美国Invitrogen公司;RT-PCR试剂盒(批号:20170613):北京索莱宝公司。2)仪器:DMS-2MORRIS水迷宫系统:中国医学科学院药物研究所;702超低温冰箱:ULT Freezer美国;OptimaTM XL-look Ultra centrifuge高速低温离心机:BECKMAN美国;Apllied Biosystems 2700 PE PCR扩增仪:Singarpore;DYY-8B稳压稳流定时电泳仪:北京六一厂;Labworks 4.5 UVP紫外凝胶成像系统:Cambridge英国。
1.2 方法
1.2.1 模型制备
取适应性饲养2周的清洁级Wistar大鼠15只不做任何处理为空白组,剩余85只大鼠术前禁食水,称重。腹腔注射10%的乌拉坦麻醉,并置于手术台上仰卧固定,消毒颈部,切开颈部皮下组织,分离双侧颈总动脉(Common Carotid Arteries,CCA),用动脉夹夹闭双侧CCA20 min(I20),后去除动脉夹通血10 min(R10),再夹闭20 min(I20),如此反复3次,即I20-R10-I20-R10-I20-R10,末次腹腔注射硝普钠,缝合伤口后置于笼中继续饲养。假手术组仅分离双侧CCA后即缝合。在实验过程中为了减少低温对模型脑缺血损伤的保护作用,使大鼠肛温保持在37 ℃左右。
手术3 d后,模型大鼠行动迟缓,活动减少。将100只大鼠中所有存活动物分别进行Morris水迷宫实验,记录每只大鼠逃避潜伏期,以空白组大鼠的均值为参考值,计算模型组大鼠各鼠平均逃避潜伏期与参考值之差占平均逃避潜伏期的比值,该值大于20%为痴呆,其中,比值20%~30%为轻度痴呆,比值30%~40%为中度痴呆,比值40%为重度痴呆。达不到痴呆标准者被剔除出实验。
1.2.2 动物分组与给药
Wistar大鼠随机分成6组:空白组(15只)、假手术组(17只)、模型组(17只)、安理申对照组(17只)、HLWD低剂量组(黄低组,17只)、HLWD高剂量组(黄高组17只)。以灌胃形式给药,体积为2 mL,阳性对照组按照0.45 mg/kg给药,其他组给予同体积的蒸馏水,给药周期为28 d。
1.2.3 观察指标与方法
给药28 d后,将大鼠麻醉,打开胸腔,向升主动脉插管,首先用0.9%的生理盐水冲洗,并剪开右心耳,待大鼠双目虹膜以及肝脏变白后,再灌入4%多聚甲醛溶液,最后开颅取全脑匀浆备用。称取大鼠脑组织、海马50~100 mg/mL Trizol组织,置于冰盒上,研磨成粉末状。室温放置5 min,加入氯仿(0.2 mL/mL Trizol),剧烈振荡15 s,放置2~3 min。在4 ℃以1.2×104 r/min离心(离心半径为6 cm)15 min,取上清(混合物分三层,下面是酚-氯仿-蛋白质层,中间是DNA层,最上层为水性上清含mRNA),收集上层无色液体置于1.5 mLEppendorf离心管,弃沉淀管(可保留在-70 ℃)。加入等体积异丙醇(1 mLTrizol加入0.5 mL),混匀,出现沉淀后放置10 min。在4 ℃以1.2×104 r/min,离心(离心半径为6 cm)10 min弃上清,留沉淀,加入1 mL 4 ℃的75%乙醇洗涤。在4 ℃以1.0×104 r/min离心(离心半径为6 cm)10 min。将沉淀溶于30 μLDEPC水中。测量RNA浓度及纯度。余下RNA分装置于-70 ℃备用。
1)取0.2 mL PCR管,分别加入RNA(1 mg/mL)1 μL、DEPC处理水6 μL、OligodT11 μL,金属浴70 ℃ 5 min,立即置于冰盒上放置10 min。再向体系中加入4 μL 5×反转录酶buffer、4 μL dNTP(2.5 mmol/L)、2 μL DTT(0.1 mol/L)、1 μL Rnase Inhabitor、1 μL mol/L-MLV,37 ℃1 h,95 ℃5 min,-20 ℃分装冻存。
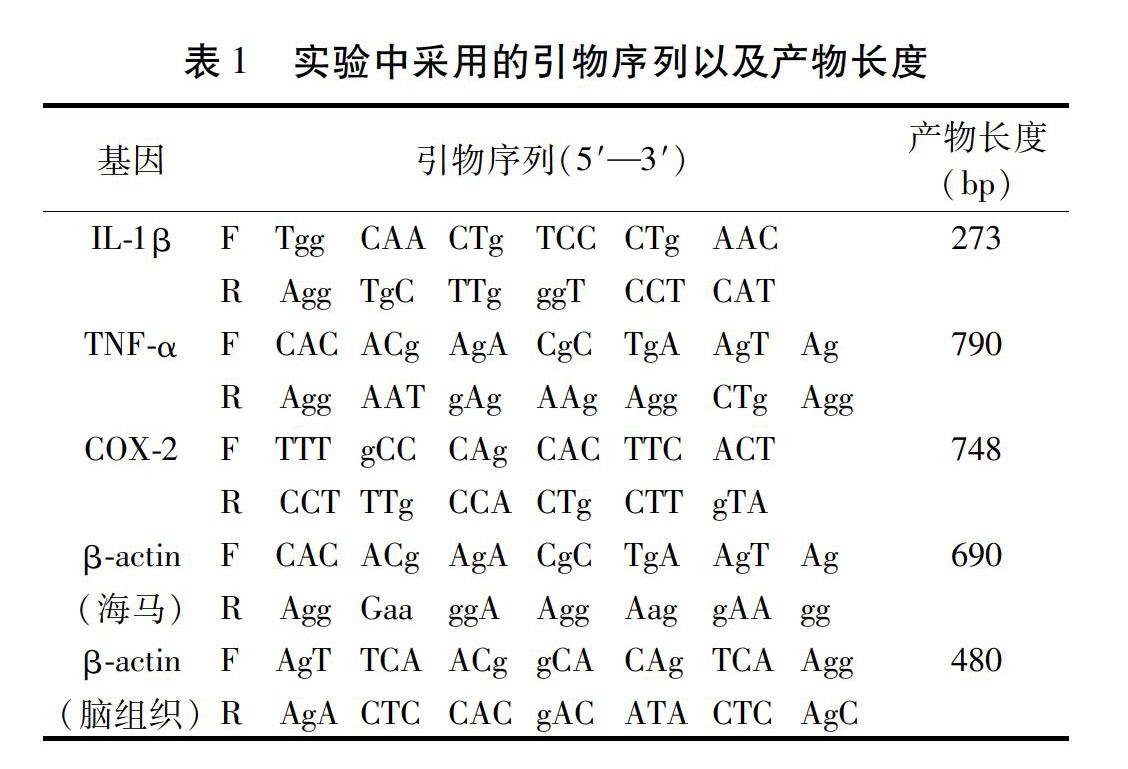
2)聚合酶链反应:引物和内参序列分别如表1所示(由美国NCBI数据库提供RNA全序列,用Primer3引物设计软件设计)。
3)反应体系:5 μL 10×PCR buffer,4 μL DNTP,1 μL上游引物50 mmol/L,1 μL下游引物50 mmol/L,1 μL cDNA,3 μL Mgcl2,1 μL Taq DNA Polymerase,DEPC-treated water补足至50 μL。
4)PCR条件:IL-1β、TNF-α、COX-2退火温度分别为53.5 ℃、56.8 ℃、53.5 ℃。
95 ℃预变性6 min,94 ℃变性30 s,53.5~56.8 ℃退火30 s,72 ℃延伸30 s,重复33个循环,72 ℃延伸10 min,4 ℃10 min,-20 ℃分装保存。
5)电泳及图像分析:取5 L上述反应产物于1.5%琼脂糖凝胶上电泳,扫描拍照和分析扩增产物电泳强度,并依据目的基因IL-1β、TNF-α、COX-2与内参基因β-actin电泳条带密度比值,分析基因表达水平变化。
1.3 统计方法
采用SPSS 17.0统计软件进行数据分析,数据采用均数±标准差(±s)表示,对逃避潜伏期采用多因素方差分析比较,其他组间比较采用单因素方差分析。P<0.05为差异有统计学意义。
2 结果
2.1 大鼠一般狀况
造模前大鼠皮毛亮泽光滑,饮食正常,体格健壮,喜活动,行动敏捷。手术过程中,CCA阻断后出现短暂性晕厥,双目变白,皮温减低,呼吸频率先快后慢,复位反射消失。造模后早期大鼠运动量减少,嗜睡,饮食减少,随后出现精神萎靡、竖毛或毛发稀疏无光而枯槁、反应迟钝,而无肢体运动障碍,大部分造模后大鼠出现虹膜淡白,一侧眼裂的缩小。
给药后,各组一般状况均有不同程度的缓解。但模型组大鼠进食、排便和活动量减少,体质量减轻,精神不振,反应迟钝,毛发干枯无光泽,尾部有色素沉着且日渐加重。以上症状在假手术组大鼠中均未出现。在给药阶段,假手术组、模型组、安理申组、黄低组、黄高组死亡数分别为1只、2只、1只、2只、1只,其主要死亡原因为术后感染和术后颅内压力过高导致颅内出血,死亡大鼠不列入统计分析,每组剩余大鼠做指标检测。
2.2 HLWD对VD大鼠脑组织IL-1βmRNA、TNF-αmRNA和海马COX-2mRNA的影响
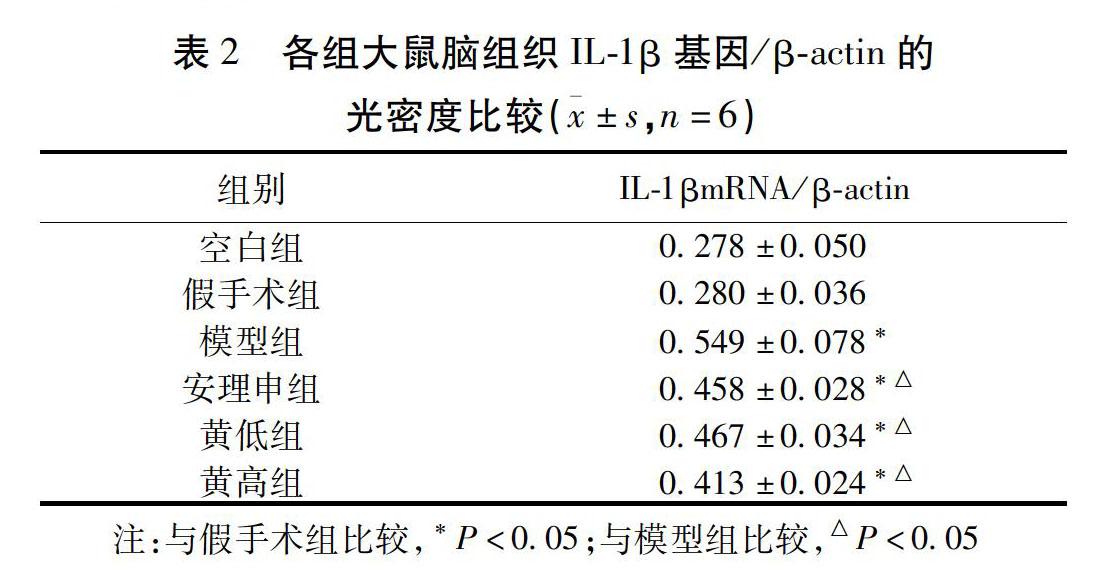
2.2.1 IL-1βmRNA表达水平分析 与假手术组比较,模型组大鼠脑组织IL-1βmRNA水平升高(P<0.05);与模型组比较,黄高低组、安理申组对脑组织IL-1βmRNA水平均有明显的下调作用(P<0.05);各观察组比较差异无统计学意义(P>0.05)。见图1,表2。
2.2.2 TNF-αmRNA表达水平分析 与假手术组比较,模型组大鼠脑组织TNF-αmRNA水平升高,差异有统计学意义(P<0.05);与模型组比较,黄高组、安理申组对脑组织TNF-αmRNA水平均有明显上调作用,差异有统计学意义(P<0.05),黄低组差异无统计学意义(P>0.05)。黄高组与安理申比较差异无统计学意义(P>0.05)。见图2,表3。
2.2.3 COX-2mRNA表达水平分析
与假手术组比较,模型组大鼠海马区COX-2mRNA水平显著升高,差异有统计学意义(P<0.05);与模型组比较,黄高低组、安理申组对海马区COX-2mRNA水平下调显著,差异有统计学意义(P<0.05);黄高组与安理申组比较,差异有统计学意义(P<0.05)。见图3,表4。
3 讨论
VD是迄今世界唯一公认可以防治的痴呆疾病,极早治疗或有可逆性,寻找其发病机制,对于早期诊断和早期治疗意义巨大[8-9]。张伯礼院士提出治疗VD要以“补肾为要、痰瘀并治”,肾精亏虚、髓海空虚、瘀血痰浊亦为病情变化之根源。黄连温胆汤出自《六因条辨》卷上,有理气化痰的功效,符合张伯礼院士提出治疗VD要以“补肾为要、痰瘀并治”理论[10-12]。此方中半夏为君药,可燥湿化痰;陈皮可理气和中,茯苓渗湿健脾以消痰,黄芪与此二味药共奏益气、理气之效;决明子清泻肝火、润肠通便,又兼补肾阴,黄连清热燥湿、泻火解毒;竹茹利胆和胃,葛根清热生津,此二味共防燥热药伤阴;丹参具有活血化瘀作用,可祛除瘀阻之邪;甘草,益气和中,可调和诸药[13-14]。
炎症反应与脑组织的损伤、缺血、缺氧及再灌注等密切相关[15-16]。灌注早期产生的炎症介质主要包括TNF-α、IL-1β等,可介导炎症反应和免疫反应,可放大炎症反应,是机体对创伤产生的适应性反应[17-18]。COX-2是PGS合成中的关键限速酶,为酶的诱导型,当细胞受到IL-1β、TNF-α等各种刺激时迅速合成,促进炎症反应和组织损伤[19-20]。
在模型组大鼠脑组织IL-1βmRNA表达水平明显升高,提示缺血再灌注后,可诱导脑内炎症反应发生,炎症介质IL-1β表达增强。HLWD高、低剂量组及安理申对照组IL-1βmRNA表达水平较VD模型组有明显的下调作用,提示HLWD高、低剂量组和安理申组脑组织炎症反应较模型组减轻。HLWD高、低剂量组及安理申对照组TNF-αmRNA表达水平均较VD模型组下降,提示HLWD高、低剂量组和安理申组脑组织炎症反应较模型组减轻,这提示HLWD和安理申均有抑制VD大鼠模型脑内慢性炎症、TNF-αmRNA及IL-1βmRNA表达的作用,这可能是二者对抗VD的机制之一。HLWD高、低剂量组及安理申对照组COX-2mRNA表达水平均较VD模型组下降,提示HLWD高、低剂量组和安理申组脑组织炎症反应较模型组减轻。HLWD可减少COX-2的表达,或通过对炎症介质(IL-1β和TNF-α)的抑制作用而发挥对COX-2的基因和蛋白质表达的干预作用,起到抑制脑缺血后的炎症反应,发挥脑保护的作用。
参考文献
[1]石苗茜,刘卫平.血管性痴呆发病机制研究进展[J].第四军医大学学报,2007,28(9):860-863.
[2]单永琳,刘国华.血管性痴呆的研究现状[J].医学综述,2017,23(8):1589-1594.
[3]陈永真,麻春杰.近5年中医药治疗血管性痴呆研究概述[J].山东中医杂志,2020,39(1):83-86.
[4]刘川杨,肖凌勇,屠建锋,等.中药复方治疗血管性痴呆的机制研究进展[J].中华中医药杂志,2019,34(2):696-701.
[5]陈静,吴林,伍媛,等.从五脏论治血管性痴呆的研究进展[J].湖南中医杂志,2020,36(1):143-145.
[6]王佳彬,沈晓明,黄艳丽.血管性痴呆的中西医研究进展[J].中医研究,2020,33(1):71-74.
[7]朱世瑞,马云枝.从“毒损脑络”探讨血管性痴呆的机理[J].河南中医,2015,35(4):738-740.
[8]周流畅,庞喜乐,刘立瑾,等.辨证施治血管性痴呆研究进展与思考[J].中国中医药现代远程教育,2018,16(15):146-148.
[9]Thal DR,Grinberg LT,Attems J.Vascular dementia:different forms of vessel disorders contribute to the development of dementia in the elderly brain[J].Exp Gerontol,2012,47(11):816-824.
[10]崔远武,江丰,马妍,等.张伯礼教授治疗老年期痴呆经验[J].中华中医药杂志,2015,30(8):2783-2786.
[11]郭芳芳,陆晖.血管性痴呆的病因病机研究进展[J].中医临床研究,2017,9(29):138-141.
[12]李强,耿秀超,聂金涛,等.中医药治疗血管性痴呆研究概况[J].中医临床研究,2018,10(12):32-36.
[13]张风丽,范琳琳,李寒,等.《六因条辨》之黄连温胆汤临床运用浅析[J].湖南中医杂志,2018,34(11):106-107.
[14]姜浩,刘巧巧,余仁欢.黄连温胆汤现代研究进展[J].北京中医药,2014,33(4):314-316.
[15]杨小钰,黄海红,谌泽芳,等.脑缺血再灌注后炎症反应研究进展及中西医结合防治思路[J].中国现代医药杂志,2019,21(12):95-99.
[16]Evzelman MA,Mityaeva EV,Lashkhiia IB,et al.Acute cerebral ischemia and inflammation[J].Zh Nevrol Psikhiatr Im S S Korsakova,2019,119(12.Vyp.2):73-80.
[17]Lambertsen KL,Biber K,Finsen B.Inflammatory cytokines in experimental and human stroke[J].J Cereb Blood Flow Metab,2012,32(9):1677-1698.
[18]江高峰,秦旭平,李洁.免疫炎症反应在动脉粥样硬化中作用的研究进展[J].中南医学科学杂志,2015,43(2):212-216.
[19]Ferrer MD,Busquets-Cortés C,Capó X,et al.Cyclooxygenase-2 Inhibitors as a Therapeutic Target in Inflammatory Diseases[J].Curr Med Chem,2019,26(18):3225-3241.
[20]Yao C,Narumiya S.Prostaglandin-cytokine crosstalk in chronic inflammation[J].Br J Pharmacol,2019,176(3):337-354.
(2020-10-14收稿 責任编辑:杨觉雄)

