美洲黑杨×大青杨染色体制片优化及核型分析
马晓雨,刘焕臻,孙国语,易嘉欣,李开隆
(东北林业大学 林木遗传育种国家重点实验室,黑龙江 哈尔滨 150040)
杨树是杨柳科Salicaceae 杨属Populus高大乔木、具有生长快、分布广、品种多、易杂交、易改良、易无性繁殖等优良特点,在工业用材、环境绿化、生态防护和科学研究等领域发挥着重要作用。在杨树细胞遗传学研究中,染色体形态结构是最稳定的细胞学特征之一[2],染色体的观察也是细胞遗传学主要的研究内容。染色体制片技术是观察染色体的基础技术,完善的染色体制片方案可以为杨树的倍性鉴定、种间关系和系统分类等提供良好的技术支撑。
早在20世纪20年代,Blackburn 研究发现欧洲黑杨P.nigra染色体数目为2n=38。Kesara 等对两个地区欧洲山杨P.tremula染色体数目的研究结果也为38 条[3]。1978年我国学者对小青杨P.pseudo-simonii根尖染色体的制片技术进行了初步的研究,优化了杨树染色体根尖压片技术[4]。2004年陈成彬等对三倍体毛白杨P.tomentosa和三倍体黑杨核型进行了比较分析,发现不同品种杨树核型有显著差异[5]。2015年尹丽莎等对滇杨P.yunnanensis的染色体制片技术进行了优化[6]。近年来,已有一些染色体制片技术进行杨树染色体行为观察和倍性鉴定的研究,但由于杨树属于小染色体植物,且染色体数目较多,为杨树染色体制片增加难度,从而导致制片效果欠佳;并且不同杨树品种的最佳染色体制片方案也有所差异:毛白杨杂种三倍体茎尖采用V(浓HCL)∶V(乙醇)=1∶1 的混合液解离15 min 染色体制片效果较好[7];山海关杨P.deltoides‘Shanhaiguan’×新疆杨P.albavar.pyramida根尖解离采用1 mol/L 的盐酸60℃下解离10 min 能够得到用以鉴定其倍性的染色体图片[8]。目前关于美洲黑杨×大青杨杂交品种染色体制片优化的研究未见报道,且缺乏从染色体制片到核型分析的系统研究。本研究从根尖长度、预处理方法和解离方式3 个染色体制片主要影响因素分析比较,优化美洲黑杨P.deltoides×大青杨P.ussuriensis染色体制片技术,提高染色体制片效果,并进行系统的核型分析,为杨树系统发育和遗传育种等方面提供一定的细胞学水平的理论依据和技术基础。
1 材料与方法
1.1 试验材料
试验材料为美洲黑杨×大青杨组培苗的根尖。母本美洲黑杨采自辽宁省金城原种场,父本大青杨采自黑龙江省青山种子园。
1.2 试验方法
1.2.1 根尖培养和取材
嫩叶经0.1%氯化汞消毒,剪成1 cm2大小接种于分化培养基(MS+0.5 mg/L 6-BA+0.05 mg/L NAA)中,待幼苗生长高度达3 cm 时接种于生根培养基(1/2MS+0.3 mg/L IBA)中,待根生长分别达到0.5、1.0、1.5、2.0、2.5 cm 时,于9:00—10:00 剪取粗壮嫩根,取其根尖分别置于饱和对二氯苯溶液中0℃处理1 h,每个长度取20 条根尖。
1.2.2 预处理
预试验发现根发育至1.5 cm 时,其根尖分生区细胞分裂最为活跃,采用0.2%秋水仙素、饱和对二氯苯和两者1∶1 混合液3 种试剂分别对发育至1.5 cm 新生根的根尖进行预处理,于0℃下,分别处理1、2、3 h,每种预处理取20 条根尖。
1.2.3 固定
预处理后的根尖用蒸馏水冲洗3 次,转入现配的卡诺氏固定液(无水乙醇∶冰乙酸=3∶1)中4℃固定24 h。固定后,蒸馏水洗净根尖,置于70%乙醇中4℃保存备用。
1.2.4 染色体制片
采用1 mol/L 盐酸酸解法,根据以往研究显示,酸解法在60℃或25℃下能够取得较好解离效果[14,22]。本研究分别在25℃下酸解12、14、16、18 min,60℃下酸解6、8、10、12 min。酸解后蒸馏水冲洗5次,无菌滤纸吸干根尖表面水分,切取根尖分生区置于载玻片上,用卡宝品红染液染色9 min,然后进行常规压片,并用奥林巴斯(BX43)进行镜检。
1.2.5 核型分析
40 倍物镜下,统计中期分裂细胞及分散相较好细胞所占比例;100 倍油镜下,选取30 个以上染色体形态及分散良好分裂相进行染色体计数。选取5 个染色体形态轮廓清晰且无重叠的细胞进行核型分析。利用Adobe Photoshop 7.0.1 对染色体进行配对,迅捷CAD 编辑器进行染色体长度测定,Excel 2010 进行数据汇总和核型参数的计算。按李懋学等所提核型标准进行分析[9];着丝粒位置命名方式参照Levan 的方法[10];核型模式图按乔永刚等提出的方法[11]进行绘制。
2 结果与分析
2.1 染色体制片技术的优化
2.1.1 不同根发育长度对制片效果的影响
随着根长度的增加,中期细胞和适合核型分析的中期细胞所占比例均呈先增加后减少的趋势(表1)。在根生长至1.5 cm 时,中期细胞占比和适合核型分析的细胞占比均达到最高,分别为1.69%和15.56%;根长达0.5 cm 时,适合核型分析的细胞占比最低,为6.23%;根长达2.5 cm 时,中期细胞占比最低,仅为0.68%。结果表明,在根发育过长或过短时取样,制片效果均较差,因此,选择根长至1.5 cm 时进行取样,能够获得较多中期分裂相,利于核型分析。
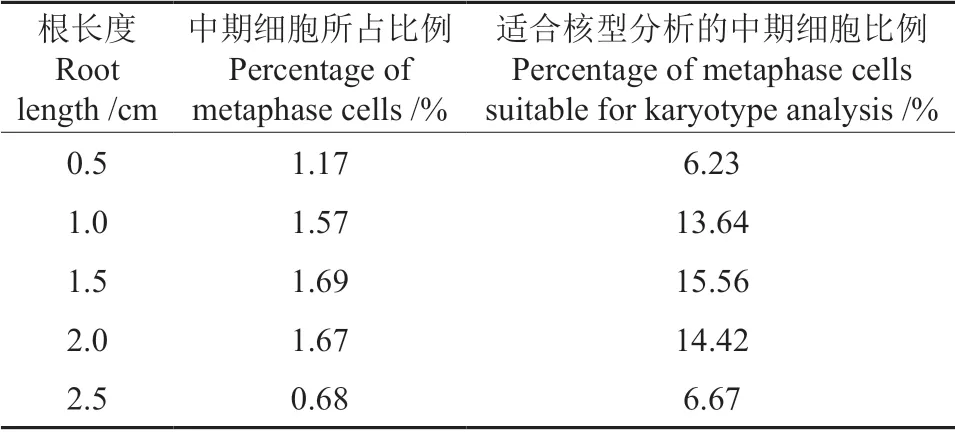
表1 不同根长对制片效果影响Table 1 Effect of different root length on chromosome preparation
2.1.2 不同预处理试剂对制片效果的影响
本研究采用3 种不同试剂0℃下对根尖进行预处理,对不同试剂和预处理时间下制片效果进行统计(表2)。结果显示,对二氯苯饱和水溶液处理效果最好,中期细胞总占比达到7.54%,且其中,预处理2 h 时染色体制片效果最佳,中期细胞比例为3.26%,得到的染色体形态轮廓清晰且分散良好,长度适宜(图1E);其次采用混合液(对二氯苯饱和水溶液∶0.2%秋水仙素溶液=1∶1)和0.2%秋水仙素溶液进行预处理时,得到的中期细胞总占比相差不多,分别为3.63%和3.43%,且其中,0.2%秋水仙素溶液预处理1 h 时,获得的染色体清晰,分散较好,长度适宜;相同试剂预处理下,预处理时间过长均会对染色体形态产生一定影响,出现轮廓模糊,粘连拖尾等情况(图1C、F,图1I)。综合上述结果,选择对二氯苯饱和水溶液作为预处理试剂,0℃下预处理2 h,能够获得较多的中期细胞,且染色体形态最好,是本研究中的最佳预处理方案。
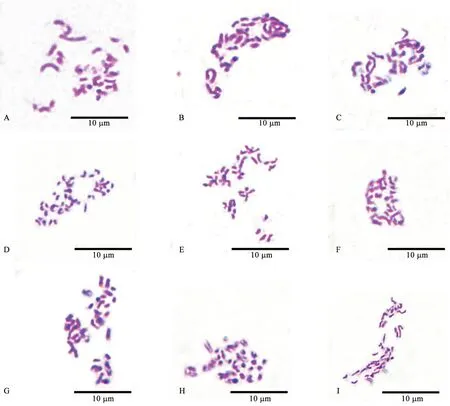
图1 不同预处理方式对制片效果的影响Fig.1 Effect of different pretreatment methods on chromosome preparation
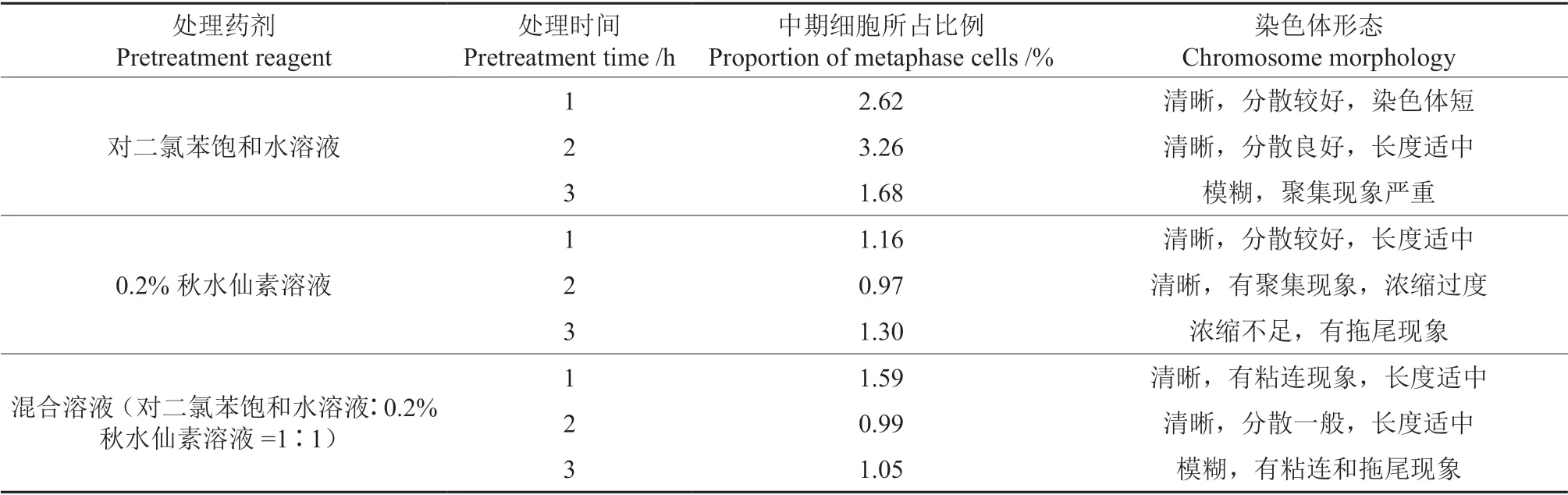
表2 不同预处理方式对制片效果的影响Table 2 Effect of different pretreatment methods on chromosome preparation
2.1.3 不同解离温度和时间对制片效果的影响
图2为不同解离温度和时间下镜下染色体制片效果,结果显示,不同解离时间和解离温度对染色体制片有显著影响。60℃下解离6 min 时,细胞质着色,有细胞壁残留,染色体形态不清晰,且重叠较多不分散(图2A);解离8 min 时,细胞质着色较浅,无细胞壁残留,染色体部分粘连,形态清晰(图2B);解离10 min 时,几乎无杂质残留,对比度高,染色体形态清晰,分散良好(图2C);解离12 min 时,染色体分散性好,但由于解离过度导致细胞破裂,染色体丢失(图2D)。综上,60℃下解离10 min 时,染色体制片效果最佳。
25℃下解离12 min 时,细胞质着色,细胞壁残留,染色体形态模糊堆叠(图2E);解离14 min 时,细胞质着色,少量细胞壁残留,染色体形态较清晰,但粘连重叠较多(图2F);解离16 min 时,无杂质,对比度高,染色体形态清晰且着色效果好,但分散性一般(图2G);解离18 min 时,对比度高,染色体形态清晰着色效果好,分散性良好(图2H)。综合不同解离时间和温度对染色体制片影响的结果,60℃解离10 min 和25℃解离18 min 均能达到较好染色体制片效果。
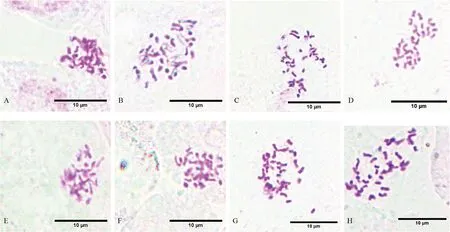
图2 不同解离温度和时间对制片效果的影响Fig.2 Effect of different acidolysis time and temperature on chromosome preparation
2.2 染色体核型分析
通过对美洲黑杨×大青杨杂种的染色体核型参数(表3)和中期分裂相、核型及其模式图(图3)分析,结果表明:核型公式为2n=2x=38=32m+6sm,其中16 对为中部着丝点染色体,3 对为近中部着丝点染色体,在第3 对染色体短臂上附有随体;染色体相对长度在1.35%~4.37% 之间,臂比值在1.05%~1.87% 之间,着丝点指数在34.88%~48.76% 之间,染色体相对长度组成为2n=8L+10M2+10M1+10S;最长染色体与最短染色体相对长度之比为3.24,没有臂比值大于2 的染色体,核型不对称系数为56.61%,为1B 核型。

图3 美洲黑杨×大青杨染色体中期分裂相(A)、核型图(B)及模式图(C)Fig.3 Metaphase map (A)、karyogra (B) and idiogram (C) of P.deltoides × P.ussuriensis chromosome
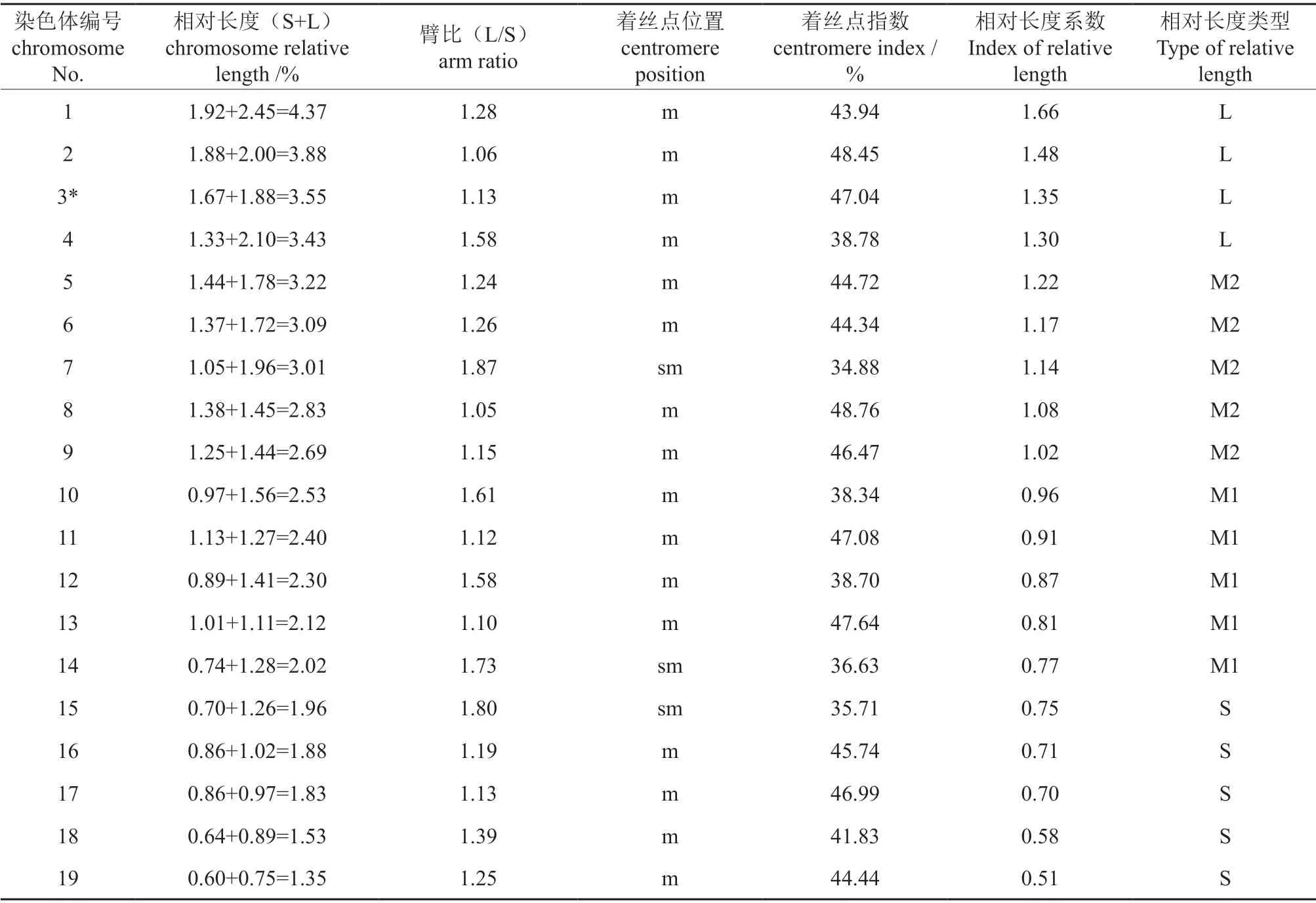
表3 美洲黑杨×大青杨杂种染色体核型参数†Table 3 Parameters of chomosome karyotype of P.deltoides × P.ussuriensis
3 结论与讨论
3.1 讨 论
3.1.1 不同根长度对制片效果的影响
植物染色体制片是植物细胞学的基础技术之一,影响染色体制片效果的因素较多,其中取材、预处理方式和解离条件是较为关键的影响因素[12]。植物根尖分生区细胞分裂旺盛、细胞壁较薄,且根尖易培养、不受外界环境限制,是最为常用的染色体制片材料,其中根尖长度对中期分裂相的数量有着显著影响[13]。根尖细胞分裂活跃性的差异不仅取决于不同的植物根尖特征,也会因同一植物不同根尖培养方式而有所区别。构树Broussonetia papyrifea种子的胚根长度达1.0 cm时,其根尖有丝分裂指数最高,根过长或过短得到的分裂相均较少[14];人参Panax ginseng组培苗诱导根尖长至2 cm,水培根尖长至1 cm,种子根尖长至1.5 cm 时,中期分裂相较多[15];小青杨种子胚根伸长至0.5 cm 时取其根尖,能够得到较好制片效果[4]。正常土壤中生长的根在水培条件下,不易产生根冠,根尖分生区细胞得不到保护,在试验处理过程中易受损或丢失。本研究对组培苗新生根进行取材,根尖生长环境更加稳定,得到的根尖结构完整。取材时发现,随根长度的增加,根尖逐渐变细,根长为0.5 cm 时,根尖形态短粗,难以截取分生区部分;根长达2.5 cm 时,根尖形态细长,根尖分生区,处理时易折断,导致制片效果不佳;根长度1.5 cm 时,根尖粗细均匀,长度适宜,此时取样得到的中期分裂相细胞最多,染色体制片效果最好,这一结果与已有滇杨[16]和金盏菊[17]的相关研究结果一致。
3.1.2 不同预处理试剂对制片效果的影响
预处理方式是决定染色体制片质量的关键因素,该过程目的是破坏纺锤体的形成,阻止细胞继续分裂而使其停在中期,增加中期分裂相的出现概率[13]。目前常用的预处理试剂主要有8-羟基喹啉、秋水仙素、饱和对二氯苯水溶液。预处理试剂和预处理时间因试验材料不同而有所差异。山杨P.davidiana经0.002 mol/L 的8-羟基喹啉处理4~5 h 能够获得较好制片效果[18];桉树Eucalyptus urophylla×Eucalyptus grandis经过0.2%秋水仙素处理2 h 取得的制片效果最好[19];滇杨在0℃下用对二氯苯饱和水溶液处理1 h 获得的染色体图像清晰,着色最好[6]。染色体大小是固定因素,它决定了预处理时间的长短,由于杨树染色体较小,预处理时间不宜过长,一般1~2 h为宜,同时,预处理时间也会因为不同植物品种的耐药性而有所差异[20]。本研究发现,采用对二氯苯饱和水溶液0℃下处理2 h,获得中期分裂相最多,染色体制片效果最好,这一结果与前人对滇杨的最佳预处理温度和试剂一致,但最佳处理时间不同。可能由于本研究所用美洲黑杨×大青杨的亲本均为适宜北方生长环境的杨树品种,而滇杨虽与大青杨同为青杨派,但主要分布于川、黔、滇等南方地区,可见生长环境与品种的差异是决定最佳预处理方式的关键因素,本研究也为黑杨派和青杨派及北方杨树品种染色体制片和观察提供了具有一定针对性的技术参考。
3.1.3 不同解离温度和时间对制片效果的影响
常用解离方法有酶解法和酸解法,其目的是软化和分解细胞壁,便于压片和染色体观察[21]。解离时间的掌控是染色体制片中十分重要的一步,时间过短,细胞壁和细胞质残留,染色体不易分散,染色效果不佳;时间过长,导致细胞破裂,染色体受损或丢失。不同材料最适解离方法也所不同,张俊等[22]对萱草属Hemerocallis植物根尖染色体制片技术进行研究时发现,同一解离液和解离温度下,不同萱草属的植物其解离时间也有一定差异,总结得出1 mol/L 的HCl 在60℃下解离7~8 min为宜;响叶杨P.adenopoda在盐酸∶乙醇=1∶1 的解离液中常温下解离25 min 可以获得较好的染色体制片效果[23]。本研究发现,美洲黑杨×大青杨杂种的根尖采用1 mol/L 的HCl 在60℃下解离10 min 和25℃下解离18 min 均能获得清晰且分散性好的染色体图像,该结果与构树[14]、橡胶草[24]等研究结果一致。
3.1.4 染色体核型分析
染色体核型分析是细胞遗传学的基本技术之一[25],包括染色体数目统计和染色体形态结构分析,其在植物起源、分类和演化研究中占有重要位置。本研究首次对美洲黑杨×大青杨进行核型分析,得出其染色体数目38 条,染色体基数为19,为二倍体,该结论与已有的关于杨树染色体的研究结果相吻合[26]。染色体核型为2n=2x=38=32m+6sm,这与已研究的杨树其他品种核型有一定差异,例如河北杨P.hopeinsis染色体核型为2n=26m+6sm+6st[27];小青杨染色体核型为2n=27m+6sm+4st+1t[28],这种差异可能与杨树品种、生境和染色体制片方法的不同有关。也可能因为种间的杂交使染色体核型发生变异[29],但本研究结果显示美洲黑杨×大青杨的大多数染色体均为中部着丝点染色体和近中部着丝点染色体,该结果与前人研究结果相符。植物的进化趋势是由对称向不对称发展,说明核型不对称系数越大,植物的进化程度越高,在已有的杨树核型报道中,欧洲山杨、大叶杨P.lasiocarpa、小叶杨P.simonii、箭杆杨P.nigravar.thevestina、胡杨P.euphratica核不对称系数分别为65.79%、62.33%、61.36%、58.14%、63.03%[30]。本研究结果显示美洲黑杨×大青杨核不对称系数为56.61%,在杨树品种中属于核型较对称的原始类型,说明其起源相对较早。本研究对美洲黑杨×大青杨染色体制片技术进行了优化,对其染色体形态结果进行了分析,为杨树品种间亲缘关系、倍性鉴定、优良品种的选育等方面提供了细胞学上的技术支持。以往研究表明杂交可使染色体核型发生变异,本研究仅对美洲黑杨×大青杨核型进行了分析,与其亲本核型间差异还未做进一步研究。今后可以对亲本美洲黑杨和大青杨核型进行研究并与已有杂种核型进行比较分析,为杨树杂交后代变异研究提供细胞学上的理论依据。
3.2 结 论
优化的美洲黑杨×大青杨染色体制片方案为:取1.5 cm 长根的根尖,用对二氯苯饱和水溶液在0℃下预处理2 h,卡诺氏固定液固定24 h 后,在1 mol/L 盐酸60℃下酸解10 min 或25℃下酸解18 min,最后用卡宝品红染液染色9 min。核型分析得出:美洲黑杨×大青杨染色体数目为2n=38,基数为19,为二倍体,核不对称系数为56.61%,核型属于较原始的对称类型。

