大蒜气生鳞茎形态发生及其碳水化合物和内源激素含量以及相关基因表达的变化特征
彭怡琳,刘 敏,蒋芳玲,李梦倩,张 蒙,吴 震*
(1 南京农业大学 园艺学院,南京 210095;2 农业部华东地区园艺作物生物学与种质创新重点实验室,南京 210095)
大蒜(AlliumsativumL.)又名蒜、葫蒜,属于百合科葱属二年生草本植物[1]。大蒜通常利用蒜瓣进行无性繁殖,导致病毒逐年积累并代代相传,造成种性逐渐退化,产量、品质下降。栽培大蒜虽不能结种,但其花茎顶部的总苞开裂后,花序基部可形成小鳞茎,也称气生鳞茎,并有研究发现大蒜气生鳞茎可作为提纯复壮的繁殖材料[2]。前人对大蒜器官形态解剖特征的研究多集中在蒜薹、花芽和地下鳞茎[3-7],大蒜气生鳞茎发育的形态解剖研究尚无报道。此外,有研究表明大蒜花败育可能与气生鳞茎相关[8]。因此,明确大蒜气生鳞茎形成及形态解剖特征,有助于揭示大蒜气生鳞茎分化机制和花器官发育情况。
碳水化合物和内源激素参与鳞茎形成的研究国内外均有报道。Shin等[9]研究发现,蔗糖是百合植株碳水化合物长距离运输至鳞茎的主要形态;郭洪云[10]研究认为,在大蒜鳞茎成熟过程,单糖转化为双糖贮存;刘秀慧[7]对8个不同发育时期的大蒜鳞茎进行转录组测序分析发现,淀粉和蔗糖代谢以及激素转导相关基因参与大蒜鳞茎发育;Hideaki等[11]研究表明,能形成鳞茎的洋葱中叶鞘茉莉酸(JA)总量是不能形成鳞茎的洋葱的3倍多。咸丰[12]研究证实,水杨酸(SA)处理能促进大蒜鳞茎膨大并改善大蒜鳞茎品质。大蒜气生鳞茎形成过程中碳水化合物和内源激素含量的变化规律是否与这些研究结果一致,有待深入研究。
本研究以中早熟薹用品种‘二水早’、中晚熟薹瓣兼用品种‘麻江红蒜’以及晚熟瓣用品种‘徐州白’为供试材料,对大蒜气生鳞茎形成过程进行形态解剖、碳水化合物和内源激素含量变化以及相关基因表达研究,旨在明确大蒜气生鳞茎形成规律,为进一步揭示大蒜气生鳞茎的发育机制和栽培调控提供研究资料。
1 材料和方法
1.1 植物材料与栽培
供试植物材料为成熟期不同的3个大蒜品种:中早熟薹用品种‘二水早’(Ershuizao),中晚熟薹瓣兼用品种‘麻江红蒜’(Majianghongsuan),晚熟瓣用品种‘徐州白’(Xuzhoubai)。首先在1 L水中溶解0.3 g的磷酸二氢钾和多菌灵作为消毒液,挑选健康无伤、大小一致的蒜瓣,在消毒液中浸泡8 h,再用清水浸泡24 h。处理过的蒜瓣于2018年10月7日种植于江苏省农博园(句容市),采用高畦栽培,畦宽2 m,畦长4 m,行株距为20 cm×10 cm,种植后覆土1 cm并采用白色地膜覆盖,生长期间按常规栽培管理。
1.2 测定项目与方法
1.2.1 气生鳞茎形态和解剖结构观察播种130 d后,当大蒜长至5或6片叶时,每隔7 d取样1次,共取15次,每次均取生长正常的大蒜10株;在植株抽薹前,其中4株剥去幼叶,将0.5 cm茎尖保存在FAA固定液(V70%酒精∶V冰醋酸∶V甲醛=90∶5∶5)中,另外6株在LeicaM165体式显微镜下解剖并拍照,观察茎尖生长点的变化;当植株抽薹后,取蒜薹,其中4根剥去总苞叶,用消毒刀片切取总苞保存于FAA固定液,另外6株在LeicaM165体式显微镜下解剖并拍照,观察花序轴的变化。
石蜡切片的制作参考吴泽秀[5]的方法,将FAA固定液中材料取出,依次进行脱水、透明、浸蜡、包埋、切片、展片、脱蜡、染色、封片等步骤,制作成石蜡切片,最后用Leica DM6 B正置显微镜观察气生鳞茎形态结构,并拍照记录。
1.2.2 可溶性糖、蔗糖、淀粉以及内源激素含量测定以‘麻江红蒜’为供试材料,当植株抽薹后,每隔7 d取样1次,共取8次。剥去总苞叶去除小花和苞片,切取花序轴表皮1 mm及以上部分。3次生物学重复,每重复2株,共取6株。根据形态和解剖结构观察划分大蒜气生鳞茎形成时期,选择不同时期的样品用于相关指标测定,可溶性糖、蔗糖以及淀粉含量测定均参考薛应龙的方法[13]。植物内源激素IAA、ZR、ABA、ETH、JA和BR含量测定参考WU的方法[14]。样品液氮速冻后研磨成粉末,迅速转移至10 mL离心管中,干冰保存,送由中国农业大学农学与生物技术学院化控中心测定。
1.2.3 碳水化合物代谢和内源激素信号转导相关基因表达分析选取‘麻江红蒜’不同时期的样品,使用Trizol试剂(Invitrogen, CA, 美国)提取总RNA,并用Bioanalyzer 2100和RNA 6000 Nano LabChip Kit(Agilent, CA, 美国)检验RNA的质量和纯度,经检验合格的RNA用于碳水化合物代谢和内源激素信号转导相关基因的荧光定量分析。茉莉酸信号转导基因JAZ根据转录组数据筛选,利用primer 5.0(Primer-E Ltd., Plymouth, 英国)设计RT-qPCR引物,其他基因引物设计参考文献进行[15-17],内参基因采用UBQ,相关基因名称及其具体引物序列见表1。利用2-ΔΔCt法计算基因的相对表达量。PCR反应程序:95 ℃预变性10 min,95 ℃变性15 s,60 ℃退火30 s,40个循坏。熔解曲线制作:95 ℃ 15 s,60 ℃ 1 min,起始温度60 ℃,终止温度95 ℃,每秒温度上升0.15 ℃。

表1 碳水化合物代谢和内源激素信号转导相关基因的qRT-PCR引物
1.3 数据处理
利用SPSS 25.0软件对数据进行方差分析,并用Duncan检验法进行差异显著性(P<0.05)检验。采用GraphPad Prism 8绘图。
2 结果与分析
2.1 大蒜气生鳞茎形成过程分期及其形态解剖特征
对‘二水早’、‘麻江红蒜’和‘徐州白’3个品种大蒜气生鳞茎形成过程进行观察,根据大蒜茎尖生长点的形态解剖特征和气生鳞茎发育特点,将大蒜气生鳞茎形成过程划分为启动期、气生鳞茎原基分化期(包括保护叶原基、贮藏叶原基分化)、气生鳞茎膨大期和气生鳞茎成熟期4个时期。3个品种大蒜气生鳞茎在相同发育时期的形态和解剖特征一致,现以‘二水早’为例,说明气生鳞茎形成过程中的形态解剖特征(图1、2)。
2.1.1 气生鳞茎形成启动期越冬后,大蒜植株新叶重新萌发,茎尖生长锥呈半球形(图1,a和图2,a),生长锥两侧突起形成叶原基,一对互生的叶原基不断分化形成幼叶,幼叶相互折叠抱合(图2,a和b)。花序原基形成后,半圆形的花序轴顶端分生组织细胞分裂旺盛,逐渐形成小突起(图2,c),进而纵向伸长形成小花原基(图1,b和图2,c)。由于其顶端细胞分裂旺盛,顶端变扁平加宽,外围开始分化为雄蕊原基,中心形成雌蕊原基(图1,c和图2,d)。同时,花序轴周围分生组织分化产生小突起(图2,e和f),标志着气生鳞茎原基分化的开始。

a.启动期植株茎尖;b、c. 启动期花序轴;d、e. 气生鳞茎原基分化期花序轴(红色箭头示缺刻);f. 膨大期气生鳞茎;g. 成熟期气生鳞茎;h. 膨大结束后花序轴;i. 成熟期花序轴。Ba.背部;Be.腹部;Br.苞片;FB.花芽;FP.花原基;GL.发芽叶;LP.叶原基;PL.保护叶;PP.雌蕊原基;SL.贮藏叶;SP.雄蕊原基;T.气生鳞茎;VM.营养分生组织图1 大蒜气生鳞茎形成过程中不同时期植株茎尖、花序轴以及气生鳞茎的形态特征(‘二水早’品种)a. Stem tip at start-up stage; b, c. Inflorescence axis at start-up stag; d, e. Inflorescence axis at topset primordium differentiation stage (The red arrow indicates notch shape.); f. Topset at expansion stage; g. Topset at mature stage; h. Inflorescence axis after expansion; i. Inflorescence axis at mature stage. Ba Backside; Be Belly; Br. Bract; FB. Flower bud; FP. Flower primordium; GL. Germinated leaf; LP. Leaf primordium; PL. Protected leaf; PP. Pistil primordium; SL. Storage leaf; SP. Stamen primordium; T. Topset; VM. Vegetative meristemFig.1 Morphology features of stem tip, inflorescence axis and topset during different stages (‘Eeshuizao’)
2.1.2 气生鳞茎原基分化期小突起顶端细胞分裂旺盛,染色加深(图2,f),逐渐分化呈透明球状(图1,d)。随后球状突起周围形成保护叶原基(图1,d和图2,g),保护叶原基表面有缺刻(图1,d)。观察气生鳞茎原基的纵切面(图2,g),由于保护叶原基细胞分化水平不同,较快发育的一侧形成气生鳞茎的背部,另一侧为腹部(图1,g和图2,g、h)。接着,又以相同的方式形成贮藏叶(图2,i)。从花序轴横切面(图2,j)可以看到逐渐形成的维管束。
2.1.3 气生鳞茎膨大期气生鳞茎的保护叶和贮藏叶分化完成后,其内细胞膨大,原形成层中分化出维管束(图2,k)。从气生鳞茎的横切面(图2,k)和纵切面(图2,l)观察发现,保护叶和贮藏叶之间存在空隙,随着细胞的不断分裂,空隙减少。膨大终期时,白色的气生鳞茎充满整个花序轴,形态饱满(图1,h),对其形态解剖观察发现,半圆形的分生组织两侧陆续突起产生发芽叶(图1,f和图2,m)。
2.1.4 气生鳞茎成熟期剥去总苞叶,气生鳞茎保护叶由白色逐渐转变为紫色(图1,h和i),气生鳞茎开始进入成熟期。此时,花序轴上的气生鳞茎膨大结束,苞片和小花逐渐枯萎(图1,i)。对气生鳞茎进行纵切,其剖面最外层为膜质化保护叶,中部为贮藏叶,肉质肥厚,最里面是发芽叶(图1,g)。
2.2 大蒜气生鳞茎形成进程品种间比较
对3个品种大蒜气生鳞茎形成进程观察比较发现:不同熟期品种气生鳞茎形成过程相同,均可划分为启动期、气生鳞茎原基分化期、气生鳞茎膨大期和气生鳞茎成熟期4个时期,但它们进入气生鳞茎原基分化期的时间以及每个阶段所持续的时间受到品种熟期的影响存在一定的差异(表2)。其中,中早熟薹用品种‘二水早’气生鳞茎原基最早分化(从3月16日开始分化),植株新叶重新萌发到气生鳞茎原基分化持续了29 d;中晚熟薹瓣兼用品种‘麻江红蒜’气生鳞茎原基分化较晚(从4月7日开始分化),启动期持续了37 d;晚熟瓣用品种‘徐州白’气生鳞茎原基分化最晚(从4月20日开始分化),启动期持续了41 d。同样,‘二水早’气生鳞茎成熟也最早,5月8日开始成熟。除‘二水早’气生鳞茎原基分化期与气生鳞茎膨大期持续时间相近,其他2个品种膨大期持续时间长于原基分化期。另外,观察气生鳞茎原基开始分化时,3个品种大蒜总苞叶尖均刚露出叶鞘,‘二水早’叶片数为7~8片,‘麻江红蒜’叶片数为8~9片,‘徐州白’叶片数为9~10片。
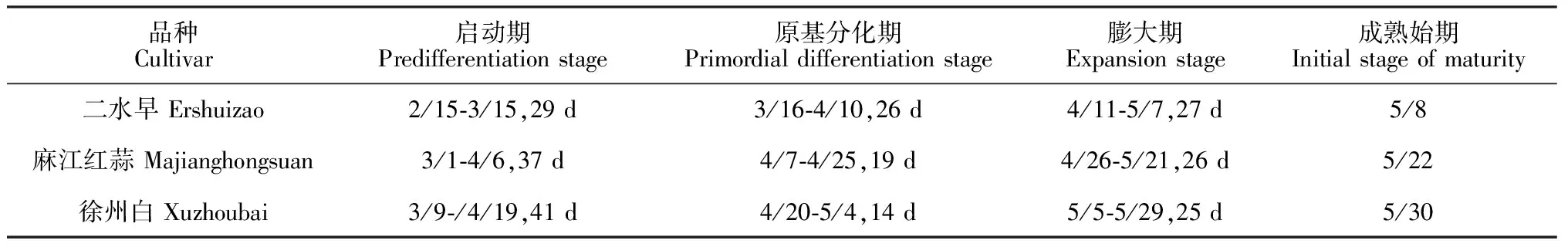
表2 3个品种大蒜气生鳞茎形成进程比较(月/日,天数)
2.3 大蒜气生鳞茎形成过程中相关生理生化指标的动态变化
2.3.1 可溶性糖、蔗糖、淀粉含量大蒜品种‘麻江红蒜’气生鳞茎可溶性糖和蔗糖含量在其形成过程中均表现出先上升后下降的变化趋势,两者在分化时期之间均显著差异(图3)。其中,气生鳞茎可溶性糖和蔗糖含量在膨大开始时达到最高值,分别为441.4和140.7 mg/g,为气生鳞茎的膨大做准备;气生鳞茎开始膨大后,可溶性糖和蔗糖含量急剧下降,在成熟期分别降至332.4和91.6 mg/g,这表明气生鳞茎膨大需要消耗大量的可溶性糖和蔗糖。另外,淀粉是气生鳞茎的储能物质,其含量从气生鳞茎原基分化开始呈直线型上升趋势,并在成熟期达到最高值(194.3 mg/g)。

图中不同字母表示分化时期间在0.05水平差异显著(P<0.05),下同图3 大蒜气生鳞茎形成过程中可溶性糖、蔗糖和淀粉含量的变化Different letters in the graph indicate significant difference among stages at 0.05 level, the same as belowFig.3 Changes of soluble sugar, sucrose and starch contents during the development of garlic topset
2.3.2 内源激素含量大蒜气生鳞茎形成过程中,其中的内源激素含量因种类不同而表现出不同的变化趋势(图4)。其中,气生鳞茎IAA、GA3和MeJA含量在其形成过程中均呈下降趋势,但有一定差异。IAA含量在气生鳞茎膨大初期显著降低,并在成熟期降至最低值(15.58 ng/g);GA3和MeJA含量分别从气生鳞茎原基分化期和膨大初期开始下降,并在成熟期分别降至2.5 ng/g和7.8 ng/g。气生鳞茎ABA含量从启动期到成熟期呈上升趋势,在成熟期达到最高值(78.1 ng/g)。ZR含量从气生鳞茎原基分化期开始下降,至膨大中期达到最低值(3.8 ng/g),随后在成熟期显著上升至4.6 ng/g,与膨大前期持平。气生鳞茎BR含量从启动期到膨大初期无显著性变化,在膨大中期显著降低至最低值2.2 ng/g,随后在成熟期显著上升至2.9 ng/g。
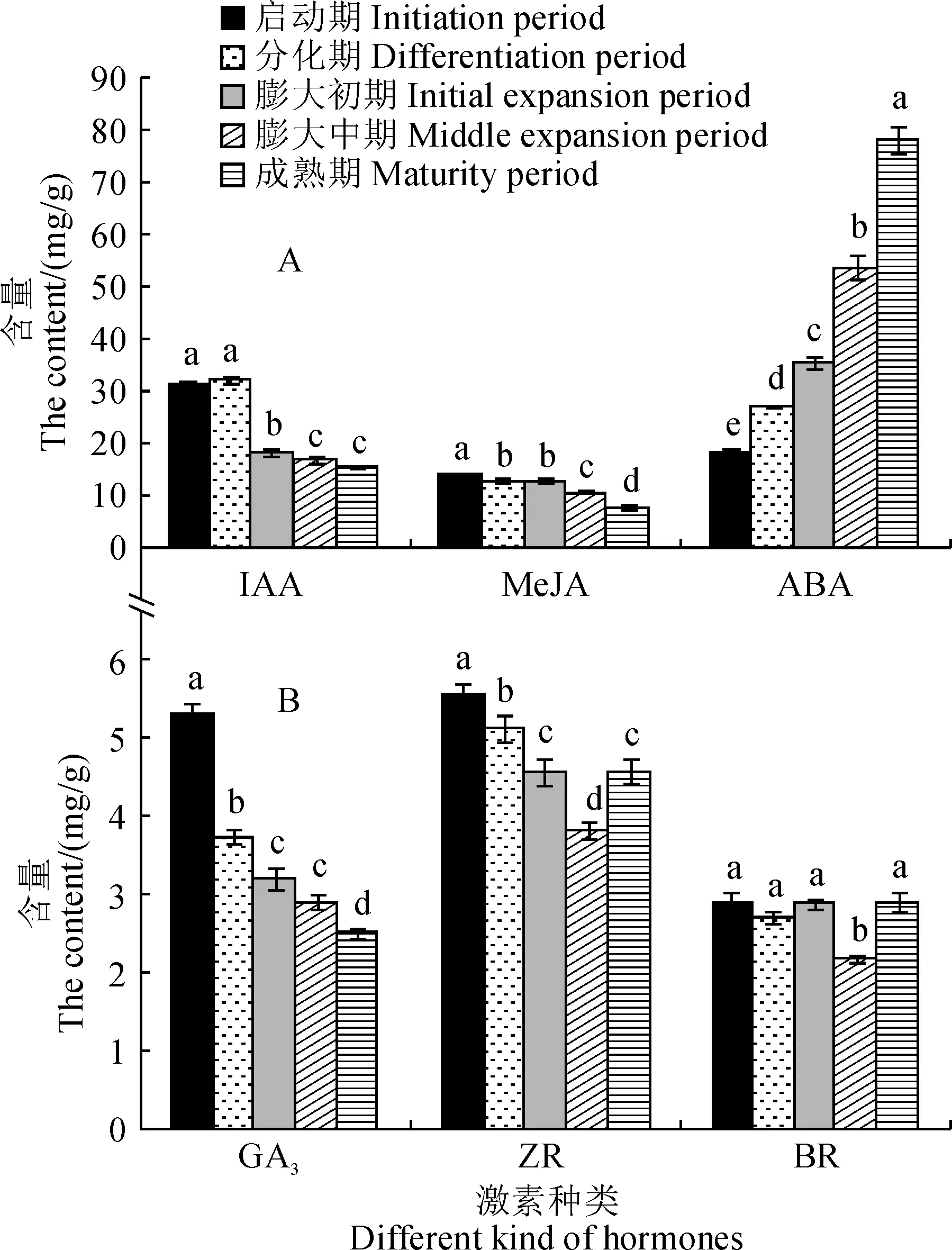
图4 大蒜气生鳞茎形成过程中内源激素含量的变化Fig.4 Changes of endogenous hormone contents during the development of garlic topset
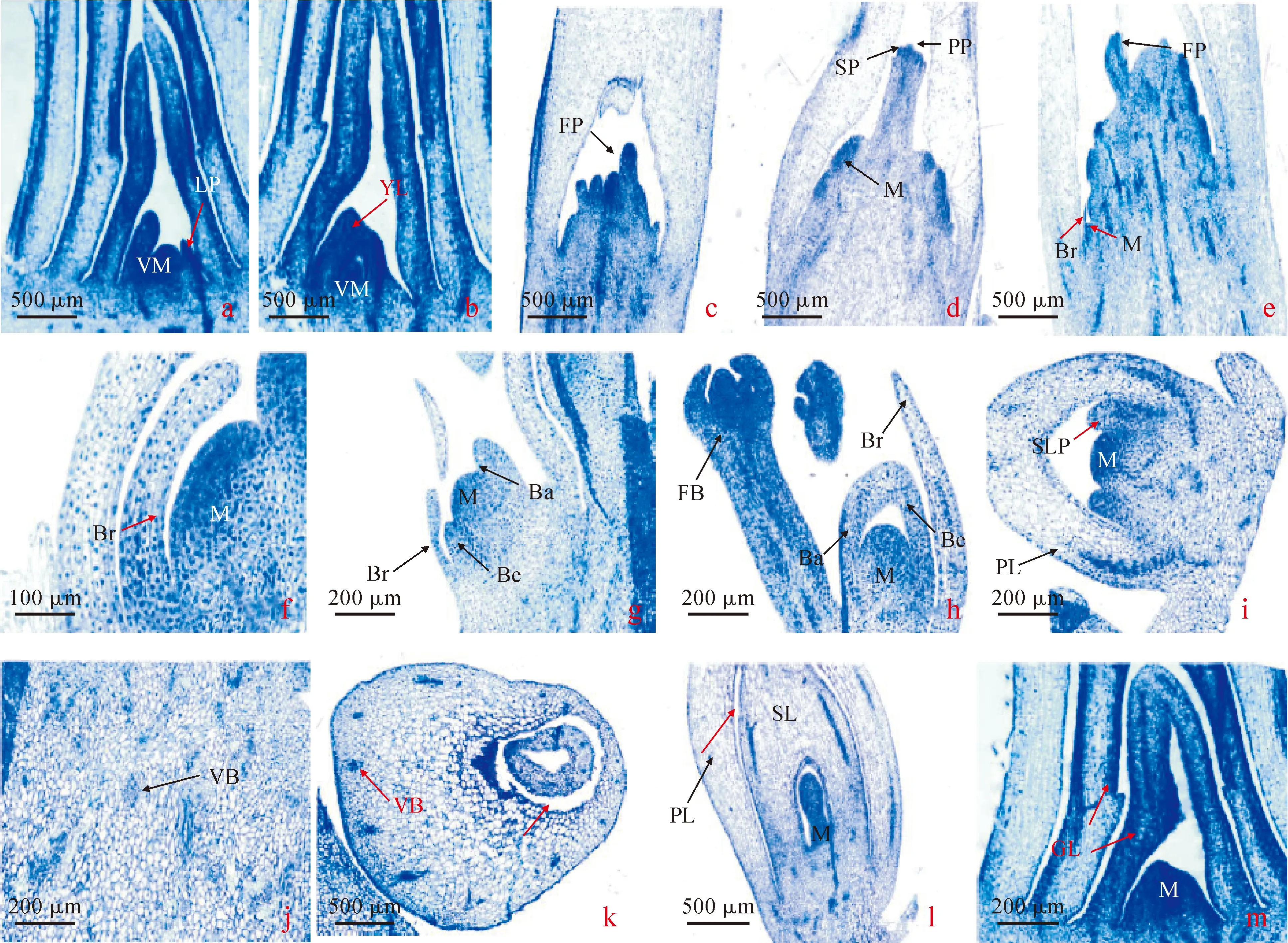
a-b. 启动期植株茎尖;c-f. 启动期花序轴;g-i. 分化期气生鳞茎原基;j. 分化期花序轴横切面;k. 膨大期气生鳞茎横切面;l. 膨大期气生鳞茎纵切面;m. 膨大期气生鳞茎发芽叶。 Ba.背部;Be.腹部;Br.苞片;FB.花芽;FP.花原基;GL.发芽叶;M.分生组织;PL.保护叶;PP.雌蕊原基;RM.生殖分生组织;SLP.贮藏叶原基;SP.雄蕊原基;VB.维管束;VM.营养分生组织;YL.幼叶图2 大蒜气生鳞茎形成过程不同时期植株茎尖、花序轴以及气生鳞茎的解剖特征(‘二水早’)a-b. Stem tip at start-up stage; c-f. Inflorescence axis at start-up stage; g-i. Topset primordium at primordium differentiation stage; j. The inflorescence axial transverse section at primordium differentiation stage; k. Transverse section of topset at expansion stage; l. Longitudinal section of topset at expansion stage; m. Germinated leaf of topset at expansion stage. Ba. Backside; Be. Belly; Br. Bract; FB. Flower bud; FP. Flower primordium; GL. Germinated leaf; M. Meristem; PL. Protected leaf; PP. Pistil primordium; RM. Reproductive meristem; SLP. Storage leaf primordium; SP. Stamen primordium; VB. Vascular bundle; VM. Vegetative meristem; YL. Young leafFig.2 Morphological features of stem tip, inflorescence axis and topset during different stages (‘Eeshuizao’)
2.4 大蒜气生鳞茎形成过程中相关基因差异表达动态变化分析
2.4.1 碳水化合物代谢相关基因对大蒜气生鳞茎形成过程中碳水化合物代谢相关基因进行荧光定量分析,结果如图5所示。首先,1-果聚糖水解酶基因(1-FEH)相对表达量从气生鳞茎启动期逐渐增加,在膨大中期达到峰值,是启动期的20.07倍;随后在成熟期显著降低,相对表达量仅是启动期的32%。
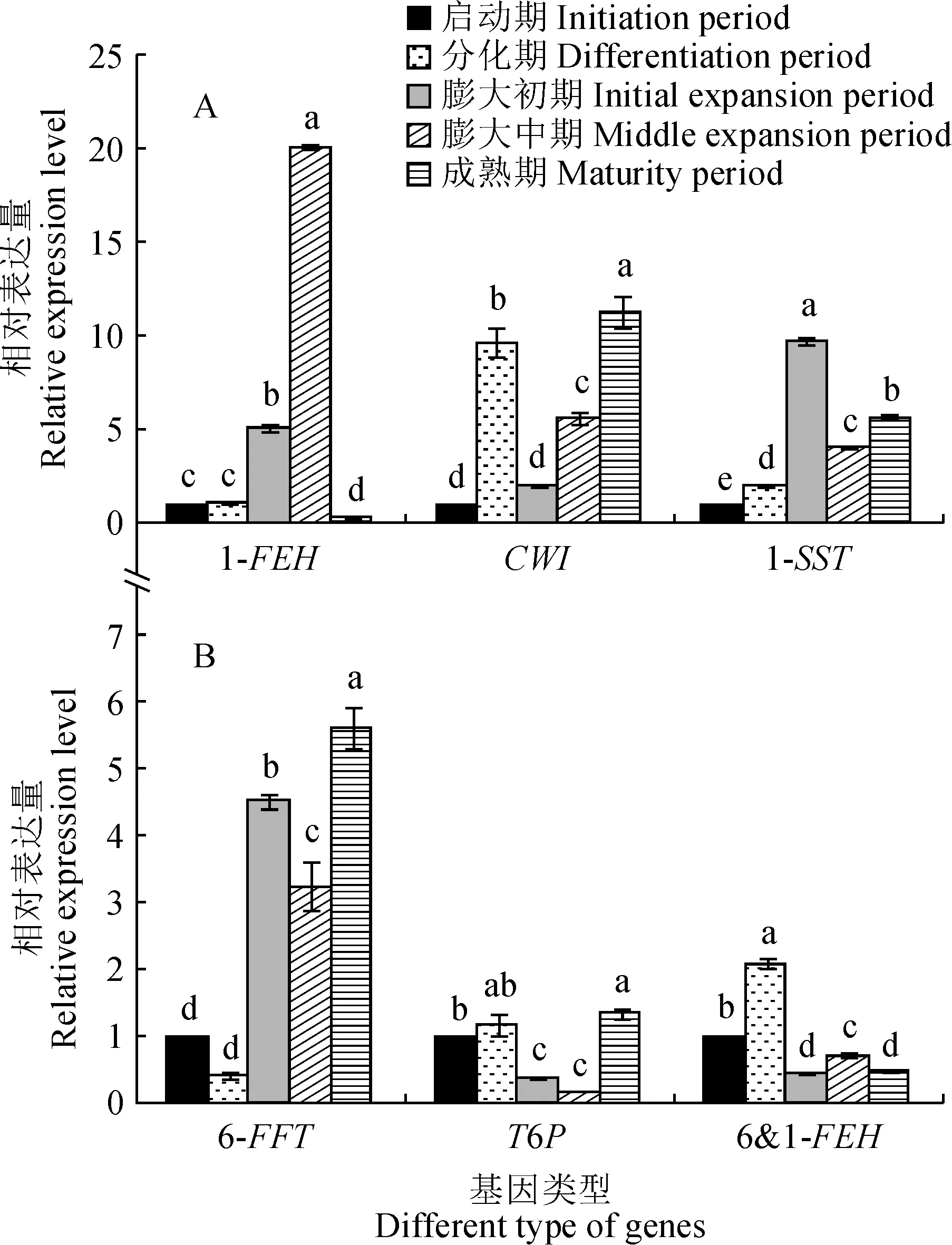
图5 大蒜气生鳞茎形成过程中碳水化合物代谢相关基因表达量变化Fig.5 Changes of carbohydrate metabolism related gene expression during the development of garlic topset
其次,细胞壁转移酶基因(CWI)、蔗糖1-果糖基转移酶基因(1-SST)和果聚糖6-果糖基转移酶基因(6-FFT)相对表达量在气生鳞茎形成整个过程均呈先上升再下降后上升的动态变化。CWI相对表达量在气生鳞茎原基分化期显著升高,是启动期的9.6倍;在膨大初期相对表达量显著下降,是启动期的2.02倍;后又随着气生鳞茎的膨大而显著上升,于成熟期达到最高值,是启动期的11.29倍。1-SST和6-FFT相对表达量均在膨大初期显著升高,分别是启动期的9.68倍和4.5倍。
再次,海藻糖-6-磷酸合成酶(T6P)相对表达量在膨大初期显著下降,是启动期的16%;在成熟期,T6P相对表达量显著升至最高,是启动期的1.35倍。
而6-1-果聚糖水解酶基因(6&1-FEH)的相对表达量在整个过程呈‘双峰’型变化。在气生鳞茎原基分化期,其相对表达量显著升高达到最高值,是启动期的2.08倍;在膨大开始时降至最低值,仅是启动期的45%;在气生鳞茎膨大中期,6&1-FEH相对表达量显著升高,而在成熟期显著下降至膨大初期水平。
2.4.2 内源激素信号转导相关基因对气生鳞茎形成过程中内源激素信号转导相关基因进行荧光定量检测,结果如图6所示。生长素信号转导相关基因ARF1、乙烯信号途径中的基因ETR、细胞分裂素信号转导相关基因ARR-B、脱落酸信号转导相关基因PP2C以及油菜素内酯信号转导基因CYCD的表达量在气生鳞茎形成过程中均呈先上升后下降再上升的动态变化。其中,ARF1和ETR相对表达量均在气生鳞茎膨大中期最低,分别是启动期的78%和70%;在成熟期,ARF1相对表达量显著升高,是启动期的2.24倍,ETR相对表达量也显著升高至膨大初期的水平。ARR-B相对表达量在气生鳞茎原基分化期显著升高,是启动期的2.3倍;在膨大初期,其相对表达量显著降低至最低值,是启动期的56%;后随着气生鳞茎膨大显著持续上升,其相对表达量至成熟期时是启动期的3.9倍。PP2C和CYCD相对表达量在成熟期表达量显著升高,分别是启动期的7.02倍和6.68倍。另外,茉莉酸信号转导相关基因JAZ相对表达量在气生鳞茎原基分化期显著下降,是启动期的53%;在成熟期表达量最高,是启动期的3.78倍。
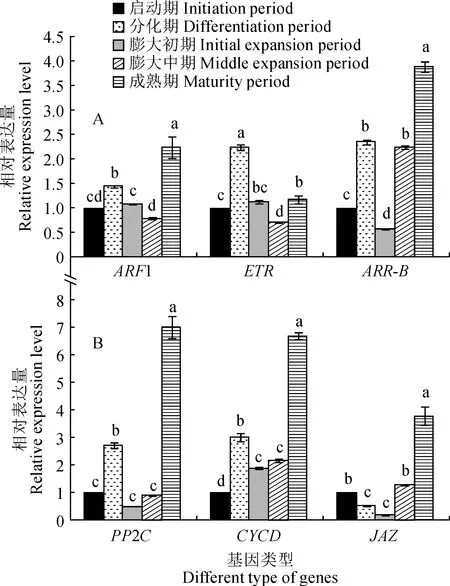
图6 大蒜气生鳞茎形成过程中内源激素信号转导相关基因表达量变化Fig.6 Changes of endogenous hormones signal transduction related gene expression changes during the development of garlic topset
3 讨 论
3.1 大蒜气生鳞茎形成进程及形态和解剖特征
鳞茎是具有繁殖和营养贮藏双重作用的器官,其形成是个复杂的形态分化过程。关于气生鳞茎形成进程划分的研究结果不尽一致。樊金萍等[18]将卷丹百合气生鳞茎形成分为3个时期:启动期、膨大期和成熟期;乔永旭等[19]将东方百合‘索邦’鳞茎形态发生过程分为:启动、生长锥形成、叶原基形成和小鳞茎形成等4个时期;佘璇等[20]将鳞茎发育过程分为原基启动形成期,膨大期和成熟期3个阶段。本试验根据3个不同成熟期的大蒜品种茎尖和花序轴的形态解剖特点,将气生鳞茎形成划分为启动期、气生鳞茎原基分化期、气生鳞茎膨大期和气生鳞茎成熟期等4个时期,与前人对鳞茎形成时期的划分不完全一致。当总苞叶尖露出叶鞘时,花序轴周围分生组织区域产生小突起,开始进入气生鳞茎原基分化期,这与前人的研究结果一致[18-20]。鳞茎的叶分为保护叶、贮藏叶和发芽叶,当保护叶和贮藏叶之间的空隙变小时,发芽叶原基还未开始分化,故将发芽叶原基分化划归到气生鳞茎膨大期。根据气生鳞茎外层保护叶颜色变化判断气生鳞茎是否进入成熟期,这与樊金萍等[18]的研究结果一致,但大蒜气生鳞茎外层保护叶是由白色转为紫色,百合鳞茎保护叶是由绿色变成褐色。
本试验对3个熟期大蒜品种气生鳞茎形成进程的划分与刘秀慧[7]对大蒜地下鳞茎形成划分结果基本一致,仅在启动期的划分有一定差异。在启动期,气生鳞茎和地下鳞茎形成都伴有新叶的萌发,但由于气生鳞茎着生在花序轴上,其形成启动期还伴随着花序的形成。此外,郭菊叶等[3]对蒜薹发育过程观察发现,气生鳞茎原基分化略早于花器官原基分化或同时分化,而我们观察发现气生鳞茎原基分化是在花器官原基分化之后,与吴泽秀等[5]的研究一致。植物器官发育与栽培环境密切相关,猜测造成差异的原因是前者将大蒜种植于网室内,而本试验是露地栽培。
根据石蜡切片结果以及田间观察发现,大蒜气生鳞茎原基分化开始时,3个品种大蒜的总苞叶均刚露出叶鞘。可以由此得出,总苞叶露出叶鞘可以作为气生鳞茎原基开始分化的外部形态依据,在大蒜生产栽培管理中及时进行肥水管控,可促进气生鳞茎的生长和发育。
3.2 大蒜气生鳞茎形成过程中碳水化合物及其相关基因表达的变化特征
碳水化合物是鳞茎发生和膨大的能量和物质基础。在百合鳞茎中,碳水化合物主要以淀粉的形式贮藏,并以蔗糖的形式运转,淀粉、蔗糖代谢在百合鳞茎的发育中起重要作用[9]。Li等[22]对兰州百合小鳞茎形成和发育过程进行转录组测序分析,在分子水平证明了碳水化合物代谢是鳞茎发生和形成的基础。本研究中气生鳞茎可溶性糖含量和蔗糖含量在膨大初期达到最高值,在气生鳞茎膨大开始后急剧下降,直至成熟期,表明气生鳞茎的膨大需要消耗大量的可溶性糖和蔗糖;气生鳞茎淀粉含量则呈直线型上升,表明在气生鳞茎形成过程中,可溶性糖转化成淀粉,进行物质转换和能量代谢,这与百合鳞茎的研究结果一致[23]。
果聚糖代谢相关基因1-SST、1-FEH分别在膨大初期、膨大中期表达量显著升高,其中1-SST调控果聚糖的合成,1-FEH调控果聚糖的降解,表明果聚糖参与了大蒜气生鳞茎形成,且其积累是合成与分解并进的过程[24-26]。CWI参与器官发育[27],CWI相对表达量在气生鳞茎原基分化期显著升高,表明气生鳞茎形成需要大量细胞进行分裂、分化。T6P是一个蔗糖信号转导基因[28],在气生鳞茎原基分化期相对表达量显著升高,猜测花序轴通过大量蔗糖积累后引起T6P表达上调,激活了气生鳞茎形成相关基因的表达,分生组织开始分化形成气生鳞茎。
3.3 大蒜气生鳞茎形成过程中激素及其相关基因表达的变化特征
植物激素是调控植物器官形成及发育的重要因子[16]。生长素能够调控分生组织的发生和发育[29]。本试验中,大蒜气生鳞茎IAA含量变化趋势与菊芋[30]块茎形成中IAA含量变化趋势一致。气生鳞茎IAA在分化期保持较高浓度,膨大开始后显著降低,在膨大中期和成熟期维持在低水平,表明高浓度的IAA可以促进气生鳞茎原基的分化,低浓度的IAA有利于气生鳞茎的膨大。ARF是调控生长素信号转导的关键转录因子[31]。ARF在分化期表达量显著升高,表明ARF参与了气生鳞茎的形成过程。
JAZ是茉莉酸信号调控途径中的负调控因子[32],其相对表达量在大蒜气生鳞茎原基分化期和膨大初期均维持一个较低水平,而MeJA在这一个过程中维持一个较高的浓度,推测该基因表达下调促进MeJA的合成进而影响气生鳞茎原基分化和膨大。这与李春香等[33]、熊正琴等[34]的研究结果相一致。
同时,蛋白磷酸酶基因PP2C在ABA信号转导途径中具有负调控作用[35]。随着气生鳞茎的形成,本研究中气生鳞茎ABA含量呈持续上升的趋势,与唐雯琪等[36]对山药块茎膨大过程内源激素变化的研究结果一致。然而PP2C表达量在分化期和成熟期显著升高,推测ABA对气生鳞茎原基分化的调控作用不大,也可能是PP2C没有参与气生鳞茎的形成,还有待进一步的验证。
另外,气生鳞茎ZR含量在启动期较高,但随着气生鳞茎的形成而显著降低,表明高浓度的细胞分裂素有利于鳞茎原基分化启动[37]。气生鳞茎形成过程中,BR的含量整体处于较低的水平且变化不大,因而推测BR对气生鳞茎形成没有作用。
4 结 论
3个不同熟期品种大蒜气生鳞茎形成进程均可划分为气生鳞茎形成启动期、气生鳞茎原基分化期(包括保护叶原基、贮藏叶原基分化)、气生鳞茎膨大期和气生鳞茎成熟期4个时期,且其分化先后顺序与品种成熟期相关。当总苞叶叶尖露出叶鞘,花器官原基分化时,花序轴周围分生组织区域产生小突起,标志着气生鳞茎原基分化的开始;气生鳞茎外层保护叶由白色转为紫色时开始进入成熟期。气生鳞茎形成消耗大量可溶性糖并积累淀粉。高浓度的ZR可以启动气生鳞茎原基的分化,高浓度的IAA和MeJA可以促进气生鳞茎原基分化,低浓度的IAA有利于气生鳞茎膨大。
——植物学教材质疑(六)

