湖南预防“新冠肺炎”2号方对免疫缺陷小鼠模型的免疫调节作用研究
肖荣 赵澄 张香港 吴涛 魏科 胡珏 卢芳国 秦裕辉
〔摘要〕 目的 探討湖南预防“新冠肺炎”2号方(简称“2号方”)的免疫调节作用与可能机制。方法 将30只BALB/c小鼠随机分为正常对照组、模型对照组、2号方干预组,每组10只。腹腔注射环孢菌素A(cyclosporin A, CsA)建立免疫缺陷小鼠模型,经灌胃给临床等效剂量的2号方水煎剂干预7 d后,常规法检测胸腺指数、脾脏指数、肺指数,ELISA法检测血清中IL-2、IFN-γ、TNF-α表达水平以及肺组织匀浆液中血管紧张素转化酶2(angiotensin converting enzyme 2, ACE2)和血管紧张素Ⅱ(angiotensin Ⅱ, AngⅡ)表达水平。结果 (1)与正常对照组比较,模型对照组小鼠胸腺指数显著降低(P<0.01),胸腺组织萎缩、出现明显的病理改变,并伴有血清中的IL-2、IFN-γ表达水平和肺组织匀浆液中ACE2含量显著降低(P<0.05)以及血清中TNF-α表达水平和肺组织匀浆液AngⅡ表达水平显著上升(P<0.05或P<0.01);(2)与模型对照组比较,2号方干预组小鼠胸腺指数显著升高(P<0.01)、胸腺组织得到明显的改善,血清中IFN-γ 表达水平显著提高(P<0.01),肺组织匀浆中AngⅡ表达水平均显著降低(P<0.01),脾脏指数和肺脏指数差异无统计学意义(P>0.05)。结论 2号方可能通过改善胸腺组织结构、调节IFN-γ、AngⅡ的表达水平而影响CsA所致免疫缺陷小鼠模型的免疫功能。
〔关键词〕 免疫缺陷;新冠肺炎;免疫调节;2号方;炎性因子
〔中图分类号〕R285.5 〔文献标志码〕A 〔文章编号〕doi:10.3969/j.issn.1674-070X.2021.03.002
〔Abstract〕 Objective To explore the immunomodulatory effects and possible mechanisms of Hunan No.2 prevention prescription of "COVID-19" (No.2 prescription"). Methods 30 BALB/c mice were randomly divided into normal control group, model control group and No.2 prescription intervention group, with 10 mice in each group. The immune deficiency model of mice was established by intraperitoneal injection of cyclosporin A (CsA). After 7 days of intervention with clinical equivalent dose of decoction of No.2 prescription, thymus index, spleen index and lung index were detected by routine method, and the contents of IL-2, IFN-γ and TNF-α in serum and the levels of angiotensin converting enzyme 2 (ACE2) and angiotensin Ⅱ (AngⅡ) in lung homogenate were detected by ELISA. Results (1) Compared with the normal control group, the thymus index of the model control group was significantly decreased (P<0.01), the thymus tissue atrophy and obvious pathological changes were observed, and the levels of IL-2 and IFN-γ in serum and as well as ACE 2 in lung tissue homogenate were significantly decreased (P<0.05). Meanwhile, the expressions of TNF-α in serum and AngⅡ in lung tissue homogenate were significantly increased (P<0.05 or P<0.01). (2) Compared with the model control group, the thymus index of No.2 prescription intervention group was significantly increased (P<0.01), thymus tissue got obvious improvement, IFN-γ expression level in serum increased significantly (P<0.01), the level of Ang Ⅱ in lung tissue homogenate was significantly decreased (P<0.01). There were no statistical differences in spleen index and lung index (P>0.05). Conclusion No.2 prescription may affect the immune function of CsA induced immunodeficiency mice by improving the structure of thymus and regulating the expression levels of IFN-γ and AngⅡ.
〔Keywords〕 immunodeficiency; COVID-19; immunomodulatory; No.2 prescription; inflammatory factors
众所周知,机体的免疫状态是影响疾病发生发展的主要因素。我国“新冠肺炎”疫情防控所取得的阶段性胜利与中医药的推广应用密切相关。自国家卫生健康委发布的《新型冠状病毒感染的肺炎诊疗方案(试行第三版)》起,中药就被纳入了“新冠肺炎”疫情防控的诊疗措施中[1]。全国各省、市坚持中西医结合防治,已取得良好效果[2]。经湖南中医药大学、湖南省中医药研究院專题研究,由国医大师刘祖贻等多名中医药专家共同讨论,分别制定出了预防新型冠状病毒感染的、针对健康人群的“预防1号方”和针对体质虚弱人群的“预防2号方”,两个预防方剂在防御感染、控制病情发展、减轻症状、提高生活质量等方面显现出明显效果[3-4]。为探析中医药防治“新冠肺炎”的效应机制,本项目组制备免疫缺陷小鼠模型,研究湖南预防“新冠肺炎”2号方(简称“2号方”)的免疫调节,以期为中医药科学防治新发、突发冠状病毒感染疾病的临床应用提供理论依据。
1 实验材料
1.1 动物
SPF级4~5周龄BALB/c雄性小鼠,体质量(20±2) g,购自湖南斯莱克景达实验动物有限公司,动物许可证号:SCXK(湘)2019-0004,实验单位使用许可证编号:SYXK(湘)2019-0009。实验过程中对小鼠的处理措施已通过湖南中医药大学第一附属医院医学创新实验中心动物伦理委员会同意。
1.2 主要药物与试剂
(1)2号方组成:黄芪30 g,山银花15 g,陈皮9 g,甘草7 g,大枣5枚(20 g)。黄芪(批号:CK20042901,湖南中医药大学第一附属医院)、山银花(批号:HY20050601,湖南中医药大学第一附属医院)、陈皮(批号:2002049,安徽毫药千草中药饮品有限公司)、甘草(批号:NG20051202,湖南中医药大学第一附属医院)、大枣(批号:2002270072,豪州市沪谯药业有限公司),购自湖南中医药大学第一附属医院门诊部。(2)环孢菌素A(cyclosporin A, CsA)(批号:191215,杭州中美华东制药有限公司),以无菌生理盐水稀释,现配现用,应用剂量为20 mg/kg。(3)小鼠IL-2 ELISA试剂盒(批号:LOT20200904A)、小鼠TNF-α ELISA试剂盒(批号:LOT20200904A、小鼠IFN-γ ELISA试剂盒(批号:LOT20200909A)、小鼠血管紧张素转化酶2(angiotensin converting enzyme 2, ACE2)ELISA试剂盒(LOT20200911A)、小鼠血管紧张素Ⅱ(angiotensin Ⅱ, AngⅡ)ELISA试剂盒(批号:LOT20200904A)均购自上海酶联生物科技有限公司。
1.3 主要仪器
PB1501-E型电子分析天平(Mettler公司);Heraleus?Fresco21微量冷冻离心机(德国ThermoF isher科技公司);DK-S24电热恒温水浴锅(上海精宏实验设备公司);ELx800酶标仪(美国BioTek公司);Motic-BA400显微镜(日本Olympus公司)。
2 实验方法
2.1 2号方水煎剂的制备
按照2号方组成准确称取药材1剂(81 g)。先加入1 000 mL蒸馏水室温浸泡30 min,待武火煮沸后,改文火煎煮30 min,过滤获得一煎滤液;留取药渣继续加入1 000 mL蒸馏水,武火煮沸后改文火煎煮30 min,过滤获得二煎滤液,合并两次滤液,水浴浓缩至含生药1.17 g/mL,4 ℃避光保存备用。
2.2 模型建立与分组给药
30只SPF级BALB/c小鼠,随机分成3组:正常对照组、模型组对照组、2号方干预组,每组10只。除正常对照组外,其余各组小鼠腹腔注射CsA,剂量为20 mg/kg,隔日1次,共注射3次。正常对照组同步腹腔注射等量生理盐水。每天定期观察动物的一般症状以评判模型[5-6],评判模型成功的当天开始灌胃给药。2号方干预组给药方式为:0.2 mL/只,1次/d,连续灌胃1周,给药剂量为等效剂量,即根据成人用药量30 g/60 kg体质量,按体表面积换算成小鼠的等效剂量为每日0.234 g/20 g[7]。正常对照组和模型对照组同步给予无菌生理盐水灌胃。
2.3 标本采集与指标检测
2.3.1 胸腺、脾脏、肺脏指数检测 采用器官称重法进行器官指数检测。给药结束后次日称量各组小鼠体质量,颈椎脱臼处死小鼠,解剖取出胸腺、脾脏、肺脏于电子分析天平上称重。
器官指数=器官重量(mg)/体质量(g)
2.3.2 胸腺、脾脏、肺脏组织病理变化观察 将胸腺、脾脏、肺脏组织用4%多聚甲醛固定、石蜡包埋、切片、苏木素-伊红(HE)染色、显微镜下观测。
2.3.3 血清细胞因子表达水平检测 眼球取血,4 ℃下静置过夜,3 000 r/min离心10 min收集血清,ELISA试剂盒检测血清中IL-2、IFN-γ、TNF-α 水平。操作遵循试剂盒操作说明书进行,使用酶标比色仪测定各反应孔的OD值,绘制标准曲线并计算血清中IL-2、IFN-γ、TNF-α的浓度。
2.3.4 肺组织匀浆液ACE2和AngⅡ表达水平检测 取适量肺组织1.0 g,加入9.0 mL磷酸盐缓冲液(PBS,pH 7.4),用匀浆器制备10%的肺组织匀浆,3 000 r/min离心10 min收集上清,经蛋白定量后分装一份用于ACE2、AngⅡ表达水平检测,剩余样本置于-80 ℃冷冻存放备用。ELISA操作遵循试剂盒操作说明书进行。
2.4 统计学分析
将收集的资料录入SPSS 21.0统计学软件分析,计量资料以“x±s”表示,满足正态分布者,采用单因素方差分析(One-way ANOVA),若方差齐,组间两两比较采用LSD检验;方差不齐时,采用Dunnetts T3检验。不满足正态分布者,采用非参数Kruskal-wallis检验。P<0.05表示差异有统计学意义。
3 结果
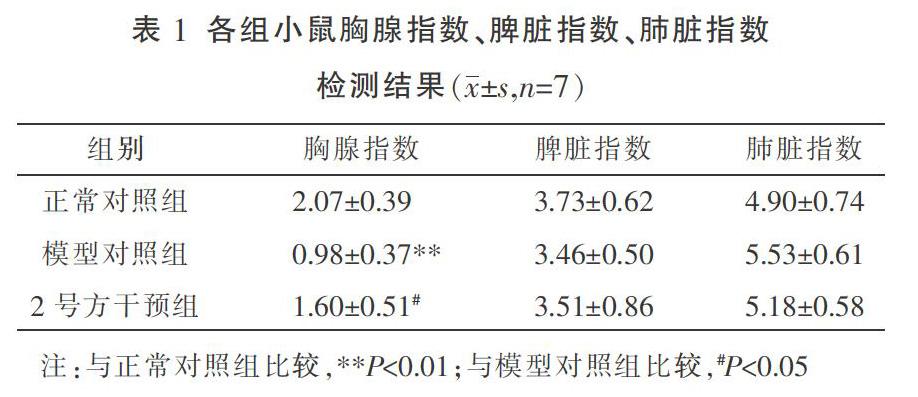
3.1 胸腺、脾脏、肺脏指数检测结果
与正常对照组比较,模型对照组小鼠的胸腺指數显著降低(P<0.01),脾脏指数和肺脏指数差异无统计学意义(P>0.05);与模型对照组比较,2号方干预组小鼠的胸腺指数显著上升(P<0.05)。见表1。
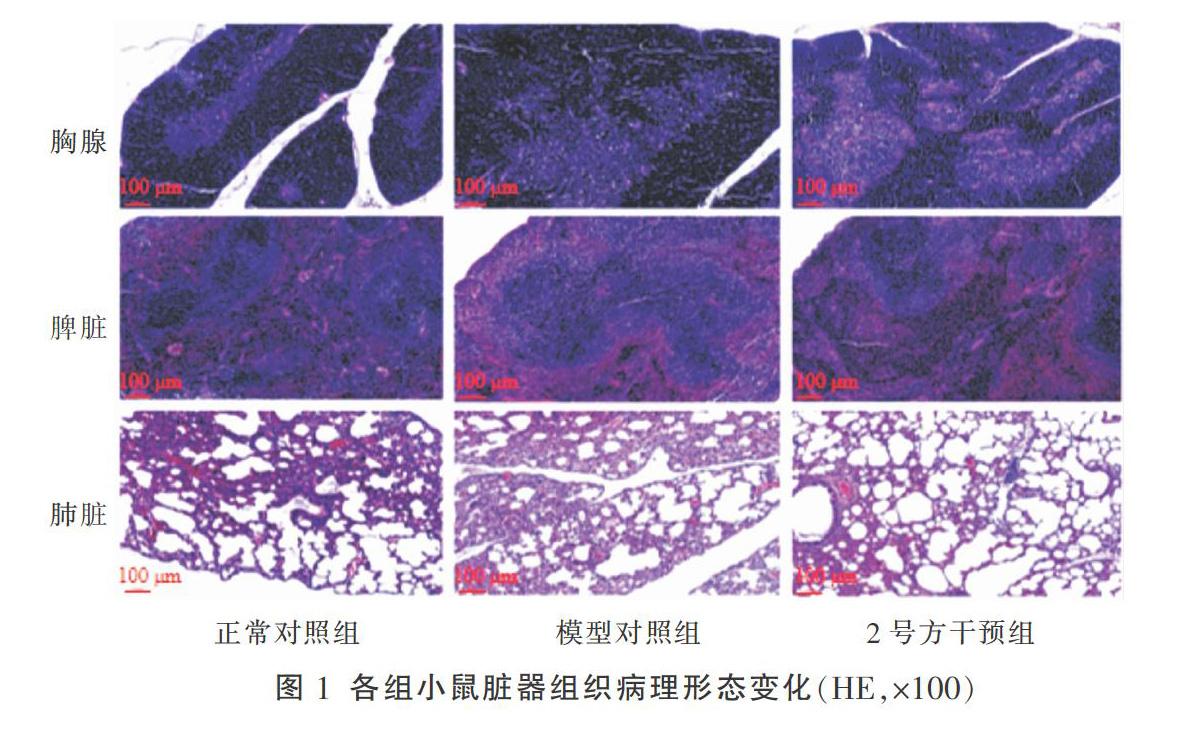
3.2 胸腺、脾脏、肺脏组织病理变化观察结果
正常对照组小鼠胸腺组织皮质髓质分界明显,皮质区淋巴细胞排列整齐,髓质区可见胸腺小体;模型对照组小鼠胸腺组织皮质变薄,淋巴细胞减少,细胞间隙增大,皮质髓质分界模糊;2号方干预组小鼠胸腺组织皮质、髓质分界较为清晰,皮质区淋巴细胞排列规整,髓质区胸腺小体明显。正常对照组小鼠脾脏组织被膜均完整,脾小梁、白髓、红髓组织结构均清晰;模型对照组和2号方干预组小鼠脾脏组织未见明显的病理改变;正常对照组小鼠肺脏组织的肺泡、肺泡隔形态、结构完整,模型对照组和2号方干预组小鼠的肺脏亦未见明显的病理改变。见图1。
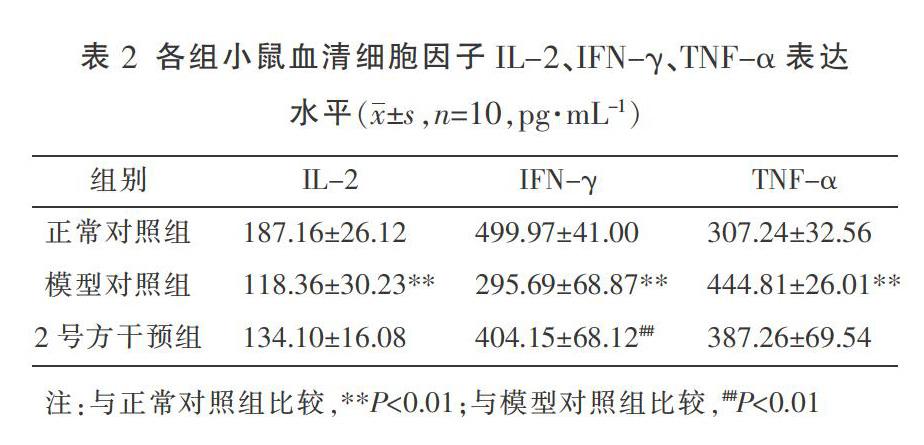
3.3 血清细胞因子表达水平检测结果
与正常对照组比较,模型对照组小鼠血清中的细胞因子IL-2、IFN-γ表达水平显著降低(P<0.01),TNF-α表达水平显著增高(P<0.01)。与模型对照组比较,2号方干预组小鼠血清中的IFN-γ表达水平显著升高(P<0.01),IL-2和TNF-α表达水平差异无统计学意义。见表2。
3.4 肺组织匀浆液ACE2和AngⅡ表达水平检测结果
与正常对照组比较,模型对照组肺组织匀浆液中ACE2表达水平显著降低(P<0.05),AngⅡ表达水平显著增高(P<0.01)。与模型对照组比较,2号方干预组小鼠肺组织匀浆液中ACE2表达水平无显著性差异(P>0.05),而AngⅡ表达水平显著降低(P<0.01)。见表3。
4 讨论
CsA是临床上广泛应用于自身免疫性疾病和移植排斥反应防治的一种免疫抑制剂。已有研究[5-6,8-9]证明:CsA可特异性地抑制CD4+ T细胞的增殖分化,CsA对细胞免疫和胸腺依赖性抗原的体液免疫有较强的选择性抑制作用,并能抑制Th1型细胞产生IL-2、IL-3、IFN-γ等细胞因子的表达,影响T淋巴细胞表面结构和识别功能,阻止T淋巴细胞的活化。机体抗病毒免疫过程主要依赖细胞免疫应答,而2号方是针对体质虚弱人群的中药复方,因此,本课题组选用CsA建立免疫缺陷动物模型,以研究2号方的免疫调节效应与机制。
胸腺是哺乳动物的中枢免疫器官,也是T细胞分化成熟的场地,其结构及功能与机体状态紧密相关,胸腺指数的变化直接反映机体细胞免疫水平的高低[10]。IL-2、IFN-γ是主要由Th1型细胞分泌产生的具有调节机体免疫作用的细胞因子,也是评价机体细胞免疫功能状态的重要指标[11]。本研究所制备的免疫缺陷小鼠模型,出现食欲减退、反应迟钝、毛失光泽等症状,胸腺组织萎缩、胸腺指数显著降低,胸腺经HE染色观察可见胸腺皮质变薄、皮质髓质分界模糊等变化,并伴有血清中的细胞因子IL-2、IFN-γ表达水平显著降低。这些研究结果表明CsA成功建立了以细胞免疫缺陷为主的免疫缺陷小鼠模型。
ACE2可以将肾素-血管紧张素系统中的AngⅡ降解成血管紧张素1-7而发挥抗炎、抗纤维化作用。ACE2活性功能受阻将导致AngⅡ升高,而AngⅡ不仅是致纤维化因子,而且能够刺激核增殖因子κB的表达,并进一步诱导炎症因子(如:IL-1β、IL-6、TNF-α)、趋化因子(如:MCP-1、IP-10)等多种物质的表达[12-15]。本研究中免疫缺陷小鼠模型血清中的TNF-α表达水平以及肺组织匀浆液AngⅡ表达水平显著增高,这可能与ACE2活性下降有关,提示ACE2、AngⅡ可能是与免疫炎症密切相关的指标。
2号方中黄芪甘温,大补脾肺之气,固表实卫,重用为君药;陈皮味苦辛,性温,理气健脾、和中燥湿,合黄芪既能助其健脾之功,又使其补而不滞,为臣药;山银花辛凉,既有辛凉透邪、清热解毒之效,又具芳香辟秽之功,为佐药;大枣、甘草益气健脾,合黄芪加强益气、实卫固表之功,甘草兼能调和诸药,共为佐使。诸药配伍,重在培固正气,兼以辟秽化湿、清解热毒[16]。本研究结果显示:与模型对照组比较,2号方干预组小鼠胸腺指数显著升高(P<0.05),胸腺组织得到明显的改善,血清中IFN-γ 表达水平显著增高(P<0.01),肺组织匀浆中AngⅡ含量水平显著降低(P<0.01)。以上结果表明2号方可能通过改善胸腺组织结构、调节IFN-γ、AngⅡ的表达水平而发挥对CsA所致免疫缺陷小鼠模型的免疫调节作用。这可能是该方调节体质虚弱人群免疫功能、降低新型冠状病毒肺炎感染风险的机制之一。然而,由于中药复方有效组分丰富,作用机制复杂,相关免疫调节机制仍有待进一步深入研究与探索。
参考文献
[1] 中华人民共和国国家卫生健康委员会.国家卫生健康委办公厅关于印发新型冠状病毒感染的肺炎防控方案(第三版)的通知[EB/OL].(2020-01-28)[2020-11-11].http://www.nhc.gov.cn/jkj/s7923/202001/470b128513fe46f086d79667db9f76a5.shtml.
[2] 徐 旭,张 莹,李 新,等.各地区中医药预防新型冠状病毒肺炎(COVID-19)方案分析[J].中草药,2020,51(4):866-872.
[3] 湖南省中医药管理局:关于印发《湖南省新型冠状病毒感染的肺炎中医药诊疗方案(试行第三版)》的通知 湘中医药函〔2020〕19号[EB/OL].(2020-02-03)[2020-02-18].http://tcm.hunan.gov.cn/tcm/xxgk/tzgg/202002/t20200203_11168981.html.
[4] 湖南省中医药管理局.湘中医药函〔2020〕23号湖南省中医药管理局关于在全省机关、企事业单位、学校推广使用中药预防新型冠状病毒感染的通知[EB/OL].(2020-02-10)[2020-11-11].http://tcm.hunan.gov.cn/tcm/xxgk/tzgg/202002/t20200210_11175538.html.
[5] 刘吉勇,卢芳国,朱惠斌,等.应用环孢菌素A制备小鼠免疫缺陷动物模型[J].实用预防医学,2008,15(5):1376-1378.
[6] 朱惠斌,卢芳国,黄顺玲,等.湘A1号、2号对免疫缺陷动物免疫保护作用的研究[J].中华中医药学刊,2011,29(4):828-831.
[7] 贺石林,王 键,王净净.中医科研设计与统计学[M].长沙:湖南科技出版社,2003.
[8] 胡正军.环孢菌素A体内作用2 h对淋巴细胞亚群的影响[J].浙江中医药大学学报,2014,38(11):1308-1310.
[9] 吴 洁,唐 静,谢伟敏,等.应用环孢菌素A制备BALB/C小鼠肺癌模型的实验研究[J].右江民族医学院学报,2013,35(3):268-270.
[10] 罗 晶,郝 钰.免疫学基础与病原生物学[M].2版.北京:人民卫生出版社,2016.
[11] MITRA S, LEONARD W J. Biology of IL-2 and its therapeutic modulation: Mechanisms and strategies[J]. Journal of Leukocyte Biology, 2018, 103(4): 643-655.
[12] SANTOS R A S, SAMPAIO W O, ALZAMORA A C, et al. The ACE2/angiotensin-(1-7)/MAS axis of the renin-angiotensin system: Focus on angiotensin-(1-7)[J]. Physiological Reviews, 2018, 98(1): 505-553.
[13] ANGUIANO L, RIERA M, PASCUAL J, et al. Circulating ACE2 in cardiovascular and kidney diseases[J]. Current Medicinal Chemistry, 2017, 24(30): 3231-3241.
[14] 黎秀芝,尹新華.ACE2/Ang(1-7)/Mas轴在心血管疾病中的研究进展[J].医学综述,2020,26(20):3969-3975.
[15] PAZ OCARANZA M, RIQUELME J A, GARCíA L, et al. Counter-regulatory renin-angiotensin system in cardiovascular disease[J]. Nature Reviews Cardiology, 2020, 17(2): 116-129.
[16] 秦裕辉,胡方林,葛金文.新冠系列方预防新型冠状病毒感染用方探讨[J].湖南中医药大学学报,2020,40(2):129-133.

