棘孢曲霉液体发酵产β-葡萄糖苷酶培养基的优化
张玉千 周学 夏文静 郑丹 许晓风

摘要:以棘孢曲霉为生产菌株进行液态发酵生产β-葡萄糖苷酶,优化产酶培养基成分。采用单因素法对发酵培养基的碳源、氮源、碳氮比、磷酸盐的含量及吐温-80的浓度进行初步探索,借助正交设计试验法确定棘孢曲霉液态发酵产β-葡萄糖苷酶最优培养基组成。结合单因素试验和正交试验得到最优的培养基成分为2%蔗糖、0.16%尿素、碳氮比为30 ∶1、0.2% KH2PO4、0.125%吐温-80。利用优化后的培养基成分进行发酵产酶,β-葡萄糖苷酶的酶活力达到29.23 U/mL,是初始产酶培养基产酶活力的8.21倍。通过对培养基成分的优化,大幅度提高了β-葡萄糖苷酶的产量,为β-葡萄糖苷酶的生产提供了新的菌株,为提高槐角异黄酮的转化研究提供了新的途径及数据参考。
关键词:棘孢曲霉;β-葡萄糖苷酶;培养基优化;正交试验;单因素试验
中图分类号: S182 文献标志码: A
文章编号:1002-1302(2021)11-0208-05
收稿日期:2020-09-23
基金项目:江苏省大学生创新创业训练计划一般项目(编号:201913843026Y);南京师范大学高等教育改革研究课题(编号:2018JG07042、2019JG09001)。
作者简介:张玉千(1985—),男,山东济宁人,硕士研究生,讲师,主要从事天然产物的分离纯化及微生物转化研究。E-mail:zqwl2000@163.com。
通信作者:许晓风,博士,教授,博士生导师,主要从事植物保护、分子遗传与分子生态方面的研究。E-mail:xuxiaofeng@njnu.edu.cn。
棘孢曲霉是曲霉属真菌,具有球形或椭圆形的顶囊,分生孢子为淡褐色球状,表面有刺突[1]。棘孢曲霉在自然界中分布广泛,常见于粮食、植物和土壤中。棘孢曲霉具有丰富的酶系,可分泌淀粉酶、酸性蛋白酶、纤维素酶、葡萄糖氧化酶、柠檬酸、葡糖酸和没食子酸等产物,是一种重要的工业发酵微生物,被广泛应用于生产工业酶制剂、产品发酵等方面[2-3]。
目前,关于棘孢曲霉的研究主要集中在产酶条件的优化,尤其是产果胶酶和柚苷酶的研究。何海燕等从蚕沙堆积地土壤中筛选出产果胶酶的优良菌株,经过微波诱变得到稳定菌株,所产酶活性可达10.17 U/mL[4]。王耸等以柚皮为原料优化棘孢曲霉产柚苷酶的固体发酵条件,产酶量提高了7.38倍[5]。据报道,棘孢曲霉所产的β-葡萄糖苷酶活性较强,在微生物转化中尤其是对苷类物质糖苷键的水解反应中效果较好。Treebupachatsakul等发现棘孢曲霉产β-葡萄糖苷酶可以将糖转化为乙醇,为工业生物乙醇的生产提供较好的途径[6]。马迎迎等发现,棘孢曲霉可以将甜菊糖苷转化为甜菊醇,为甜菊醇的制备提供一种新的方法[7]。试验组在槐角黄酮苷的转化过程中发现,棘孢曲霉可以将染料木苷、槐角苷转化为5,7,8,4′-四羟基异黄酮[8-9],后者是一种高效的酪氨酸酶抑制剂[10-11],在医药、美容、食品等领域具有广阔的应用前景[12]。在棘孢曲霉转化槐角黄酮苷的过程中,β-葡萄糖苷酶是关键酶,提高该酶的产量可以增加产物得率。本试验在国内外相关研究的基础上进行液态发酵研究,通过优化培养基成分提高β-葡萄糖苷酶的产量。
1 材料与方法
1.1 材料与仪器
1.1.1 材料与试剂
试验菌种为棘孢曲霉,笔者所在实验室筛选鉴定,菌种保藏号为CCTCC NO:M2011264。
斜面培养基(20%土豆、2%葡萄糖、2%琼脂、pH值自然)、种子培养基[1% (NH4)2SO4、0.5% KH2PO4、0.1% MgSO4、6%葡萄糖]、发酵基础培养基[2%蔗糖、0.16% (NH4)2SO4、0.2% KH2PO4、0.02% MgSO4、0.001% FeSO4·7H2O、0.05%吐温-80、 pH值自然]。
水杨苷(湖北帝柏化工有限公司)、无水乙醇,苯酚亚硫酸氢钠、酒石酸钾钠、3,5-二硝基水杨酸、冰醋酸、无水乙酸钠均为分析纯,购自国药集团上海有限公司。
1.1.2 仪器与设备
试验主要仪器有ZHJH-C1214B超净工作台(上海智城分析仪器制造有限公司)、MLS-3780高压蒸汽灭菌器[致微(厦门)仪器有限公司]、FA2204电子分析天平(上海方瑞仪器有限公司)、HZQ-X100恒温振荡培养箱(太仓市实验设備厂)、WFZ UV-2000紫外可见分光光度计[尤尼柯(上海)仪器有限公司]。
1.2 试验方法
1.2.1 菌种活化及发酵培养
将4 ℃保藏的菌种转接至斜面培养基上,28 ℃培养2~3 d,用无菌水冲洗斜面孢子,做成1×108 CFU/mL的孢子悬液,充分振荡30 min。按10%接种量接入到100 mL液体发酵培养基中,30 ℃ 150 r/min摇床培养72 h。
取发酵液8 000 r/min离心10 min,取上清加无水乙醇,使乙醇浓度为70%~75%,放于4 ℃冰箱中沉淀过夜。10 000 r/min离心15 min,沉淀用0.2 mol/L pH值为4.6的乙酸-乙酸钠的缓冲液重新溶解,即得酶液,测定酶活力。
1.2.2 单因素试验
1.2.1.1 碳源的优化
发酵基础培养基中去掉碳源,分别加入2%的葡萄糖、蔗糖、麸皮、稻糠、玉米粉、麸皮+稻糠(1 ∶1)、麸皮+玉米粉(1 ∶1)作为唯一碳源,其他成分保持不变,配制液体培养基各100 mL,装入250 mL锥形瓶中,灭菌,按10%接种量加孢子悬液,30 ℃,150 r/min摇床培养72 h,按“1.2.1”节方法提取酶液,测酶活力。
1.2.1.2 氮源的优化
发酵基础培养基中去掉氮源,分别以0.16%的硫酸铵(无机氮源)、酵母浸膏、豆粕粉、蛋白胨、尿素为氮源,其他成分保持不变,配制液体培养基各100 mL,装入250 mL锥形瓶中,灭菌,按10%接种量加孢子悬液,30 ℃,150 r/min摇床培养72 h,按“1.2.1”节方法提取酶液,测酶活力。
1.2.1.3 碳氮比的优化
以蔗糖为碳源,硫酸铵为氮源,控制碳氮比分别为5 ∶1、10 ∶1、20 ∶1、30 ∶1、40 ∶1,其他成分和发酵基础培养基一致,配制液体培养基各100 mL,装入250 mL锥形瓶中,灭菌,按10%接种量加孢子悬液,30 ℃,150 r/min摇床培养72 h,按“1.2.1”节方法提取酶液,测酶活力。
1.2.1.4 磷酸盐对产酶的影响
去除发酵基础培养基中的磷酸盐,分别加入KH2PO4,使质量分数为0、0.1%、0.2%、0.3%、0.4%、0.5%,其他成分保持不变,配制液体培养基各100 mL,装入250 mL锥形瓶中,灭菌,按10%接种量加孢子悬液,30 ℃,150 r/min 摇床培养72 h,按“1.2.1”节方法提取酶液,测酶活力。
1.2.1.5 吐温-80对产酶的影响
去除发酵基础培养基中的吐温-80,分别加入吐温-80,使质量分数分别为0.050%、0.075%、0.100%、0.125%、0.150%,其他成分保持不变,配制液体培养基各100 mL,装入250 mL锥形瓶中,灭菌,按10%接种量加孢子悬液,30 ℃,150 r/min摇床培养72 h,按“1.2.1”节方法提取酶液,测酶活力。
1.2.3 正交试验
在单因素试验的基础上,固定接种量为10%,装液量为100 mL,选择碳源、氮源、磷酸盐用量、吐温-80质量分数4个因素,按照表1所示的因素水平设计4因素3水平正交试验组合,按照“1.2.1”节的方法进行发酵,测酶活力。
1.2.4 酶活力测定方法
根据文献[13]的方法,采用3,5-二硝基水杨酸(DNS)法测定β-葡萄糖苷酶酶活:取0.2 mL水杨苷加0.2 mL酶液,在60 ℃ 的水浴锅里加热10 min,取出,向反应液里加入1 mL DNS试剂,放入沸水中加熱5 min,冷却,定容至10 mL,540 nm下测定吸光度,根据葡萄糖标准曲线计算。
酶单位定义(U/mL):在60 ℃、pH值=4.6的条件下,每1 mL酶液1 min水解底物产生1 μmol还原糖(以葡萄糖计)所需的酶量为1个酶活力单位(U/mL)。
葡萄糖苷酶活力单位(U/mL)=1 000×N×(D540 nm+0.012 8)/(180×0.816 9×0.2),N表示稀释倍数。
2 结果与分析
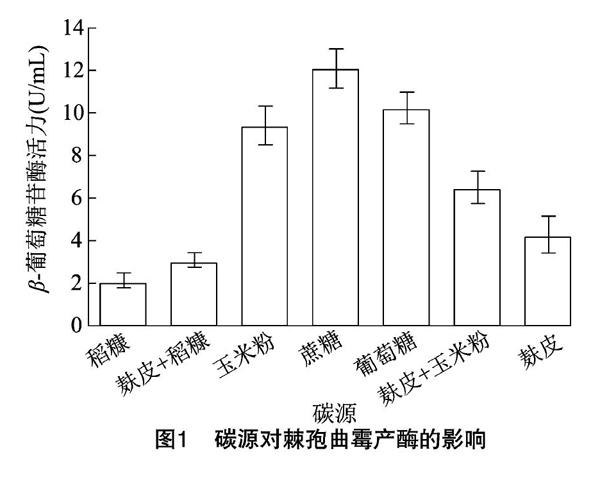
2.1 碳源对产酶的影响
碳源为微生物新陈代谢提供所需的能源和合成产物的碳骨架,是微生物正常生长分裂的物质基础。碳源过多,在发酵过程中容易形成较低的pH值;碳源不足,容易使菌体过快衰老和自溶,不同的微生物所需要的碳源种类不同,需要通过试验进行优化。试验选用葡萄糖、蔗糖、麸皮、玉米粉、稻糠、麸皮+玉米粉(1 ∶1)、麸皮+稻糠(1 ∶1)等农副产品为碳源进行研究。由图1可知,蔗糖作为碳源时,最有利于产酶,酶活力最高为12.09 U/mL,其次是葡萄糖和玉米粉。蔗糖作为碳源时,分解率等于利用率,没有葡萄糖的积累,可以避免葡萄糖对β-葡萄糖苷酶的抑制作用。葡萄糖的效果仅次于蔗糖,可能是该菌体已经部分解除了葡萄糖的抑制。以麸皮、稻糠及其组合为碳源的β-葡萄糖苷酶酶活力较低,说明在液态发酵培养中,可溶性碳源容易被菌体吸收利用,见效较快。
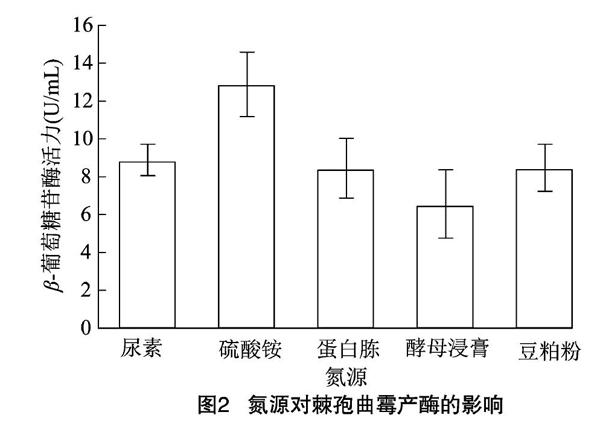
2.2 氮源对产酶的影响
氮源对微生物的生长发育有着重要意义,微生物利用它在细胞内合成氨基酸和碱基,进而合成蛋白质、核酸等细胞成分[14]。氮源过多,会使菌体生长过于旺盛,体系pH值偏高,不利于代谢产物的积累;氮源不足,则菌体繁殖量少,生物量少,产物的生产量减少。分别以尿素、硫酸铵(无机氮源)、蛋白胨、酵母浸膏、豆粕粉为氮源进行发酵产酶。由图2可知,在以硫酸铵为氮源时,测得的酶活力最高,为12.88 U/mL,因此优选硫酸铵为氮源。
2.3 碳氮比对产酶的影响
碳氮比不当会影响菌体按比例吸收营养物质,直接影响菌体的生长和产物的形成。碳氮比过高和过低均不利于细胞生长和外源蛋白表达与积累,过低导致菌体提早自溶;过高导致细菌代谢不平衡,最终不利于产物的积累。一般碳源因为既作碳架又作能源,因此用量要比氮多。由图3可知,碳氮比为30 ∶1 时酶活力最高,为11.55 U/mL,因此优选碳氮比为30 ∶1。
2.4 磷酸盐对产酶的影响
钾和磷都是微生物生长所必需的营养素,培养基中的KH2PO4既能提供氮磷元素又可以缓冲发酵液的pH值,保持微生物生长所需的酸碱度。本试验将KH2PO4浓度分别设为0.1% 、0.2% 、0.3% 、0.4% 、0.5%,结果如图4所示,0.2%和0.3%这2个浓度对应的酶活力较高,当磷酸盐浓度为0.2%时,测得最大酶活力为12.55 U/mL。因此KH2PO4的浓度选择0.2%。
2.5 吐温-80对产酶的影响
吐温-80为非离子型表面活性剂,可以增强细胞膜的通透性,能促进胞外酶的分泌,但浓度太大也会影响培养基中的溶氧,进而影响菌体生长和产酶。试验考查了不同吐温-80浓度对产酶的影响,由图5可知,控制的碳氮源分别是蔗糖和硫酸铵,当吐温-80质量分数为0.100%时,测得的酶活最大,为11.49 U/mL。
2.6 正交试验设计
通过表2对比4种因素对棘孢曲霉产酶的影响,结果表明RA>RC>RB>RD,碳源种类对棘孢曲霉产酶的影响最大,其次是磷酸盐浓度、氮源,影响最小的是吐温-80的浓度。通过比较k值,得到最优水平为A2B1C2D3,即2%蔗糖、0.16%尿素、0.2%KH2PO4、0.125%吐溫-80。
2.7 重复验证试验
为确定正交试验结果的优劣及稳定性,利用最优培养基组分进行3批重复验证试验,结果表明,平均酶活力为29.23 U/mL,均高于正交试验表中的9个试验中的酶活力,相当于初始培养基酶活力(3.56 U/mL)的8.21倍。因此,确定A2B1C2D3为最优组合且具有一定的稳定性。
3 结论与讨论
以前期筛选的棘孢曲霉为出发菌株,通过单因素试验和正交试验优化棘孢曲霉液态发酵培养基组分。结果表明,碳源、氮源对产酶的影响最大,优化得到的液态培养基的组分为2%蔗糖、0.16%尿素、0.2%KH2PO4、0.125%吐温-80。在此基础上进行发酵产酶,β-葡萄糖苷酶活力为29.23 U/mL,是基础初始培养基的酶活的8.21倍。
β-葡萄糖苷酶广泛存在于植物、动物、微生物中,其中来源于微生物的酶活性较高,研究报道较多。β-葡萄糖苷酶可水解β-D-糖苷键,解除纤维二糖对纤维素酶的抑制,在纤维素水解的过程中是关键的一步[15-17],目前在生物能源、食品工程、过程转化等领域被广泛应用[18]。在产纤维素酶的菌株中,β-葡萄糖苷酶含量普遍较低。但黑曲霉除外,目前工业中也主要利用黑曲霉生产β-葡萄糖苷酶,通过培养基、培养条件的优化及诱变育种等方法提高β-葡萄糖苷酶的产量[15]。棘孢曲霉可分泌淀粉酶、纤维素酶、果胶酶、柚苷酶、鼠李糖苷酶等多种酶[2,4,19-20],其中柚苷酶的研究较多,β-葡萄糖苷酶的研究较少。棘孢曲霉经过优化后β-葡萄糖苷酶的酶活力有了明显提高,从而为β-葡萄糖苷酶的生产提供了新的菌株。
槐角是一种常用的中药材,富含黄酮异黄酮类化合物[21],利用微生物的甲基化、羟基化、甲氧基化、水解等反应可以提高活性成分的含量、获得高附加值的代谢产物[22]。Wu等利用Schizophyllum commune转化槐角苷得到羟基化、甲基化等多种有价值代谢产物[23]。槐角中的染料木苷含量较高,但生物活性没有苷元染料木素的活性高。Chang等以槐角粉末为原料利用黑曲霉和酵母联合发酵培养,使染料木素的含量增加了34.45倍[20,24]。刘姜华利用米根霉LJH3将槐角苷转化成染料木素,转化率达80.2%[25]。在棘孢曲霉转化槐角的过程中,β-葡萄糖苷酶水解染料木苷分子中的糖苷键生成染料木素和葡萄糖,染料木素又被细胞色素P450酶羟基化形成5,7,8,4′-四羟基异黄酮[8,26]。通过优化棘孢曲霉产酶培养基提高酶活力,可提高染料木苷的转化效率,最终提高5,7,8,4′-四羟基异黄酮的收率。
参考文献:
[1]王 迪,倪 辉,李利君,等. 一株棘孢曲霉的鉴定及其柚苷酶合成规律[J]. 微生物学报,2013,53(7):691-701.
[2]刘艳苓. 棘孢曲霉发酵柚皮产多酶组分分析及产柚苷酶工艺优化[D]. 厦门:集美大学,2015:1-2.
[3]王亚林,严建芳,吴灵英,等. 稻草发酵菌种的筛选与组配研究[J]. 饲料研究,2001(10):24-25.
[4]何海燕,覃拥灵,陆世则,等. 产果胶酶棘孢曲霉的筛选鉴定及微波诱变育种[J]. 中国饲料,2015,2(2):20-22.
[5]王 耸,刘艳苓,姜泽东,等. 棘孢曲霉固态发酵柚皮产柚苷酶的条件优化[J]. 微生物学通报,2015,42(10):1936-1944.
[6]Treebupachatsakul T,Nakazawa H,Shinbo H,et al. Heterologously expressed Aspergillus aculeatus β-glucosidase in Saccharomyces cerevisiae is a cost-effective alternative to commercial supplementation of β-glucosidase in industrial ethanol production using Trichoderma reesei cellulases[J]. Journal of Bioscience and Bioengineering,2016,121(1):27-35.
[7]马迎迎,陈育如,张伟娜,等. 棘孢曲霉转化甜菊糖为甜菊醇及纯化莱鲍迪苷A[J]. 微生物学报,2014,54(1):62-68.
[8]陈育如,张玉千,玄 燕,等. 一株棘孢曲霉菌株及用该菌株制备5,7,8,4′-四羟基异黄酮的方法:ZL2011102258550[P]. 2011-12-14.
[9]Zhang Y Q,Zhao Y C,Lu Y Y,et al. Bioconversion of fructus sophorae into 5,7,8,4′-tetrahydroxyis oflavone with Aspergillus aculeatus[J]. PLoS One,2019,14(3):e0211613.
[10]Chang T S,Ding H Y,Tai S K,et al. Mushroom tyrosinase inhibitory effects of isoflavones isolated from soygerm koji fermented with Aspergillus oryzae BCRC 32288[J]. Food Chemistry,105(4):1430-1438.
[11]Chang T S. Two potent suicide substrates of mushroom tyrosinase:7,8,4′-trihydroxyisoflavone and 5,7,8,4′-tetrahydroxyisoflavone[J]. Journal of Agricultural and Food Chemistry,2007,55(5):2010-2015.
[12]閆 军,陈声利,李春阳. 酪氨酸酶抑制剂及对黑素生物合成的影响[J]. 国外医学:皮肤性病学分册,2003,29(4):250-253.
[13]刘 虎,陈育如,姜中玉. 固定化β-葡萄糖苷酶转化甜菊糖的研究[J]. 食品工业科技,2011,32(4):170-172,176.
[14]李 涛,张朝辉,郭雅雯,等. 国内外微生物肥料研究进展及展望[J]. 江苏农业科学,2019,47(10):37-41.
[15]石彩蕊. 黑曲霉诱变育种产β-葡萄糖苷酶研究[D]. 长沙:中南林业科技大学,2011:11-12.
[16]常治帅,兰 辉,包亚莉,等. 微生物产β-葡萄糖苷酶研究进展[J]. 微生物前沿,2018,7(2):79-86.
[17]倪嘉璐,张琪琳,沈利峰,等. β-葡萄糖苷酶产生菌的筛选及发酵培养基优化[J]. 浙江树人大学学报,2010,10(1):22-26.
[18]Singh G,Verma A K,Kumar V. Catalytic properties,functional attributes and industrial applications of β-glucosidases[J]. 3 Biotech,2016,6(1):3.
[19]刘艳苓,肖安风,李利君,等. 棘孢曲霉固态发酵α-L-鼠李糖苷酶调控机制及培养基优化[J]. 中国食品学报,2015,15(7):10-17.
[20]陈 红,倪 辉,李利君,等. 棘孢曲霉固态发酵柚皮产柚苷酶及其在柑橘果汁脱苦中的应用[J]. 菌物学报,2013,32(6):1034-1045.
[21]Chang L,Ren Y,Cao L,et al. Simultaneous determination and pharmacokinetic study of six flavonoids from Fructus sophorae extract in rat plasma by LC-MS/MS[J]. Journal of Chromatography. B,Analytical Technologies in the Biomedical and Life Sciences,2012,904(1):59-64.
[22]Das S,Rosazza J P. Microbial and enzymatic transformations of flavonoids[J]. Journal of Natural Products,2006,69(3):499-508.
[23]Wu J G,Yang X L,Ge J,et al. Biotransformation of sophoricoside in Fructus sophorae by the fungus Schizophyllum commune[J]. Bioresource Technology,2012,111:496-499.
[24]Feng C,Jin S,Xia X X,et al. Effective bioconversion of sophoricoside to genistein from Fructus sophorae using immobilized Aspergillus niger and Yeast[J]. World Journal of Microbiology & Biotechnology,2015,31(1):187-197.
[25]刘姜华. 微生物转化槐角苷制备染料木素的研究[D]. 杭州:浙江工业大学,2017.
[26]Androutsopoulos V P,Ruparelia K,Arroo R R,et al. CYP1-mediated antiproliferative activity of dietary flavonoids in MDA-MB-468 breast cancer cells[J]. Toxicology,2009,264(3):162-170.

