磁共振T2WI纹理分析对前列腺癌雄激素剥夺治疗疗效评估的临床价值
蔚纳,吴慧,任嘉梁,高阳,刘挨师,钱洛丹,蔚晓玉,牛广明
前列腺癌(prostate cancer,PCa)是男性最常见的恶性肿瘤之一,近年来我国PCa的发病率和死亡率逐年上升[1]。早期PCa通过积极监测、手术、放疗进行控制,但局部晚期和转移阶段的治疗以雄激素剥夺治疗(androgen deprivation therapy,ADT)为主,通过手术或化学去势,文献报道41%的PCa患者将其作为一线治疗手段[2]。然而,有一部分患者会对治疗产生抗药性进展为去势抵抗性前列腺癌(castration-resistant prostate cancer),文献报道其中51%的患者将在治疗后5年内进展成为难治性前列腺癌[3]。目前,还没有生物标记物可以预测那些肿瘤最有可能出现去势抵抗性,而MRI纹理分析是一种最新的技术,用来描述人眼看不到的像素值特征,反映像素值的微小变化,具有非侵入性研究前列腺癌对ADT治疗反应的潜力,可能有助于选择下一步临床治疗方案。
ADT会影响MR图像上前列腺的外观及信号变化,雄激素缺乏引起腺体萎缩、纤维化导致正常外周带T2信号降低,影响肿瘤边缘的区分[4-5],这可能高估治疗后肿瘤的存在。近年来,许多学者使用纹理分析对前列腺癌患者进行研究,例如前列腺癌与良性增生鉴别[6]、监测风险分层[7]、预测生化复发的模型[8-9]等,而纹理分析在ADT患者中对前列腺癌的检出和描述还没有得到重视。虽然多参数MRI(multi-parameter magnetic resonance imaging,mp-MRI)包括T2加权成像(T2-weighted imaging,T2WI)和扩散加权成像(diffusion weighted imaging,DWI)是检测PCa的准确工具,但在ADT治疗后的评估价值不太明确。因此,笔者旨在探讨MR T2WI纹理分析评估PCa患者对ADT的反应以指导下一步临床治疗,并研究从良性组织中分离残存病灶的价值。
材料及方法
1.临床资料
回顾性分析2018年1月-2019年5月符合以下标准的患者(图1)。纳入标准:①入组患者治疗前经直肠超声引导穿刺证实为PCa且临床分期为T2C或更高;②患者从接受ADT开始至行mp-MRI检查的时间为7个月,且所有患者在检查时仍处于治疗状态;③疗效差组纳入标准为患者治疗后PSA水平升高,进行mp-MRI检查对可疑残留病灶进行超声穿刺,最后将病理详细结果(12点穿刺包括进针角度、进针深度)与mp-MRI结合对残留病灶进行定位;④疗效好组纳入标准为患者治疗后PSA水平无升高、mp-MRI无可疑病灶、病理结果阴性;⑤患者血清睾酮均达到去势水平,T<50 ng/dL(<1.7 nmol/L)。排除标准:①图像质量差不符合要求;②患者接受放疗或手术等其他治疗手段。雄激素剥夺通过用雄激素受体拮抗剂进行治疗,比卡鲁胺(口服50 mg,每天一次)或醋酸环丙孕酮(口服100 mg,每天三次)连续7天,随后皮下注射10.8 mg的促性腺激素释放激素类似物(戈舍瑞林),已知该方案可在14天内达到去势血清睾酮水平[10]。
2.检查方法
采用美国GE 3.0T Discovery 750 MR扫描仪,腹部相控阵线圈。扫描前患者适度充盈膀胱,取仰卧位,扫描中心定位于耻骨联合上方2 cm。扫描序列包括横轴面、矢状面和冠状面T2WI,横轴面T1WI以及DWI序列。主要成像序列包括横轴面FS T2WI和DWI,FS T2WI旋回波序列(TR 3471 ms,TE 85 ms,层厚4.0 mm,间隔1 mm,激励次数4,矩阵320×192,FOV 240 mm×240 mm。DWI采集单次回波平面成像序列(TR 3600 ms,TE 64.1 ms,层厚4.0 mm,间隔1 mm,激励次数8,矩阵128×128,FOV 400 mm×400 mm,b值为0,1000 s/mm2)。
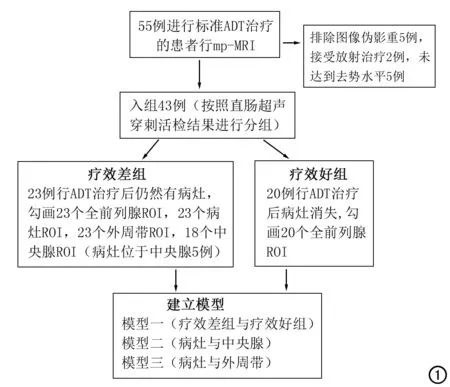
图1 病例纳入及分组。
3.图像分析
将所有患者的MR图像以DICOM格式从PCAS工作站导出并存储。在T2WI图像上由2名经验丰富的盆腔磁共振医师对两组的全前列腺以及有病灶组(经超声穿刺活检证实)的周围带(peripheral zone,PZ)、中央腺(central gland,CG)和病灶在ITK-SNAP(版本3.6.0,www.itksnap.org)软件上沿着边缘逐层进行ROI勾画并合成三维兴趣容积(volume of interest,VOI)[11]。虽然ADT治疗后降低了T2WI肿瘤的显著性,但仍可以发现原发病灶,在进行肿瘤VOI的勾画时参考ADC图。
纹理分析采用GE公司开发的AK(Analysis-Kit,GE healthcare)软件,从T2WI上标注的VOI中提取全前列腺、病灶、外周带、中央腺所有的定量影像学特征,共308个放射学特征:一阶统计量、Haralick parameters(GLCM parameters)、RLM parameters、GLSZM parameters、Form factor parameters。对影像组学进行特征提取和分析:①数据预处理,异常值用中位数代替,对数据进行z-score标准化,以统一所有特征的尺度。②特征数降维,使用单因素逻辑回归,筛选出P值小于0.05的特征。用广义线性模型LASSO(least absolute shrinkage and selection operator)算法进行特征选择。③对筛选出的特征建立预测模型,采用多因素逻辑回归建立模型,以Akaike信息准则(AIC)作为停止原则,应用逆向逐级选择保留最佳特征子集。最终将剩余特征作为最佳鉴别特征并建立多因素逻辑回归模型,见图2。
4.统计分析
采用R软件(版本3.6.1,www.r-project.com)对数据进行分析,采用组内相关系数(intraclass correlation coefficient,ICC)评价两名测量者间特征一致性,ICC>0.80为一致性良好。进一步采Kolmogorov-Smirnov检验评价纹理特征是否符合正态分布,采用Levene检验进行方差齐性检验。正态分布且方差齐的纹理特征采用两独立样本t检验比较组间差异,方差不齐者采用校正的t检验;不符合正态分布者采用非参数Mann-WhitneyU检验。采用Lasso回归模型及3折交叉验证筛选出诊断效能最高的纹理特征组合,采用logistic回归构建模型。采用ROC评价模型的诊断效能,采用决策曲线分析(decision curve analysis,DCA)方法计算模型在临床不同阈值下获得的净收益值。所有检验水准为0.05。
结 果
1.患者资料
最终纳入43例PCa患者,年龄(66.6±7.4)岁,治疗前前列腺特异性抗原(prostate specific antigen,PSA)“疗效差组”均值为60.58 ng/mL,“疗效好组”均值为77.52 ng/mL,差异无统计学意义(t=1.67,P=0.79)。
2.参数筛选及模型建立
在所提取的308个特征中,ICC为0.43~0.99,在模型一中删除59个ICC≤0.8的纹理特征,模型二中删除36个ICC≤0.8的纹理特征,在模型三中删除54个ICC≤0.8的纹理特征。一致性良好的纹理特征中,经过t检验或Mann-WhitneyU检验删除无统计学意义的纹理特征,单因素逻辑回归筛选出P值小于0.05的特征。对筛选后的纹理特征进行Lasso回归及交叉验证(图3a、b),得到最终特征(表1)。
3.模型效能评估
构建的3个模型的ROC曲线下面积、敏感度、特异度、符合率见表2。
模型一评估PCa经ADT治疗后的疗效,其Rad分值图中(图3c),分值越大越倾向于ADT治疗后癌灶的残存或复发,分值>0代表预测为ADT治疗后病灶的残存或复发,分值<0代表ADT治疗后效果好无残留或复发的病灶,在分值<0的阴性组中有6例患者出现假阴性,在分值>0的阳性组中有5例患者出现假阳性。模型一的DCA(图3d)表示不同风险阈值下的净获益,当风险阈值在训练组为10%~99%时,采用纹理分析评估前列腺癌ADT治疗效果的方法所获得的临床净收益值大于临床全部进行干预与都不干预的净收益值。

图2 纹理分析工作流程。前列腺图像纳入T2WI为分割图,ADC图像为参考图。图像分割中,由上到下分别为:疗效差组全前列腺体积分割,病灶位于前列腺中央腺(红箭);疗效好组全前列腺体积分割;疗效差组中病灶(红色覆盖区),外周带(蓝色覆盖区),中央腺(绿色覆盖区)体积分割。提取特征的示例,展示了T2WI信号的直方图特征、纹理特征以及形态特征。最后建立3个模型并进行效能评估。
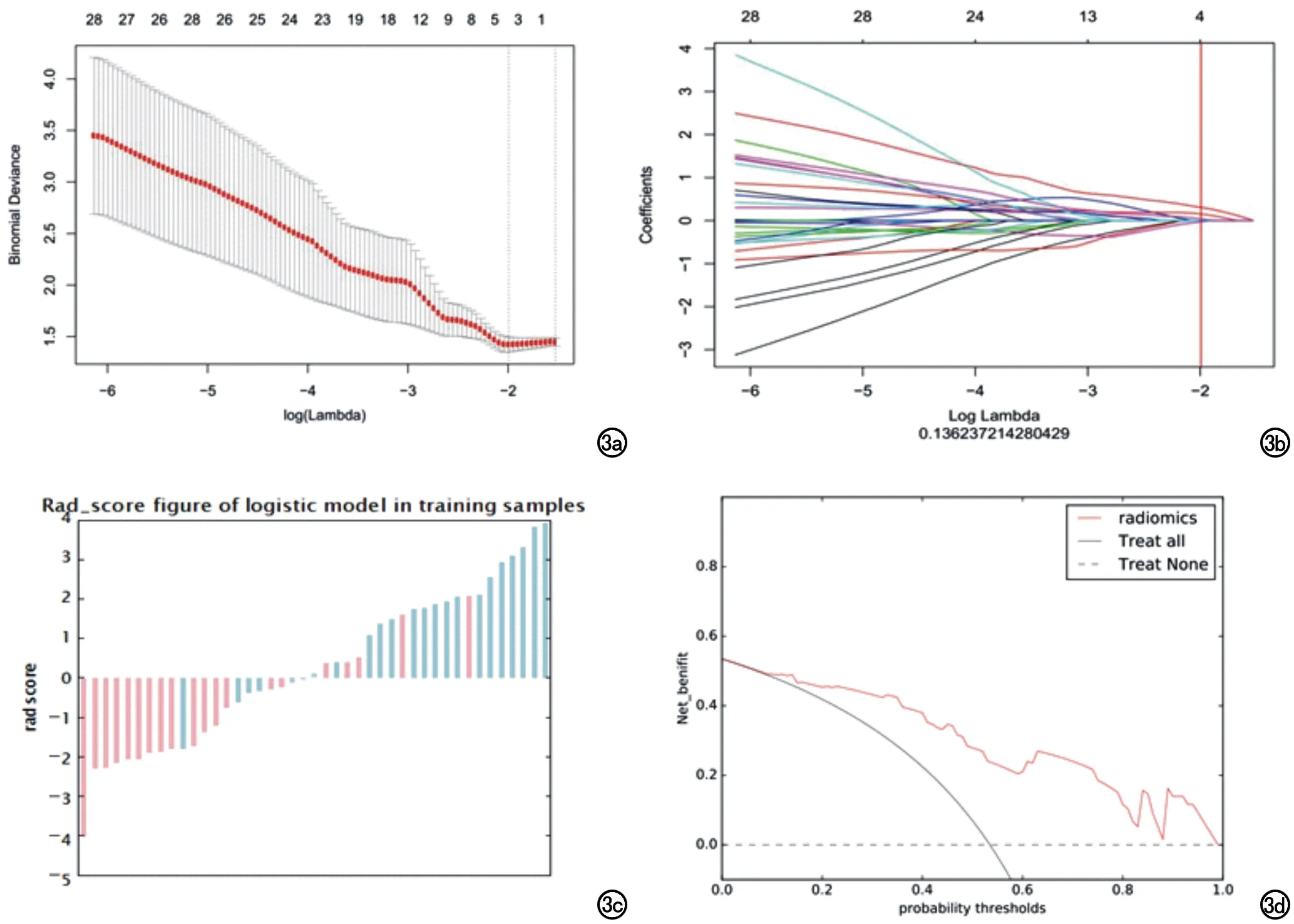
图3 a) 模型一LASSO算法调节参数log(alpha)的选择; b) 模型一308个组学特征在模型中的系数,垂直线表明经过3折交叉验证后的最佳选择log(alpha),获得4个系数非零的特征; c) 模型一的预测分值图,粉色代表无病灶组,蓝绿色代表有病灶组,分值越大越倾向于有病灶; d) 模型一的DCA曲线,表示不同风险阈值下的净获益。
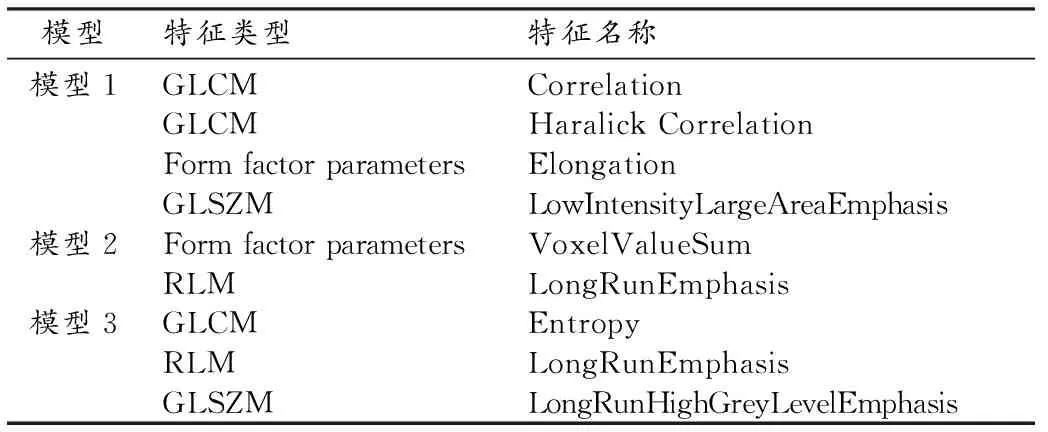
表1 构建3个模型的T2WI纹理特征

表2 构建的3个模型的诊断效能
讨 论
1.基于MR T2WI纹理分析对PCa ADT后指导临床治疗的意义
早期测量体内对治疗反应的能力可能是预测结果的一个有力工具,并有助于选择需要进一步辅助治疗的患者。顾伟光等[12]研究发现DCE-MRI定量参数在PCa内分泌治疗后有改变,可用于临床PCa疗效检测指标PSA的补充,以提高对治疗后肿瘤的检测效能,与本研究有相同初衷。Groenendaal等[13]采用多元线性回归分析,研究了ADT后0~3个月和≥3个月患者的DWI和DCE-MRI参数图的差异,结果发现≥3个月ADT组肿瘤组织的扩散和灌注明显高于0~3个月ADT组,肿瘤的显著性降低。在≥3个月治疗组的患者中,可以根据MR图像确定可疑病灶指导放射治疗。在目前的临床实践中,ADT和体外照射治疗(external beam radiotherapy,EBRT)的结合被认为是金标准治疗[14-15]。在许多研究中,治疗模式若从单纯的ADT转向ADT联合EBRT,这种变化将大大延长PCa患者的存活率[16]。所以ADT治疗期间检出前列腺癌就显得异常重要。笔者建立的模型一中Correlation_angle135_offset4、Haralick Correlation_AllDirection_offset4_SD、Elongation、LowIntensityLargeAreaEmphasis这四个纹理特征的组合可以将不同的治疗效果区分开,AUC达到0.84,虽然在模型中出现了6例假阴性但是它们的共同特点是外周带治疗后腺泡萎缩在T2WI信号减低,病灶的显著性减低像素值与周围良性组织难以识别。5例假阳性,由于治疗后外周带在T2WI出现局限性低信号影,但在DWI及ADC图并没有表现出恶性征象,所以敏感度、特异度低是模型未来需要改进的重点。作为预测模型,纹理特征在评估疗效方面具有可行性,后期通过提高数据量,有望进一步增加模型诊断的符合率,纹理特征可作为ADT患者是否需要进一步EBRT干预的独立纳入标准。
2.基于MR T2WI纹理分析检出ADT后残存病灶的价值
ADT导致前列腺腺泡萎缩、纤维化和基底细胞增生,从而减少总腺体间质组织,最终导致总腺体积减少。同时正常外周带T2信号减低,从而影响肿瘤边缘的区分,在扩散加权成像中扩散受限,导致整个前列腺信号有所增高[17],目前采用mp-MRI方法判定ADT后PCa符合率尚不理想,纹理分析能够提供丰富的定量特征,在PCa的诊断和治疗评估中有良好的应用前景[18]。在模型二与模型三探讨了区分前列腺良性组织和肿瘤组织的可行性,AUC分别为0.91、0.87。Daniel等[19]研究了经ADT治疗后使用mp-MRI纹理分析从良性组织中分离肿瘤组织,结果发现纹理特征在肿瘤和周围健康组织之间存在差异,为下一步EBRT的局灶治疗提供基础,与本研究结果一致。在模型二中体素像素值总和(voxel value sum)表现出差异,原因可能在于ADT治疗之后病灶明显缩小,而中央腺体积较大进而影响像素点总和,使得其表现出优势,但是符合我们的模型。在组织分类功能方面,模型二及模型三的T2WI纹理特征优于相应的直方图参数,证明T2WI纹理特征可以很好地将ADT治疗后肿瘤与周围良性组织区分开。
本研究尚存在一定的局限性:①由于样本量有限,未能构建验证集对模型进行进一步验证,但笔者在筛选参数时,采用3折交叉验证方法,可以在一定程度上避免模型过度拟合。②本研究的总人数较少(n=43),只探讨了ADT后的疗效评估,后期我们将通过提高数据量将MR纹理特征与前列腺病理及组织学联系起来。③本研究只使用了MR T2WI提取特征,因其能够提供高分辨率图像可进行精确的ROI勾画直接影响提取特征的结果,由于DWI信噪比低、分辨率不足未能将其作为分析模型[20-21]。④目前的研究只能对ADT治疗患者进行指导,不能为精准放疗提供肿瘤勾画的技术支持,但所提出的结果为下一步干预治疗奠定了基础。随着ADT患者人数增加,临床需要评估ADT的疗效以及提高对病灶检出,为下一步诊疗计划提供依据。
综上所述,MR T2WI纹理分析可用于前列腺癌ADT的疗效评估并可检出治疗后残存的病灶,对临床PCa进一步诊疗计划具有重要的价值。

