菌株Cupriavidus sp. DT-1对液体和土壤中TCP的降解
陆 鹏,周 慧,袁 梦
菌株sp. DT-1对液体和土壤中TCP的降解
陆 鹏*,周 慧,袁 梦
(安徽师范大学生命科学学院,安徽省分子酶学与重大疾病机理研究重点实验室,安徽 芜湖 241000)
采用液质联用(HPLC-MS)的方法检测菌株Cupriavidus sp. DT-1降解2-羟基吡啶(2-HP)的代谢产物.并用三亲结合、荧光定量PCR (q-PCR)方法评价降解菌对3,5,6-三氯-2-吡啶酚(TCP)污染土壤的修复效果.结果表明,菌株可以进一步降解2-HP,依次生成尼古丁蓝、马来酰胺酸和反丁烯二酸,直至转化成菌株DT-1生长的碳源.接种菌株DT-1对污染土壤中TCP的降解起到较大的促进作用,2组试验土壤中TCP(50mg/kg)降解率分别为94.4%和86.7%,未接种菌株的土壤中TCP降解率仅为20.4%和28.4%.带有绿色荧光蛋白基因gfp标记的菌株DT-1-gfp可在土壤中存活35d以上,并对TCP污染土壤的细菌群落丰度有显著的恢复作用.
sp. DT-1;3,5,6-三氯-2-吡啶酚(TCP);2-羟基吡啶(2-HP);生物修复
3,5,6-三氯-2-吡啶酚 (TCP)是一种典型的有机氯污染物,在自然环境中半衰期长达65~360d[1].它是毒死蜱降解的主要产物,由于其具有比母体化合物更强的水溶性和流动性,因此可引起水环境和土壤更广泛的污染[2-8].2-羟基吡啶 (2-HP)是一种-杂环类有机污染物,具有一定的生物毒性和抗生物降解特性[9].此类污染物水溶性强,容易渗入地下水和土壤,对生态环境和人类健康构成威胁[10-11]. TCP和2-HP两种物质在结构上具有很大相似性,均以吡啶作为母体化合物,其区别仅在于氯原子数目的不同.同时2-HP也是TCP、尼古丁等-杂环类化合物降解的主要中间代谢产物[12-13].因此,2-HP与TCP的降解是紧密联系的,去除环境中2-HP的残留不仅可消除其污染,同时对修复其前体剧毒化合物TCP造成的生态破坏具有重要意义.微生物降解具有效率高、成本低、无二次污染等特点,是消除TCP残留的一种环境友好型方法[14-15].目前各国学者已经从不同属微生物中分离获得多种具有降解TCP能力的菌株,包括[5]、、、、、、、、、、等[16-27].然而,TCP的完整生物降解途径仍然是未知的.多个研究表明3,6-二羟基吡啶-2,5-二酮是TCP降解过程中常见的中间代谢物[5,20,28].sp. DT-1是课题组前期分离获得的TCP降解菌株,与其他菌株不同,DT-1具有独特的TCP降解途径,以2-HP为主要中间代谢产物,并对其进一步矿化,达到完全降解TCP的效果[12].前期已推导出TCP降解为2-HP的代谢途径,然而2-HP的后续降解过程尚不清楚.
本研究探究了菌株DT-1在液体培养基中对TCP和2-HP的降解,鉴定出2-HP降解的代谢产物,结合前期研究成果,推导出菌株DT-1降解TCP的完整代谢途径.同时通过荧光标记,构建基因工程菌,结合qPCR的方法,研究了菌株DT-1对土壤中TCP的降解及其存活能力,评价降解菌对TCP污染土壤的生物修复效果.
1 材料与方法
1.1 试验材料
TCP (纯度≥99%)、2-HP (纯度≥99%)购自一基实业有限公司(中国上海),用无菌水配制成10g/L的浓缩原液.甲醇(HPCL级)和其他试剂(AR级)均购自上海化学试剂有限公司(中国上海).
菌株sp. DT-1为本实验室分离获得;SM10 (pir) pUT- mini-Tn5-(Ampr),HB101pRK2013 (Kmr),PowerSoil DNA Isolation Kit试剂盒,qPCR相关试剂购自南京金斯瑞生物科技有限公司(中国南京).
LB培养基(g/L):蛋白胨10.0,酵母膏5.0, NaCl 10.0, pH值7.0.基础盐培养基(MSM)(g/L):NH4NO31.0, K2HPO41.5, KH2PO40.5, NaCl 0.5, MgSO40.2, pH值7.0.配制好的培养基于121.3℃灭菌30min.
1.2 菌液制备
菌株DT-1在LB培养基(30℃,180r/min)中培养至指数期,于室温6000离心5min收集菌体.用灭菌的MSM洗涤细胞2次,并重悬至浓度约2× 108CFU/mL.在液体培养基中进行降解试验时,细胞接种浓度约为1×107CFU/mL.
1.3 菌株DT-1对TCP和2-HP的降解
降解试验分别在含50mg/L TCP和500mg/L 2-HP的100mL MSM中进行.试验组接种降解菌后于30℃,180r/min培养24h,每2h收集3mL样品,测定TCP和2-HP浓度.所有样本均做3组重复.
1.4 菌体生长量测定
采用上述方法培养菌体,定时取样1mL,10倍梯度稀释获得10-4~10-1稀释液,取0.2mL涂布在LB平板上,30℃恒温培养48h,选择菌落数在30~300的平板进行计数.
1.5 化合物提取和检测
采用高效液相色谱法(HPLC)检测样品中TCP的浓度.样品(3mL)在15000下离心10min,上清液过0.2μm微孔滤膜.冷冻干燥后,溶解于2mL色谱纯甲醇,用配备SPD- M20A紫外检测器(190~800nm)和Agilent C-18柱(250mm×4.6mm, 5μm)的岛津LC-201A高效液相色谱仪进行分析.流动相为甲醇/水(80:20,/),在柱温25℃下以1.2mL/min的流速输送.检测波长230nm.在0.1~100mg/L浓度区间建立标准曲线,确定TCP的浓度.检测限(LOD)为0.016mg/L,定量限(LOQ)为0.057mg/L.在0.1~ 100mg/L浓度范围内,回收率为96.5%~101.5%,相对标准偏差(RSD)为1.10%~2.84%.用同样的方法检测2-HP浓度.浓度在0.1~100mg/L之间建立标准曲线,回收率和RSD分别为94.6%~103.8%和1.37%~ 2.66%,LOD为0.021mg/L,LOQ为0.075mg/L.
以500mg/L 2-HP为唯一碳源培养菌株DT-1,定时从培养物中收集样品,15000离心10min,上清经0.2μm纤维过滤器过滤后,冷冻干燥,溶解于1mL色谱纯甲醇中,HPLC-MS分析(Finnigan TSQ Quantum Ultra, Thermal, USA),利用电子喷雾进行负离子质谱电离,在质量范围为30~400/的条件下检测,鉴定2-HP降解产物.
1.6 菌株DT-1对土壤中TCP的降解
试验所用的土壤样本分别来自安徽师范大学校园和一处此前未接触TCP的农田土壤.样品风干,筛至2mm均匀颗粒.取20g样品,105℃干燥24h,测定样品的含水量.采用凯氏定氮法测定土壤总氮和硝酸盐氮[29];采用重铬酸钾容量法测定有机质[30],土壤样品的部分特性见表1.

表1 土壤样品部分理化性质
玻璃烧杯(200mL)中加入100g土壤,添加TCP 至终浓度50mg/kg.试验组加入含菌株DT-1的MSM 培养基4.0mL,终浓度约为1×107细胞/g土壤.对照组则加入不含DT-1的MSM培养基(4.0mL).土壤样品在30℃无菌条件下培养,定期称重,重量损失通过添加无菌水来补偿.每5d收集5g土壤样品进行TCP浓度分析,共培养35d.
1.7 菌株DT-1的gfp标记
编码荧光蛋白的基因是可用于监测目的细胞最有用的生物标记物之一,在污染土壤的生物修复中有良好的应用前景[31-33].将菌株DT-1、SM10 (pir) pUT- mini-Tn5-和HB101pRK2013分别在LB培养基中培养12h.6000室温离心5min收集细胞,无菌水洗涤2次并重悬.将3种菌悬液各取5mL,6000离心5min,用20μL LB培养基重悬,将混合菌悬液铺在滤膜上,置于LB平板内30℃培养24h,用生理盐水洗涤并重悬细胞,涂布于含有100mg/L氨苄青霉素和卡那霉素的LB平板上,30℃培养24h后,在紫外灯下观察.
1.8 土壤中重组菌株计数
将1g土壤溶解在9mL无菌水中制成悬浮液,依次梯度稀释至10-4,取0.2mL稀释液涂布于LB平板上,30℃培养48h,置于紫外灯下检测,统计发出绿色荧光的菌落数.
1.9 荧光定量PCR分析
qPCR是分析土壤细菌丰度的有效手段[34],为了解接种外源微生物DT-1-对土壤细菌数量的影响,提取土壤总DNA,进行荧光定量PCR分析.取0.25g冷冻干燥后的土壤样品,采用PowerSoil DNA Isolation Kit试剂盒提取土壤总DNA.1.0%琼脂糖凝胶电泳检测,并用微量分光光度计(ND-1000, NanoDrop Technologies,美国)测定其浓度和纯度后保存于-20℃.qPCR反应体系如下:2 × SYBR Premix Ex Taq 10μL,10μmol/L上下游引物各0.5μL,模板DNA 1.0μL,无菌双蒸水8μL.标准曲线及每个样品重复3次,同时设置空白对照.qPCR反应所用引物338F (5’-ACTCCTACGGGAGGCAGC AG-3’)和518R (5’-ATTACCGCGGCTGCTGG-3’),反应条件94℃预变性2min,94℃变性30s,55℃退火30s,72℃预延伸30s,35个循环[35].
1.10 数据处理
试验数据使用SPSS 18.0进行统计分析,采用单因素方差分析(one-way ANOVA)和邓肯(Duncan)法多重比较检验各处理间的差异显著性(<0.05).
2 结果与讨论
2.1 液体培养基中TCP和2-HP的降解
如图1所示,接种后2h,两种物质的浓度均没有明显变化,这是由于菌株需要适应新的环境,而负责降解的酶还没有合成.2~10h,TCP的浓度急剧下降,而2-HP的浓度迅速上升,说明菌株DT-1开始表现出以2-HP为主要产物的TCP降解活性.然而2-HP的总浓度小于减少的TCP浓度,表明2-HP被菌株DT-1进一步降解(图2).在10~18h,TCP被完全降解, 2-HP的浓度也随之迅速下降,直到消失.
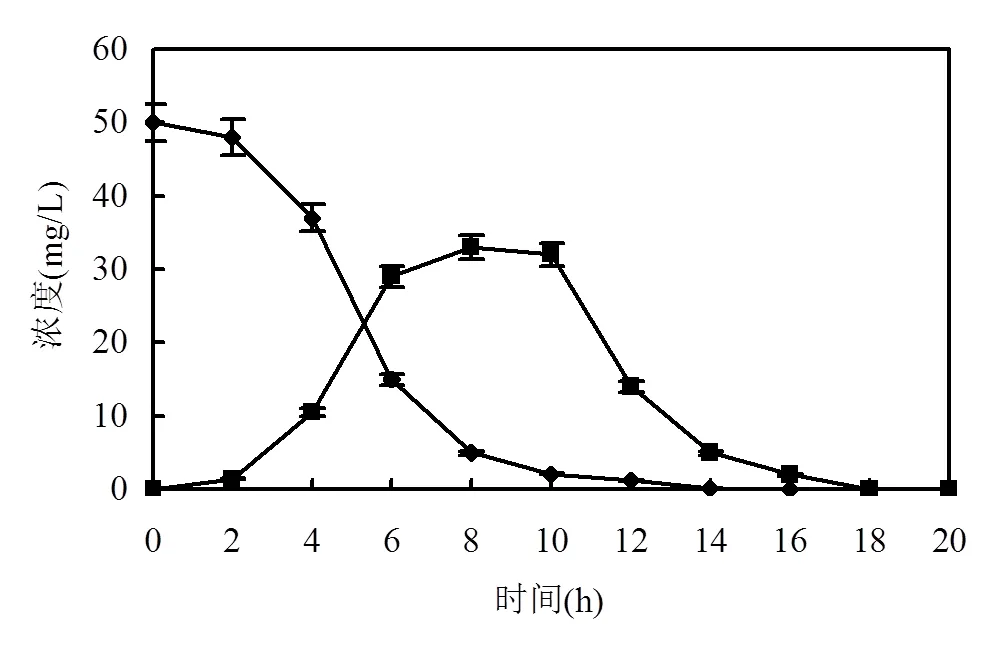
图1 菌株DT-1对TCP和2-HP的降解
◆ TCP浓度; ■ 2-HP浓度
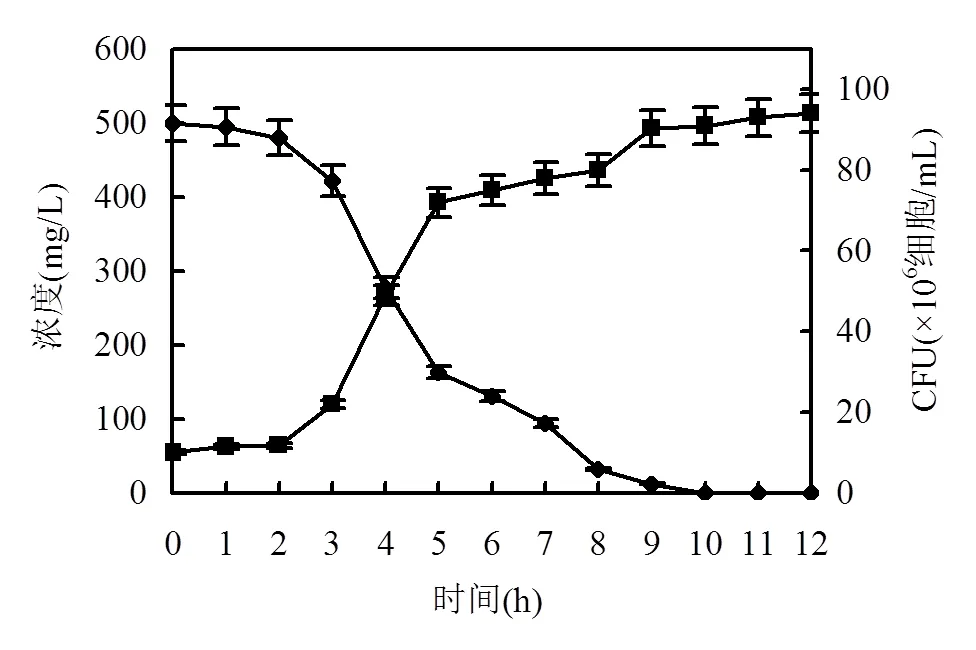
图2 菌株DT-1利用2-HP作为唯一碳源的生长降解
◆ 2-HP浓度; ■ 细胞浓度
菌株DT-1在10h内可降解500mg/L高浓度的2-HP,并以其作为生长的唯一碳源.菌株生长和2-HP降解主要发生在接种后2~8h (图2).本研究中TCP的最佳初始降解浓度较低,因为高浓度TCP对微生物有较大毒性.而2-HP对微生物的毒性较低,因此本研究采用较高初始浓度的2-HP作为降解底物,以获取高浓度的代谢产物,便于后续鉴定.
研究表明,菌株sp. T6、sp. P2和X1T可降解TCP并产生3,6-二羟基吡啶-2,5-二酮,这是一种可以进一步矿化分解的中间代谢物[1,5,20].由于未能检测到后续降解产物,因此完整的降解途径尚不清楚.Wang等[8]发现了一种能够在厌氧条件下降解TCP的微生物菌群,推测了TCP从脱氯到吡啶环裂解的完整降解途径.前期研究表明菌株DT-1能够在好氧环境中通过三步脱氯将TCP降解为2-HP[12].这是一种新型的TCP生物降解途径.为完善该途径,2-HP的后续降解过程尚需研究.
2.2 2-HP的降解途径研究
近几十年来,2-HP的生物降解途径已有了较深入的研究.其一是2-HP首先转化为二羟基吡啶,再进一步裂解吡啶环.不同微生物产生不同的最终代谢物,如反丁烯二酸[36-37]、5-氨基-5-氧-2-戊烯酸、琥珀酸半醛[38].其二是2-HP首先转化为三羟基吡啶,产生蓝色物质[39].在不同微生物作用下,最终代谢产物为延胡索酸[40]、丁二醛[41]和α-酮戊二酸[42].本研究通过HPLC检测了2-HP及其降解的代谢产物.结果见图3.
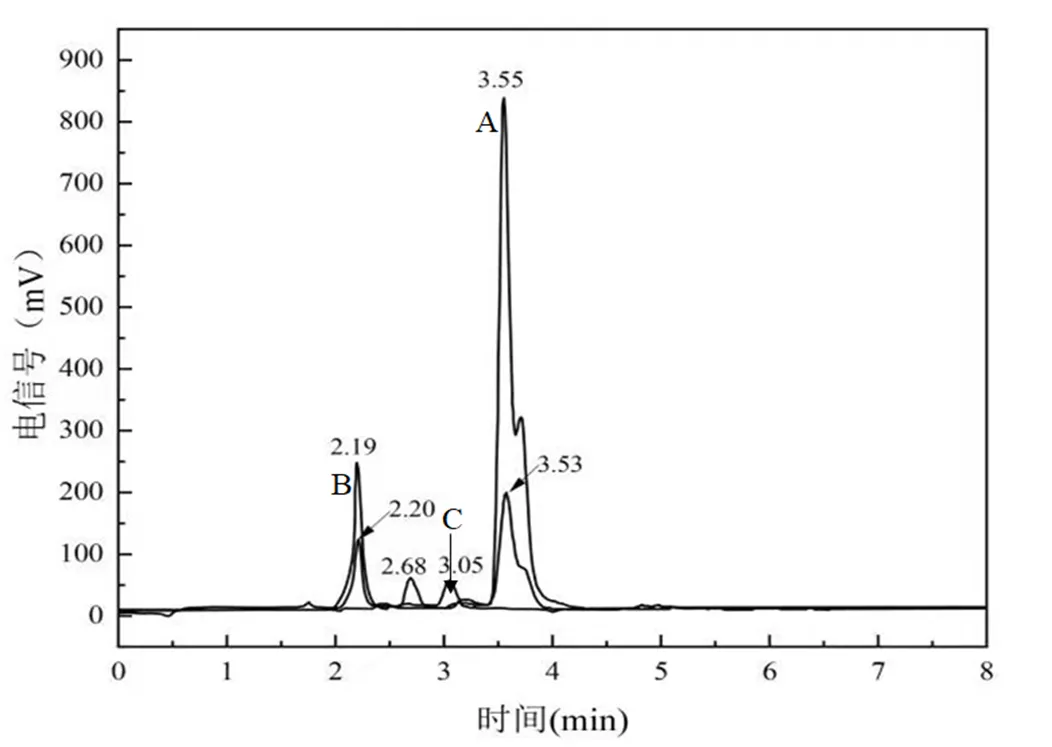
图3 2-HP及其降解产物的液相检测图谱
A.接种0h (RT= 3.55min); B.接种6h (RT= 2.19, 2.68和3.53min); C.接种10h (RT= 2.20和3.05min)
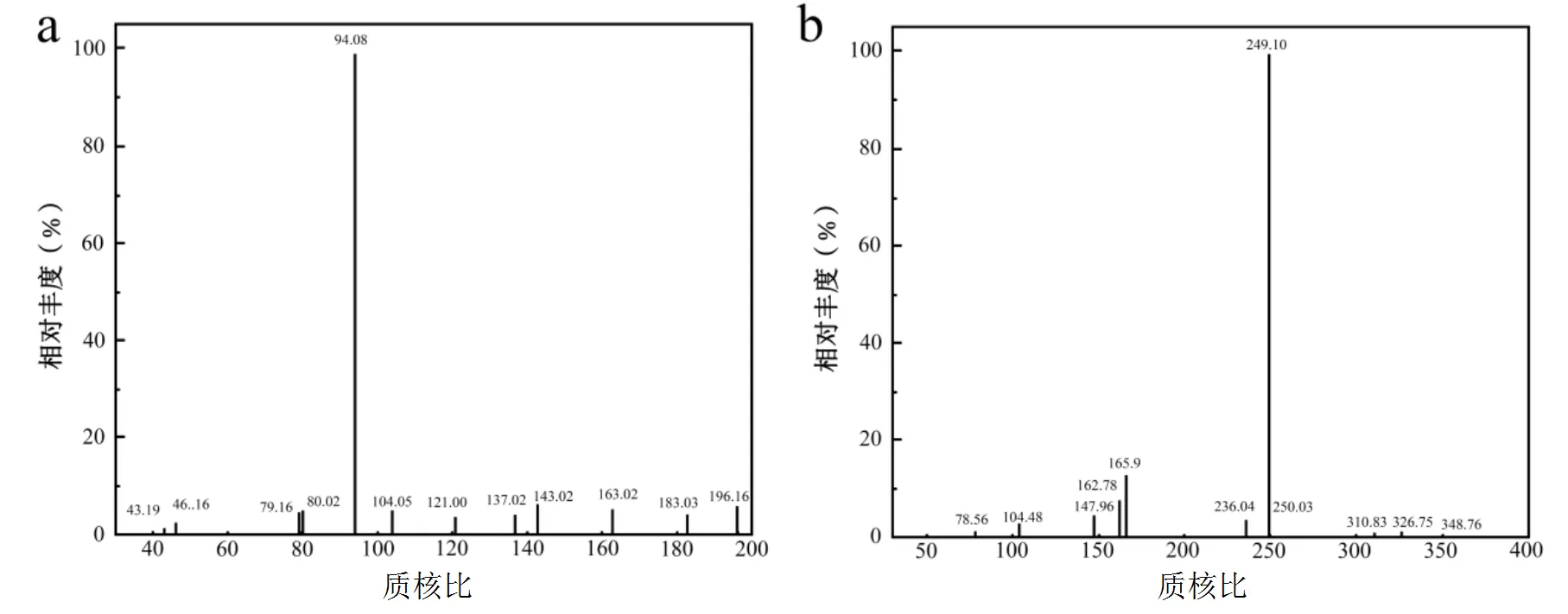
a. 2-HP MS图谱; b. 蓝色化合物MS图谱; c. 保留时间2.19min化合物的MS图谱; d. 保留时间3.05min化合物的MS图谱
2-HP的保留时间为3.55min (图3中A峰).接种菌株DT-1 6h后,培养基颜色变蓝,液相检测到3种化合物,保留时间分别为2.19, 2.68和3.53min (图3B).其一为2-HP (保留时间3.53min),另外两种应为其降解产物.在接种10h的样品中检测到两种化合物,一种保留时间为2.20min,与6h收集的样品中检测到的化合物相同,另一种新的代谢产物保留时间为3.05min (图3中C峰).
质谱结果显示,保留时间为3.55min的物质脱质子化离子/= 94.08 [M-H]-,与2-HP的分子离子相匹配(图4a).保留时间为2.68min(/=249.10 [M-H]-)的化合物(图4b)被鉴定为尼古丁蓝,它使培养基由无色变为蓝色.这说明2-HP的降解产生了2,3,6-三羟基吡啶(2,3,6-THP),并进一步在有氧环境下氧化成尼古丁蓝,这是一个可逆反应.因此保留时间为2.19和3.05min的物质应为2,3,6-THP的降解产物,分别为马来酰胺酸(/= 114.08[M-H]-) (图4c)和延胡索酸(115.10[M-H]-)(图4d).该结果表明菌株DT-1对2-HP的降解途径与菌株sp. (PNO)降解2-HP的途径相同[35],这是首次在革兰氏阴性菌中发现此途径.结合前期结论,推测菌株DT-1降解TCP的完整代谢途径如图5所示.
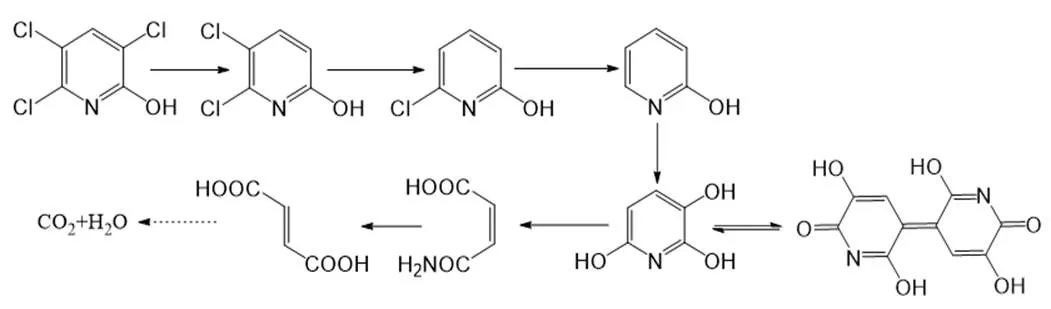
图5 菌株DT-1降解TCP的代谢途径
研究表明,能够将2-HP转化为蓝色物质的细菌均为革兰氏阳性菌.本研究检测了革兰氏阴性细菌DT-1降解2-HP的代谢产物,并提出降解途径.发现2-HP降解产生的主要中间代谢物是一种蓝色物质尼古丁蓝.这是一个新的发现,揭示了菌株DT-1降解2-HP的机制.
2.3 菌株DT-1对土壤中TCP和2-HP的降解
如图6所示,在含50mg/kg TCP的校园土壤中,接种菌株DT-1,培养35d后TCP浓度下降到2.8mg/kg (降解率94.4%),大部分降解发生在10~ 30d之间.降解产生的2-HP浓度很低,最高仅有9.8mg/kg.表明2-HP产生后被立即降解.在未接种的土壤中,约20.4%的TCP在35d内自然降解,没有检测到2-HP.农田土壤中TCP的整体降解趋势与校园土壤相似.但接种降解菌后的降解率(86.7%)略低于校园土壤(94.4%).未接种的农田土壤中TCP的降解率(28.4%)高于未接种DT-1的校园土壤(20.4%).这可能是由于农田土壤中营养物质丰富,使得土著微生物更加活跃,具有更强自净能力,但这也竞争性地抑制了菌株DT-1的繁殖.该结果表明菌株DT-1在不同类型的土壤环境中都具备降解TCP的能力.
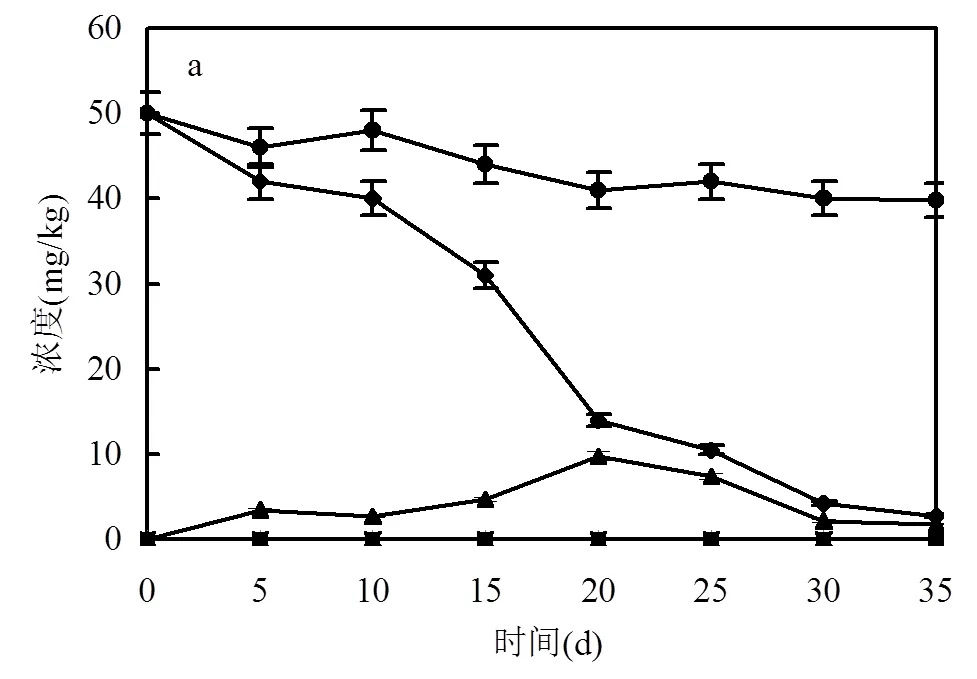
a. 校园土; b. 农田土. ● 对照组土壤中TCP浓度; ◆ 接种DT-1后土壤中TCP浓度; ▲ 接种DT-1后土壤中2-HP浓度; ■ 对照组
土壤中2-HP浓度
2.4 菌株DT-1的gfp标记和示踪
为了观察菌株DT-1在土壤中的存活情况,将荧光标记基因导入菌株内,构建基因工程菌,命名为DT-1-.图7为菌株DT-1和DT-1-在紫外光下的菌落形态,对照株DT-1无光泽,而DT-1-发出绿色荧光,说明基因在菌株DT-1-中高效表达.
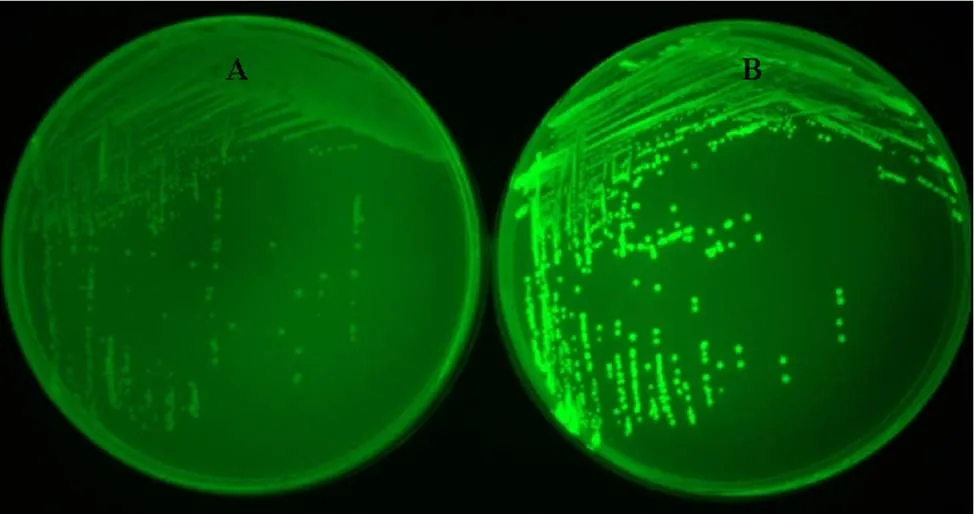
图7 菌株DT-1和DT-1-gfp在紫外灯下的菌落照片
(A) DT-1; (B) DT-1-
工程菌在普通LB平板上无选择压力连续培养20代,在荧光显微镜下观察到同样的效果,表明基因在菌株DT-1中稳定遗传.降解试验结果表明,菌株DT-1-的特性与菌株DT-1一致.因此,基因工程菌在功能上与原菌株相当,可用于TCP污染土壤的生物修复.表2为接种后菌株DT-1-在土壤中的存活情况.接种的初始细胞浓度为1×107CFU/g土壤,前7d由于土壤中支持细胞生长的营养物质较为丰富,细菌数量略有增加.7~21d,由于土壤中本地微生物的增殖竞争性抑制了DT-1-的繁殖,目的细菌总量急剧减少,且农田土壤的抑制作用强于校园土壤.21~35d,目的细菌种群保持稳定,没有显著下降,说明土壤微生物群落达到了平衡状态.结果表明,菌株DT-1-能够适应复杂的土壤环境,并可存活足够的时间来发挥其生物修复作用.

表2 菌株DT-1-gfp在校园和农田土壤中的含量(´106CFU/g)
2.5 降解菌对土壤细菌数量的影响
添加TCP的两种土壤中细菌16S rRNA拷贝数在不同培养阶段均始终低于原始土壤(表3),表明TCP对土壤微生物具有明显的毒性;添加TCP+ DT-1-处理的16S rRNA拷贝数在两种土壤的培养前期(7d)均显著低于对照,说明TCP的毒性作用依然存在;随着DT-1-在土壤中的定殖和对TCP降解作用,添加了DT-1-的土壤中细菌数量逐渐上升,在35和56d均与对照无显著差异,该结果表明TCP的毒性因为DT-1-的降解作用而逐渐减弱,初步证实降解菌施加对污染土壤中微生物生态有显著的恢复作用.然而降解菌的添加对土壤微生物群落结构的影响目前尚未探明,后续将以此为中心逐步开展研究,以期提高降解菌的应用潜力,并评价其生态安全性.
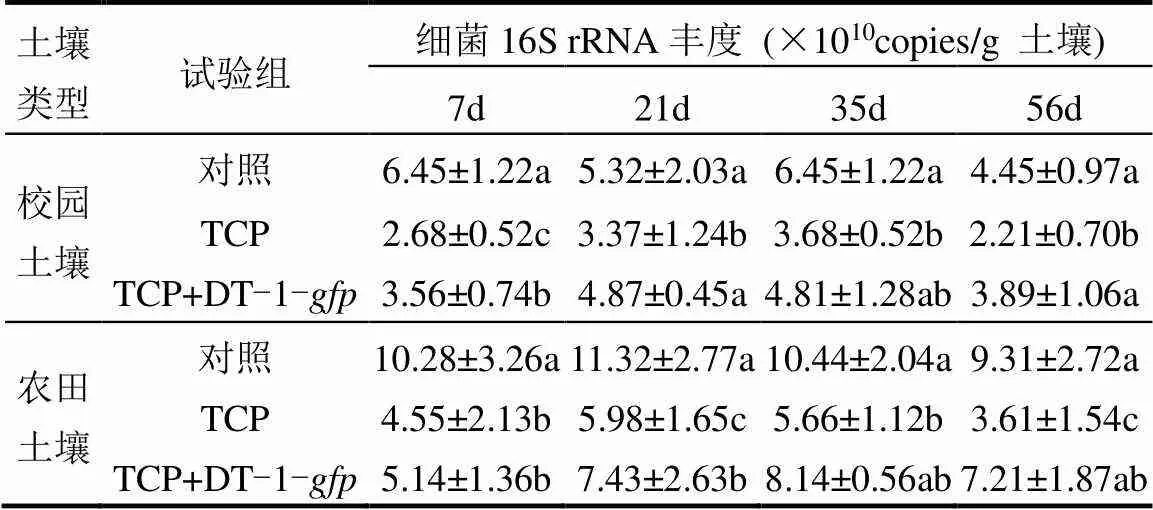
表3 TCP及菌株DT-1-gfp对土壤细菌数量的影响
注:同一列数据后不同字母表示不同处理间差异达到5%显著水平.
由于对高毒有机磷农药的限制和禁止,以毒死蜱为代表的低毒有机磷农药的市场需求不断增加.这不可避免地增加了TCP在环境中积累.TCP的积累强烈地抑制了微生物的生长,而微生物生长的抑制又加剧了TCP的积累,不仅阻碍了TCP本身的降解,还抑制了母体化合物毒死蜱以及其他有机化合物的降解[15,20,43],使农药残留对环境造成的污染进一步加剧.
基于微生物降解的污染土壤生物修复策略的发展逐渐被各国学者所重视.生物修复作为一种高效、廉价的生物技术手段,对其研究逐渐深入,并将大规模应用于污染环境的治理[44-48].然而,TCP在土壤中的生物降解研究报道较少,多数研究都集中在毒死蜱污染土壤的生物修复方面.本研究以TCP作为污染底物,研究了不同环境中微生物对其降解作用,结果表明菌株DT-1能够有效降解水体和土壤中的TCP,在TCP污染农田的生物修复中具有很大的应用潜力.
3 结论
3.1 菌株DT-1可利用2-HP为唯一碳源进行生长,并降解浓度为500mg/L的2-HP.HPLC-MS检测到3种代谢产物尼古丁蓝、马来酰胺酸和反丁烯二酸. TCP在菌株DT-1作用下经过3步脱氯反应生成2-HP,进而依次代谢产生尼古丁蓝,马来酰胺酸和反丁烯二酸,最终被彻底矿化分解.
3.2 菌株DT-1可降解土壤中浓度为50mg/kg的TCP,在两类不同的土壤中35d内的降解率分别为94.4%和86.7%,并能对代谢产物2-HP进一步降解,大部分降解发生在10~30d之间.而作为对照的未接种菌株DT-1的土壤中,自然状态下降解的TCP不产生2-HP.
3.3 基因工程菌DT-1-的降解特性、效果与原始菌株相同,并能在土壤中长时间存活,且添加降解菌后对TCP污染土壤细菌群落丰度有一定的恢复作用,表明该菌株具备应用于TCP污染土壤生物修复的潜力.
[1] Fang L C, Shi T Z, Chen Y F, et al. Kinetics and catabolic pathways of the insecticide chlorpyrifos, annotation of the degradation genes and characterization of enzymes TcpA and Fre inX1T[J]. Journal of Agricultural and Food Chemistry, 2019,67(8):2245-2254.
[2] 陈诗卉,姜锦林,张换朝,等.毒死蜱在我国水稻上登记现状及水生态风险评估 [J]. 中国环境科学, 2020,40(8):3585-3594.
Chen S H, Jiang J L, Zhang H C, et al. Registration status of chlorpyrifos products for use on rice and its risk assessment for aquatic ecosystem in China [J]. China Environmental Science, 2020,40(8): 3585-3594.
[3] Yang L, Zhao Y H, Zhang B X, et al. Isolation and characterization of a chlorpyrifos and 3,5,6-trichloro-2-pyridinol degrading bacterium [J]. FEMS Microbiology Letters, 2005,251(1):67-73.
[4] Kim J R, Ahn Y J. Identification and characterization of chlorpyrifos- methyl and 3,5,6-trichloro-2-pyridinol degradingsp. strain KR100 [J]. Biodegradation, 2009,20(4):487-497.
[5] Li J Q, Liu J, Shen W J, et al. Isolation and characterization of 3,5,6-trichloro-2-pyridinol degradingsp. strain T6 [J]. Bioresource Technology, 2010,101(19):7479-7483.
[6] Rayu S, Nielsen U N, Nazaries L, et al. Isolation and molecular characterization of novel chlorpyrifos and 3,5,6-trichloro-2-pyridinol degrading bacteria from sugarcane farm soils [J]. Frontiers Microbiology, 2017,8:518.
[7] Dores E F G C, Spadotto C A, Weber O L S, et al. Environmental behavior of chlorpyrifos and endosulfan in a tropical soil in central Brazil [J]. Journal of Agricultural and Food Chemistry, 2016,64(20): 3942-3948.
[8] Wang S H, Zhang C, Lv Z W, et al. Degradation of 3,5,6- trichloro-2-pyridinol by a microbial consortium in dryland soil with anaerobic incubation [J]. Biodegradation, 2019,30(2/3):161-171.
[9] Lataye D H, Mishra I M, Mall I D. Removal of pyridine from aaqueous solution by adsorption on bagasse fly ash [J]. Industrial& Engineering Chemistry Research, 2006,45(11):3934-3943.
[10] Petkevičius V, Vaitekūnas J, Stankevičiūtė J, et al. Catabolism of 2-hydroxypyridine bysp. strain MAK1: a 2-hydroxypyridine 5-monooxygenase encoded bycatalyzes the first step of biodegradation [J]. Applied and Environ mental Microbiology, 2018,84(11):e00387-18.
[11] Chu L, Yu S, Wang J. Degradation of pyridine and quinoline in aqueous solution by gamma radiation [J]. Radiation Physics and Chemistry, 2018,144:322-328.
[12] Lu P, Li Q F, Liu H M, et al. Biodegradation of chlorpyrifos and 3,5,6-trichloro-2-pyridinol bysp. DT-1 [J]. Bioresource Technology, 2013,127:337-342.
[13] Yu H, Tang H Z, Zhu X Y, et al. Molecular mechanism of nicotine degradation by a newly isolated strain,sp. strain SJY1 [J]. Applied and Environmental Microbiology, 2015,81(1):272-281.
[14] Wang S H, Zhang C, Yan Y C. Biodegradation of methyl parathion and p-nitrophenol by a newly isolatedsp. strain Yw12 [J]. Biodegradation, 2012,23(1):107-116.
[15] 曹 礼,徐 琳.微生物降解3,5,6-三氯-2吡啶醇的研究进展 [J]. 微生物学通报, 2015,42(6):1158-1164.
Cao L, Xu L. Research progress in microbial degradation of 3,5,6- trichloro-2-pyridinol [J]. Microbiology China, 2015,42(6):1158-1164.
[16] Feng Y, Racke K D, Bollag J M. Isolation and characterization of a chlorinated-pyridinol-degrading bacterium [J]. Applied and Environ mental Microbiology, 1997,63(10):4096-4098.
[17] Xu G M, Zheng W, Li Y Y, et al. Biodegradation of chlorpyrifos and 3,5,6-trichloro-2-pyridinol by a newly isolatedsp. strain TRP [J]. International Biodeterioration & Biodegradation, 2008, 62(1):51-56.
[18] Anwar S, Liaquat F, Khan Q M, et al. Biodegradation of chlorpyrifos and its hydrolysis product 3,5,6-trichloro-2-pyridinol bystrain C2A1 [J]. Journal of Hazardous Materials, 2009,168(1): 400-405.
[19] Singh D P, Khattar J I S, Nadda J, et al. Chlorpyrifos degradation by the cyanobacteriumsp. Strain PUPCCC 64 [J]. Environmental Science and Pollution Research, 2011,18(8):1351- 1359.
[20] Cao L, Liu H M, Zhang H, et al. Characterization of a newly isolated highly effective 3,5,6-trichloro-2-pyridinol degrading strainP2 [J]. Current Microbiology, 2012,65(3):231- 236.
[21] Abraham J, Silambarasan S. Biodegradation of chlorpyrifos and its hydrolyzing metabolite 3,5,6-trichloro-2-pyridinol bysp. JAS3 [J]. Process Biochemistry, 2013,48(10):1559-1564.
[22] Silambarasan S, Abraham J. Efficacy ofsp. JAS4in bioremediation of chlorpyrifos and its hydrolyzing metabolite TCP from agricultural soil [J]. Journal of Basic Microbiology, 2014, 54(1):44-55.
[23] Jabeen H, Iqbal S, Anwar S. Biodegradation of chlorpyrifos and 3,5,6- trichloro-2 -pyridinol by a novel rhizobial strainsp. HN3 [J]. Water and Environment Journal, 2015,29(1):151-160.
[24] Abraham J, Silambarasan S. Biodegradation of chlorpyrifos and its hydrolysis product 3,5,6-trichloro-2-pyridinol using a novel bacteriumsp. JAS2: A proposal of its metabolic pathway [J]. Pesticide Biochemistry and Physiology, 2016,126:13-21.
[25] Bempelou E D, Vontas J G, Liapis K S, et al. Biodegradation of chlorpyrifos and 3,5,6-trichloro-2-pyridinol by the epiphytic yeastsand[J]. Ecotoxicology, 2018,27(10):1368-1378.
[26] Bhardwaj A, Verma N. Proficient biodegradation studies of chlorpyrifos and its metabolite 3,5,6-trichloro-2-pyridinol byNJ11strain [J]. Research Journal of Microbiology, 2018,13(1): 53-64.
[27] Aswathi A, Pandey A, Sukumaran R K. Rapid degradation of the organophosphate pesticide-chlorpyrifos by a novel strain ofAR-3 [J]. Bioresource Technology, 2019, 292:122025.
[28] Bhuimbar M V, Kulkarni A N, Ghosh J S. Detoxification of chlorpyriphos byNCIM 2103,NCIM 2010 andNCIM 2036 [J]. Research Journal of Environmental Earth Sciences, 2011,3(5):614-619.
[29] Bulluck L R, Brosius M, Evanylo G K, et al. Organic and synthetic fertility amendments influence soil microbial, physical and chemical properties on organic and conventional farms [J]. Applied Soil Ecology, 2002,19(2):147-160.
[30] Ciavatta C, Govi M, Antisari L V, et al. Determination of organic carbon in aqueous extracts of soils and fertilizers [J]. Communications in Soil Science and Plant Analysis, 1991,22(9/10):795-807.
[31] 魏明宝,方呈祥,张甲耀,等.绿色荧光蛋白标记在生物修复中的应用[J]. 中国环境科学, 2004,24(3):290-293.
Wei M B, Fang C X, Zhang J Y, et al. The application of EGFP marker in bioremediation [J]. China Environmental Science, 2004,24(3):290- 293.
[32] Errampalli D, Leung K, Cassidy M B, et al. Applications of the green fluorescent protein as a molecular marker in environmental microorganisms [J]. Journal of Microbiological Methods, 1999, 35(3):187-199.
[33] Elvang A M, Westerberg K, Jernberg C, et al. Use of green fluorescent protein and luciferase biomarkers to monitor survival and activity ofA6cells during degradation of 4-chlorophenol in soil [J]. Environmental Microbiology, 2001,3(1): 32-42.
[34] 陈 娜,刘 毅,黎 娟,等.长期施肥对稻田不同土层反消化细菌丰度的影响[J]. 中国环境科学, 2019,39(5):2154-2160.
Chen N, Liu Y, Li J, et al. Effects of long-term fertilization on the abundance of the key denitrifiers in profile of paddy soil profiles [J]. China Environmental Science, 2019,39(5):2154-2160.
[35] Fierer N, Jackson J A, Vilgalys R, et al. Assessment of soil microbial community structure by use of taxon-specific quantitative pcr assays [J]. Applied and Environmental Microbiology, 2005,71(7):4117-4120.
[36] Zhao S X, Hu C H, Guo L Z, et al. Isolation of a 3-hydroxypyridine degrading bacterium,sp. DW-1, and its proposed degradation pathway [J]. AMB Express, 2019,9(1):65-73.
[37] Stankevičiūtė J, Vaitekūnas J, Petkevičius V, et al. Oxyfunctionalization of pyridine derivatives using whole cells ofsp. MAK1 [J]. Scientific Reports, 2016,6(1):39129.
[38] Zefirov N S, Agapova S R, Terentiev P B, et al. Degradation of pyridine byandstrains [J]. FEMS Microbiology Letters, 1994,118(1/2):71-74.
[39] 胡春辉,徐 青,于 浩.sp. 2PR降解2-羟基吡啶动力学及降解特性研究[J]. 中国生物工程杂志, 2017,37(8):31-38.
Hu C H, Xu Q, Yu H. Characteristics and kinetic study of 2-hydroxypyridine degradation by a novel bacteriumsp. 2PR [J]. China Biotechnology, 2017,37(8):31-38.
[40] Shukla O P, Kaul S M. Microbiological transformation of pyridine N-oxide and pyridine bysp [J]. Canadian Journal of Microbiology, 1986,32(4):330-341.
[41] Khasaeva F, Vasilyuk N, Terentyev P, et al. A novel soil bacterial strain degrading pyridines [J]. Environmental Chemistry Letters, 2010,9(3): 439-445.
[42] Vaitekūnas J, Gasparavičiūtė R, Rutkienė R, et al. A 2- hydroxypyridine catabolism pathway instrain PY11 [J]. Applied and Environmental Microbiology, 2016, 82(4):1264-1273.
[43] Singh B K, Walker A, Morgan J A W, et al. Biodegradation of chlorpyrifos bystrain B-14and its use in bioremediation of contaminated soils [J]. Applied and Environmental Microbiology, 2004,70(8):4855-4863.
[44] 王海兰,臧海莲,成 毅,等.氯嘧磺隆降解菌的筛选及对污染土壤的生物修复 [J]. 中国环境科学, 2018,38(4):1473-1480.
Wang H L, Zang H L, Cheng Y, et al. Screening of a chlorimuron- ethyl-degrading strain and chlorimuron-ethyl-contaminated soil bioremediation [J]. China Environmental Science, 2018,38(4):1473- 1480.
[45] Semple K T, Reid B J, Fermor T R. Impact of composting strategies on the treatment of soils contaminated with organic pollutants [J]. Environ mental Pollution, 2001,112(2):269-283.
[46] Akbar S, Sultan S. Soil bacteria showing a potential of chlorpyrifos degradation and plant growth enhancement [J]. Brazilian Journal of Microbiology, 2016,47(3):563-570.
[47] Uqab B, Mudasir S, Nazir R. Review on bioremediation of pesticides [J]. Journal of Bioremediation and Biodegradation, 2016,7(3):343.
[48] Shishir T A, Mahbub N, Kamal N E. Review on bioremediation: a tool to resurrect the polluted rivers [J]. Pollution, 2019,5(3):555-568.
Biodegradation of 3,5,6-trichloro-2-pyridinol bysp. DT-1 in liquid and soil environments.
LU Peng*, ZHOU Hui, YUAN Meng
(Anhui Key Laboratory of Molecular Enzymology and Major Disease Mechanism research, College of Life Sciences, Anhui Normal University, Wuhu 241000, China)., 2021,41(6):2780~2787
sp. DT-1 was a 3,5,6-trichloro-2-pyridinol (TCP)-degrading strain which could transform TCP to 2-hydroxypyridine (2-HP). Liquid-mass spectrometry (HPLC-MS) was used to detect the degradation products of 2-HP, And the methods of triparetal conjugation, quantitative real-time PCR (q-PCR) were used to evaluate the remediation effect of TCP-contaminated soils by the degrading-bacterium. Results showed that strain DT-1 was able to further degrade 2-HP, and sequentially produced nicotine blue, maleamic acid and fumaric acid, until it was transformed into the carbon source that could support the growth of strain DT-1. Pilot experiment showed that inoculation of strain DT-1 remarkably accelerated the elimination of TCP in soils. The degradation rates of TCP in inoculated soils were 94.4% and 86.7%, while those in uninoculated soils were 20.4% and 28.4%, respectively. Green fluorescent protein encoding gene gfp harbored strain DT-1-gfp could survive in soils for more than 35d. The results of q-PCR showed that inoculation of strain DT-1-gfp significantly improved the recovery of bacterial community abundance in the TCP-contaminated soils.
sp. DT-1;3,5,6-trichloro-2-pyridinol (TCP);2-hydroxypyridine (2-HP);bioremediation
X172
A
1000-6923(2021)06-2780-08
2020-10-28
安徽省高校自然科学研究项目(KJ2020A0084)
* 责任作者, 讲师, lupeng_2007@126.com
陆 鹏(1986-),男,江苏徐州人,讲师,博士,主要研究方向为环境微生物学.发表论文8篇.

