聚酰亚胺/金属离子修饰的玻碳电极对过氧化氢的检测性能
李 雯,杨 添,苏丹丹,李小宁,王 月
(辽宁科技大学 化学工程学院,辽宁 鞍山 114051)
过氧化氢(H2O2)是一种致癌的有毒物质,经常作为工业废物被排到河水和地下水中,高浓度的过氧化氢会对环境造成毁灭性影响[1]。此外,过氧化氢可导致脱氧核糖核酸损伤和基因突变,并且与人体各种病变的发生有着密切的关系,长期接触会导致糖尿病和动脉粥样硬化等严重疾病[2]。因此,过氧化氢含量的测定在食品、生物、医药、环境和工业等领域具有至关重要的作用。目前过氧化氢的常用检测方法有滴定法、分光光度法和化学发光法等,然而这些方法有许多缺点,如预处理时间长、设备及试剂昂贵、需要专业人员测试以及对环境不友好等[3-7]。
电化学检测方法具有灵敏度高、选择性好、使用寿命长、操作简便、成本低廉和检测速度快等优点,因此成为检测过氧化氢浓度的最佳方法之一[1]。在电化学检测中,过氧化氢的氧化反应通常需要较高电势,并且由于传感器电极反应的动力学较慢等原因,传感器电极的修饰极为重要[8]。目前,电化学传感器测定过氧化氢有两种类型,一种是在电极表面固定生物酶的电化学生物传感器[9],通常具有较高的灵敏度及较低的检测限。但由于生物酶非常敏感,容易受外界条件如温度、湿度、pH等影响而失活,限制了生物传感器的应用。另一种是无酶传感器,即使用高性能材料作为电化学催化剂或氧化还原介体来降低电势并增强电子的转移[10]。无酶传感器由于没有生物成分,不需要温和的制备及检测条件,且电极材料易于保存,所制备的电化学传感器使用寿命长,稳定性好,因而成为电化学传感器领域研究的热点[11]。
聚酰亚胺(PI)是综合性能最佳的有机高分子材料之一,耐高温达400℃以上,长期使用温度范围在200~300℃之间,无明显熔点,高绝缘性能。PI具有优异的介电性能、机械性能以及耐高低温、耐腐蚀、耐烧蚀、耐辐射等特性,在各行各业都有着广泛的应用,如柔性薄膜、涂料和先进的复合材料等[12]。聚酰亚胺作为一种工程材料,已广泛应用在航空、航天、微电子、纳米、液晶、分离膜、激光等领域。
本文以聚酰亚胺为基底材料,利用镍、钴、铬、铁金属离子为导电介体,通过简单的物理混合法,将无机盐溶解在PI中,并且固定到玻碳电极(GCE)上,制备过氧化氢电化学传感器电极。既为聚酰亚胺的应用开辟了新路径,又为电化学传感器的发展提供了新颖的基底材料。
1 实验材料与仪器
1.1试 剂
硝酸钴(Co(NO3)2)、硝酸铬(Cr(NO3)3)、硝酸镍(Ni(NO3)2)、硝酸铁(Fe(NO3)3)、过氧化氢、抗坏血酸(AA)、盐酸多巴胺(DA)、尿酸(UA)、N,N-二甲基乙酰胺(DMAc)、磷酸氢二钾(K2HPO4)、磷酸二氢钾(KH2PO4)、无水乙醇购自国药控股化学试剂有限公司(中国北京),均为分析纯试剂。聚酰亚胺为实验室合成产品[13]。使用0.1 mol/L的K2HPO4和0.1 mol/L的KH2PO4制备各种pH值的磷酸盐缓冲溶液(PB)。实验用水为双蒸水。
1.2 实验仪器
CHI 750E型电化学工作站(上海辰华);PHS-25型号pH计(上海仪电科学仪器股份有限公司),85-1B型磁力搅拌器(巩义市予华仪器有限公司);TDL-80-2B低速离心机(上海安亭科学仪器厂);电子分析天平(上海精天电子仪器有限公司);密理博超纯水机(明澈TM-D24UV纯水/超纯水系统);德国ZEISS场发射扫描电子显微镜。
2 实验过程
2.1 修饰电极的制备
将GCE电极分别用直径为0.3μm和0.05μm的Al2O3抛光粉依次抛光,再分别用无水乙醇和去离子水超声洗涤15 min,室温自然晾干。称取15 mg的硝酸盐(Mt)于烧杯中,加入0.5 mL的DMAc作为溶剂,摇匀后超声1 h,再用离心机离心1 h,使硝酸盐溶解。同样,用DMAc溶剂,配制30 mg/mL的PI溶液。将硝酸盐溶液与PI溶液1:1混合,吸取混合溶液10μL,滴涂到GCE表面,阴凉处室温静置12 h,Mt/PI/GCE电极制备完成。
2.2 实验方法
实验采用三电极系统,Mt/PI/GCE电极为工作电极,铂丝电极为对电极,Ag/AgCl电极(饱和KCl)作为参比电极。电解质溶液为0.1 mol/L的K2HPO4和KH2PO4配制的磷酸盐缓冲溶液,pH=7.0。改变实验条件,包括金属离子种类、电解质溶液pH值、初始电位、金属离子浓度,利用电化学工作站考察所制备电极对过氧化氢的检测能力。
3 结果与讨论
3.1 Mt/PI材料表征
向聚酰亚胺溶液中分别添加钴、铬、镍、铁四种离子,利用场发射电子显微镜对四种金属离子掺杂的聚酰亚胺基材料进行形貌表征,结果如图1所示。单独的聚酰亚胺基底为深灰色的均匀基板。向其中引入金属离子后,均显现出球形的颗粒状表面,这些球形颗粒是金属离子的形貌特征,金属离子的直径在1.0~1.5μm之间。金属离子都均匀地嵌在聚酰亚胺溶液中,显著提高了聚酰亚胺的导电性,使掺杂后的聚酰亚胺能够应用在电化学传感器领域。

图1 金属离子掺杂PI的扫描电镜图Fig.1 SEM images of metal ion doped PI
3.2 Mt/PI/GCE对H2O2的电化学催化氧化
为了考察Mt/PI/GCE传感器对H2O2的催化氧化情况,按照上述电极制备步骤,分别制备了Co/PI/GCE、Cr/PI/GCE、Ni/PI/GCE和Fe/PI/GCE四种电极,在电解质溶液pH为7.0时,H2O2浓度为0、5和10 mmol/L,分别检测三种条件的循环伏安曲线,结果如图2所示。四种电极对H2O2均有着敏感的电催化检测性能,随着H2O2浓度增大,氧化电流值也不断增加。其中,Fe/PI/GCE对H2O2的电催化效率最高,对相同浓度的H2O2检测产生的峰值电流最大。

图2 Mt/PI/GCE对H2O2的电化学催化氧化CV图Fig.2 CV diagrams of Mt/PI/GCE for electrochemical catalytic oxidation of H2O2
通常,根据所采用的电极修饰材料不同,电化学传感器能够检测H2O2的氧化或还原电流。其中,由于氧气与H2O2的还原峰接近,电解质溶液中的溶解氧容易对检测H2O2造成干扰。而对H2O2氧化电流的检测可以有效地避免这个问题。依据φθ(Fe3+/Fe2+)=0.769 V,φθ(Cr3+/Cr)=-0.74 V,φθ(Ni2+/Ni)=-0.24 V,φθ(Co2+/Co)=-0.28 V,φθ(O2/H2O2)=-0.146 V,由于只有φθ(Fe3+/Fe2+)>φθ(O2/H2O2),判断只有Fe3+能够氧化H2O2,进而产生最大的电流响应。此外,Fe2+离子在电化学检测中能够产生协同作用[14],从而会增大电子传输速率,增大检测的电流值。
3.3 电解质溶液pH优化
传感器工作的酸碱度条件是重要参数,pH的大小不仅决定了电化学传感器的实际应用性能,也会影响检测底物性质是否会发生改变。为了考察四种电极的最适宜pH值,分别用制备的四种Mt/PI/GCE电极在pH为5、6、7、8、9、10、11和12条件下,检测浓度为1 mmol/L的H2O2,结果如图3所示。pH为8时,Fe/PI/GCE对H2O2的响应电流达到最大值;pH为9时,Co/PI/GCE对H2O2的响应电流最大;pH为10时,Cr/PI/GCE电极对H2O2的响应电流最大;pH为11时,Ni/PI/GCE电极对H2O2的响应电流最大。Fe/PI/GCE工作的最佳电解质溶液pH为8,更接近中性。因此,综合考虑响应信号的强度以及电解质溶液的pH值,掺杂铁离子的聚酰亚胺电极实际应用性能更好。
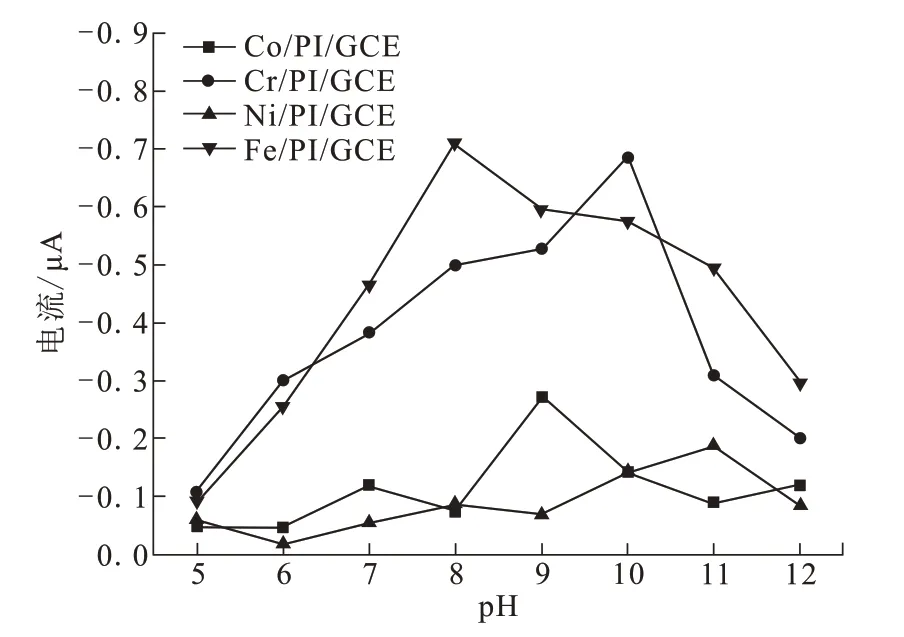
图3 电解质溶液pH对Mt/PI/GCE电极检测H2O2的影响Fig.3 Effects of electrolyte pH values on H2O2 detection of Mt/PI/GCE electrodes
3.4 外加电压优化
不同的外加电压值也会影响对H2O2的响应电流。将制备的四种电极分别在+0.3、+0.4、+0.5、+0.6和+0.7 V的外加电压下检测H2O2,H2O2浓度为1 mmol/L,电解质溶液的pH为各自最佳的pH条件,考察四种电极的最优外加电压条件,测试结果如图4所示。随着施加电压的增大,四种电极的电流值均逐渐增大,且Fe/PI/GCE电极比其它三种金属离子电极的响应电流更大。
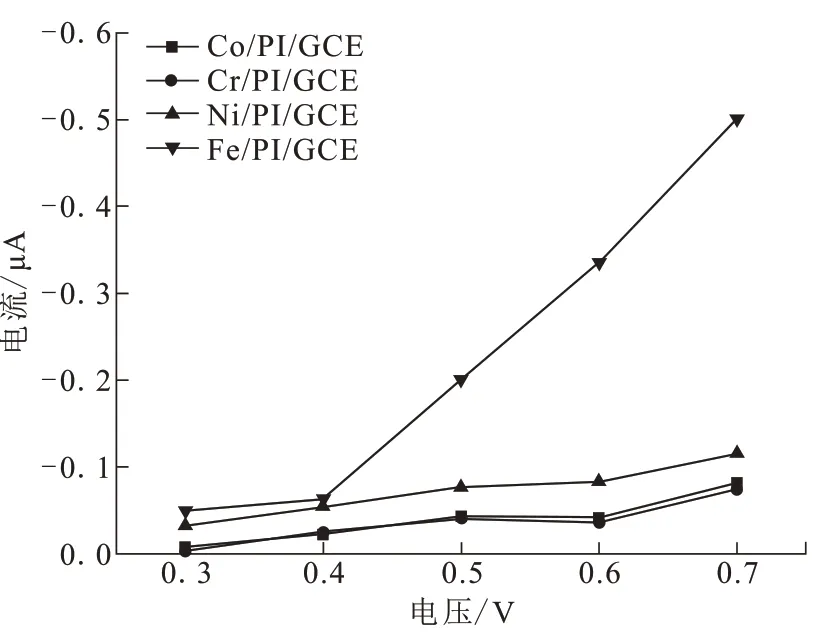
图4 外加电压对Mt/PI/GCE电极检测H2O2的影响Fig.4 Effects of applied potential on H2O2 detection of Mt/PI/GCE electrodes
3.5 金属离子浓度优化
为了考察金属离子浓度对H2O2传感器性能的影响,在上述最佳条件下,改变金属离子浓度,从5、10、15、20、25到30 mg/mL,分别考察四种金属离子对H2O2响应电流的影响,结果如图5所示。Co、Cr、Ni和Fe四种金属离子的最优化浓度分别为20、25、15和25 mg/mL。在优化以上参数后,制备的Fe/PI/CGE电化学传感器仍然对H2O2具有最好的检测效果。
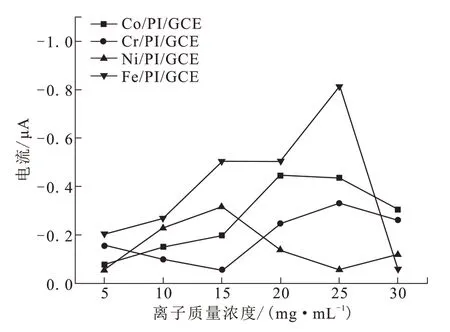
图5 金属离子浓度对Mt/PI/GCE电极检测H2O2的影响Fig.5 Effects of metal ion concentrations on H2O2 detection of Mt/PI/GCE electrodes
3.6 Fe/PI/GCE对H2O2检测的电化学性能
由于Fe/PI/GCE电极对H2O2表现出优异的检测性能,因此选择Fe/PI/GCE作为工作电极进行电化学性能的测试。在最优化条件下,在电解质溶液中添加10μmol/L、30μmol/L、0.1 mmol/L、0.3 mmol/L、1 mmol/L、3 mmol/L和10 mmol/L的H2O2,每个浓度滴加两次,Fe/PI/GCE对H2O2的电流响应曲线如图6a所示。该传感器表现出高灵敏度和低检测限的特性,对H2O2检测十分迅速,响应时间3.46 s。
图6b为Fe/PI/GCE的校正曲线。该传感器电极在H2O2浓度为10~3 000μmol/L的范围内呈线性关系,线性方程为I(µA)=-0.290 07C(mmol/L)-0.049 85,其中相关系数R2=0.991 0,最低检测下限(LOD)(S/N=3)为0.645µmol/L。该传感器具有检测范围宽、灵敏度高等优点。
图6c为Fe/PI/CGE传感器电极对相同浓度的H2O2连续性检测数据,每隔50 s滴加H2O2,浓度为1 mmol/L。Fe/PI/CGE电极对H2O2的连续性检测表现良好,在滴加了20次H2O2后,其电流响应依旧稳定,说明该电极具有连续检测性能,稳定性较好。
依据图6c数据,得到Fe/PI/GCE电极对H2O2浓度检测的线性电流响应曲线,如图6d所示。线性方程为I(µA)=-0.142 52C(mmol/L)-0.987 33,线性相关系数R2=0.987 33。表明Fe/PI/CGE对H2O2有着较好的操作稳定性。

图6 Fe/PI/GCE对H2O2的电化学性能曲线Fig.6 Electrochemical curves of Fe/PI/GCE electrodes
本文制备的Fe/PI/GCE传感器电极与其他H2O2传感器的性能比较如表1所示。Fe/PI/GCE的检测限较低,线性范围较宽。此外,Fe/PI/GCE电化学传感器还具有响应迅速、性能稳定、使用寿命长等优点。并且聚酰亚胺原料价格低廉,制备方法简单,耐高温及低温,能够适用于恶劣环境,适合作为电化学传感器的基体材料。

表1 Fe/PI/GCE传感器与其他H2O2传感器参数比较Tab.1 Comparison of parameters of Fe/PI/GCE and other H2O2 sensors
3.7 Fe/PI/GCE的使用寿命
为了考察Fe/PI/GCE电极的使用寿命,用制得的Fe/PI/GCE传感器检测浓度为1.0 mmol/L的H2O2溶液。5天后再次检测相同浓度的H2O2溶液,检测后的电极室温放置。1个月后,该电极保留了原始检测能力的85%。说明该传感器电极具有很好的储存稳定性。
4 结论
本文采用物理方法,制备了四种金属离子掺杂聚酰亚胺基过氧化氢电化学传感器,分别为Co/PI/GCE、Cr/PI/GCE、Ni/PI/GCE和Fe/PI/GCE,四种传感器均能够实现对H2O2快速检测。对H2O2传感器的制备条件进行优化,包括金属离子种类、金属离子浓度、电解质溶液pH值以及外加电压条件,确定了最佳的制备条件。Fe3+掺杂的聚酰亚胺基电化学传感器对H2O2的检测效果最佳,最佳制备电解质溶液pH为8.0、外加电位为0.7 V、铁离子浓度为25 mg/mL。该传感器有着优异的响应性能,对H2O2检测的线性范围为10~3 000μmol/L,线性方程I(µA)=-0.142 52C(mmol/L)-0.987 3,检测限(S/N)=0.645µmol/L,响应时间3.46 s,并具有良好的稳定性和使用寿命。

