肿瘤氧化还原微环境智能响应型前药纳米组装体的研究进展
陈瑶,张洪源,刘雨婷,孙丙军,孙进,何仲贵,罗聪
(沈阳药科大学无涯创新学院,辽宁 沈阳 110016)
癌症仍是严重威胁全球人类健康的重大疾病。癌症的临床治疗策略主要包括:手术、化疗、放疗和免疫治疗等[1]。目前癌症的临床治疗现状呈现出以传统治疗方案为主、多种治疗方案并存以及免疫疗法等新型治疗策略蓬勃发展的局面。值得注意的是,因肿瘤细胞的基因多态性和不稳定性,任何针对单一靶点的治疗策略最终都会产生耐药,例如上皮细胞生长因子受体(epidermal growth factor receptor,EGFR)靶向治疗[2]和程序性死亡受体1/程序性死亡受体配体1(programmed cell death 1/programmed cell death ligand 1,PD-1/PD-L1)阻断免疫治疗等[3]。因此,目前非单一靶点癌症疗法仍在临床中扮演重要角色。那么,如何实现这些非特异性抗肿瘤药物的“高效低毒”递送是药剂学领域的研究热点。
借助中早期癌症患者肿瘤血管的增强渗透和滞留效应(enhanced permeability and retention,EPR)来设计和构建新型纳米药物递送系统能显著提高药物的递送效率,且已经有多个抗肿瘤药物的纳米制剂被批准用于临床癌症的治疗,如Abraxane®(紫杉醇白蛋白纳米粒)和Doxil®(多柔比星脂质体)等。尽管纳米药物已经取得一定的研究进展,但它们的临床疗效远未达到人们的预期。究其原因,主要是物理包埋的非共价载药方式导致传统纳米制剂存在载药效率低下、载药稳定性不佳和体内药物递送效率不高等问题[4]。根本原因是多数抗肿瘤药物与载体材料的相容性较差。前药纳米组装体将共价连接化学和纳米递药技术整合到同一纳米平台,已成为纳米药物递送系统的一个重要研究领域。该纳米平台具有载药量高、稳定性好、血液循环时间长、安全性高、肿瘤靶部位智能响应前药激活等诸多优势[5-6]。
聚合物大分子前药策略是将药物通过特定的化学键共价键合于聚合物,巧妙地将药物与聚合物载体“融”为一体,从根本上解决药物与聚合物相容性差的问题。同时,通过在聚合物前药中引入肿瘤微环境(tumor microenvironment,TME)刺激响应型化学桥连还能实现药物在肿瘤组织的选择性快速释放[5]。除大分子聚合物前药以外,有些小分子前药也能自组装形成稳定的纳米体系,它们不仅具有聚合物前药纳米组装体的优点,还因药物在整个前药分子中占主导,极大地提高载药量,甚至高达50%[6]。前药分子的设计关键在于药物如何在靶部位选择性按需释放。近年来,基于肿瘤特异性生理病理微环境实现前药在作用靶点的特异性激活已被广泛研究。本文总结肿瘤氧化还原微环境智能响应型前药纳米组装体的研究进展,主要介绍肿瘤氧化还原微环境、常用的氧化还原敏感化学桥连、肿瘤氧化还原微环境智能响应型聚合物大分子前药纳米组装体和小分子前药纳米组装体。
1 肿瘤氧化还原微环境
TME不仅包括肿瘤细胞所处组织的结构、功能和代谢微环境,还包括肿瘤细胞自身的内在微环境[7-8]。肿瘤微环境的改变与肿瘤细胞内外的间质液体压力、氧含量、pH值、各种酶、氧化还原物质等密切相关[7]。同时,复杂而特殊的TME又与肿瘤的发生、发展和转移息息相关[8]。因此,研究人员构建一系列TME敏感释药的纳米药物递送系统用于肿瘤的高效诊疗,如氧化还原敏感、pH敏感、酶敏感和氧分压敏感型纳米载体等。其中,研究人员利用肿瘤细胞和正常细胞之间存在的氧化还原梯度,设计和构建多种氧化还原敏感的纳米载体,为实现抗肿瘤药物的高效低毒靶向递送提供可能。
1.1 肿瘤氧化微环境的形成和特点
肿瘤细胞中常见的活性氧(reactive oxygen species,ROS)主要包括羟基自由基(·OH)、单线态氧(1O2)和过氧化氢(H2O2)等。据相关文献报道,相比于正常细胞,肿瘤细胞会发生异常代谢行为,从而产生更高浓度的ROS[9],具体过程是肿瘤的形成源自基因损伤,导致肿瘤细胞中线粒体功能代谢紊乱,阻碍线粒体呼吸链中电子的传递,生成过量的ROS[10]。此外,不同浓度的ROS对肿瘤的发生和发展具有不同的影响。一方面,适量的ROS能够激活生长因子通路、丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)通路、磷脂酰肌醇3-激酶/蛋白激酶B(phosphatidylinositide 3-kinases/protein kinase B,PI3K/AKT)通路、核因子κB(nuclear factor kappa-B,NF-κB)相关通路等,进一步促进肿瘤的发生、发展和转移[11];另一方面,当肿瘤组织中ROS过量时,则会触发氧化还原应激机制,从而破坏DNA、氧化脂质,最终导致细胞凋亡和坏死。同时,ROS浓度的增加还会激活乏氧因子( hypoxia inducible factor-1α,HIF-1α) ,活化的HIF-1α诱导肿瘤细胞发生增殖、转移和侵袭,进一步加重肿瘤的恶化程度[12]。根据ROS过量的程度和暴露时间不同,氧化应激可以双向激活细胞增殖和凋亡机制[13]。基于ROS在癌症发展中的双重作用,抗氧化和促氧化策略在抗肿瘤药物的研发中备受关注。
1.2 肿瘤还原微环境的形成和特点
肿瘤细胞为了降低ROS对于自身的损伤,便相应产生大量以谷胱甘肽(glutathione,GSH)为主的还原性物质。肿瘤细胞内胞质溶胶、线粒体和细胞核等多种细胞器均含有高浓度的GSH。肿瘤细胞内的GSH的浓度(2 ~ 10 mmol · L-1)约是细胞外GSH浓度(2 ~ 20 μmol · L-1)的1000倍,且比正常细胞内GSH浓度高数倍。这种高浓度的GSH常常导致肿瘤细胞的抗氧化应激能力增强,并伴随耐药性也大大增加[14]。有研究发现,在耐药的肿瘤细胞中,其GSH的浓度要比普通肿瘤细胞的浓度高10倍以上[14]。除GSH以外,在肿瘤细胞内还存在其他的还原物质,主要包括以下几种:1)少量以还原态存在的二价铁离子(Fe2+); 2)硫氧蛋白还原酶;3)γ-干扰素的溶酶体巯基还原酶(GILT); 4)非GSH类还原剂如半胱氨酸。这些还原性物质均使得肿瘤部位呈现较低的氧化还原电位[15-16]。
1.3 基于肿瘤氧化还原微环境特点的药物递释策略
基于肿瘤细胞特殊的氧化还原微环境,研究者们已经设计出多种氧化还原响应型递药体系[17]。当药物随着载体一起到达肿瘤部位,高氧化还原的微环境会触发药物的快速释放,增加药物在肿瘤细胞的快速蓄积,还能实现药物的定时、定量释放,从而提高肿瘤杀伤效果,并降低对正常组织的副作用。这些氧化还原刺激响应型的载体往往表现出长循环、高响应以及定点释药等诸多优势[18]。因此,合理调控肿瘤氧化还原平衡态对于肿瘤的发生和发展具有重要影响。此外,基于肿瘤氧化还原微环境合理设计递药体系,为肿瘤的精准治疗提供更多选择。
2 氧化还原敏感的化学桥连
随着对肿瘤氧化还原微环境的不断深入了解,研究人员巧妙地设计多种氧化还原响应型药物递送系统,以实现肿瘤的高效诊疗。构建氧化还原敏感的药物递送系统,其关键在于设计和利用氧化还原敏感的化学桥连。近年来,已经相继开发多种氧化还原敏感型化学桥连,并将其用于药物递送系统的设计和构建。常用的氧化还原敏感型连接臂主要包括:单硫键[19]、二硫键[16]、三硫键[20]、琥珀酰亚胺-硫醚键[21]、硫缩酮键[22]、单硒键[23]和二硒键[24]等(见图1)。
图1 针对肿瘤细胞内氧化还原微环境的常用氧化还原敏感型化学桥连Figure 1 Common redox sensitive chemical bridging for the redox microenvironment in tumor cells
2.1 基于“硫键”的氧化还原敏感型化学桥连
单硫键、二硫键和三硫键等含硫化学键作为最常用的氧化还原敏感键,已经广泛应用在聚合物胶束[25]、纳米粒[18]、纳米凝胶[26]等给药系统中。笔者课题组在这方面做了一些研究工作:首先,发现单硫键的氧化还原双敏感性,且其氧化敏感响应能力非常强[18];其次,尽管二硫键作为传统意义上的还原单敏感化学键被最早开发和广泛应用,但是在研究中发现二硫键[19]同样具有非常好的氧化还原双敏感性。在肿瘤细胞内,二硫键能被肿瘤细胞高表达的GSH还原为硫醇,并且在ROS的作用下被氧化为强亲水性的亚砜或砜,进而增加体系的亲水性,促进药物释放;此外,还发现接近90°的二硫键键角可以显著提高前药分子的空间灵活性,有利于小分子前药纳米粒的稳定自组装。笔者课题组近期的研究发现,与二硫键相比,三硫键因具有3个硫原子和2个含硫的二面角,使得其在二聚体前药自组装中比二硫键更具优势[20]。此外,间隔二硫键[27]和硫缩酮键[22]作为氧化还原响应的连接键也被广泛研究。
2.2 基于“硒键”的氧化还原敏感型化学桥连
与含硫化学键相比,含硒化学键对氧化还原环境的敏感特性也被广泛研究。硒(Se)相比于硫(S)具有更高的氧化敏感性。因为与硫原子相比,硒的原子半径更大、电负性更弱,从而导致硒键具有较弱的键能(二硒键与二硫键的键能分别为172与240 kJ · mol-1)[23]。其中,单硒键具有很强的氧化敏感性,可以被氧化为亲水性的硒亚砜或硒砜[24]。二硒键则具有氧化还原双敏感性。在氧化条件下,二硒键被氧化为硒亚砜或硒砜,随后水解为亚硒酸或硒酸。而在还原条件下,二硒键会生成亲水性的硒醇[27],更容易在TME中发生断裂。此外,含硒的纳米载体具有更强的抗肿瘤效果,主要原因是硒化合物可以增强免疫反应、干扰肿瘤细胞的代谢、抑制血管生成并诱导肿瘤细胞的凋亡。
基于此,笔者课题组得出“硫键”和“硒键”氧化还原响应性的不同顺序。其中,氧化反应性上,遵循单硒键>单硫键>二硒键>二硫键的顺序;还原敏感性上,S比Se更容易被还原,遵循二硫键>二硒键>单硫键>单硒键的顺序。4种桥连的氧化还原响应机制如图2所示。随着研究的不断深入,氧化还原敏感型化学桥连的种类也愈加多样化,能够实现纳米载体在肿瘤部位特异性释药,具有抗肿瘤效果好、副作用低的明显优势,为肿瘤细胞内响应性释放给药系统的设计和构建奠定坚实基础。
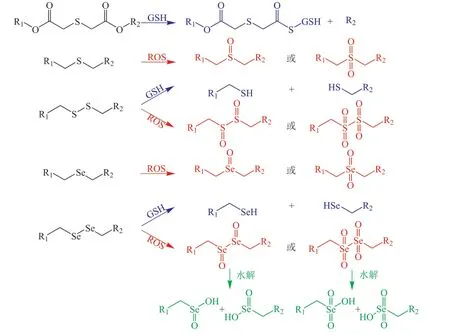
图2 单硫键、二硫键、单硒键和二硒键的氧化还原响应机制Figure 2 Redox response mechanism of single sulfur bond, disulfide bond, single selenium bond and disselenium bond
3 氧化还原敏感的聚合物前药纳米组装体
聚合物前药通过特定的化学连接臂将药物分子共价结合于聚合物分子上,多数药物可以作为两亲性聚合物疏水端的一部分,最终自组装形成聚合物前药组装体。新型的聚合物前药纳米组装体采用敏感型化学键可实现在肿瘤部位的可控释放。在这一部分,笔者重点介绍氧化还原敏感的聚合物前药纳米组装体,根据组装体的纳米载体的不同,主要分为:1)聚合物前药自组装胶束;2)聚合物前药自组装凝胶;3)聚合物前药自组装共递送纳米载体。
3.1 聚合物前药自组装胶束
胶束由两亲性聚合物载体材料构成,具有疏水内核和亲水外壳。聚合物前药自组装胶束则是将药物共价键合于聚合物的疏水端,自组装形成胶束[28]。聚合物前药自组装胶束种类繁多,因其具有良好的稳定性和生物相容性等优势在抗肿瘤药物递送领域备受关注。然而,大多数脂肪族聚酯类聚合物胶束由于释药缓慢,治疗效果并不理想。因此,根据肿瘤特有的高氧化还原的生理微环境,设计氧化还原响应型聚合物胶束并实现药物在肿瘤细胞内靶向快速释放,已成为研究的热点。
氧化还原响应型聚合物前药自组装胶束通常具有以下优势: 1)改善疏水性药物的溶解性; 2)增加载药稳定性和载药量; 3)延长药物的血液循环时间; 4)通过EPR效应增加药物在肿瘤部位的蓄积,提高药物的肿瘤靶向递送效率; 5)敏感键在肿瘤部位的特异性响应断裂,降低药物对正常组织的副作用[29-32]。Jia等[33]以支链聚乙烯亚胺(branched chain polyethylenimine,BPEI)为 骨架,二硫键为氧化还原敏感的化学桥连,透明质酸(hyaluronic acid,HA)为靶头,构建一种肿瘤细胞靶向的、GSH刺激响应的顺铂(Pt)纳米给药系统。以BPEI-SS-Pt为载体,通过静电吸附将HA包被在BPEI-SS-Pt上,构建氧化还原敏感的Pt靶向纳米给药系统[HA-(BPEI-SS-Pt)],该系统能够实现Pt在肿瘤细胞内的选择性释放,通过被动靶向与主动靶向结合,增加Pt在肿瘤部位蓄积,并能克服Pt的副作用。
为了进一步提高聚合物前药自组装胶束体系的主动靶向效果,可以在其表面进行多肽配体靶向修饰。然而,肿瘤异质性一定程度上限制单一刺激响应型释药效率。因此,构建双重甚至多重刺激响应释药的纳米载体能够进一步有效提高药物递送效率。如Li等[34]制备可以主动靶向肿瘤的还原/pH双响应的鬼臼毒素前药纳米胶束。胶束由2种前药聚合物构成,一种是在聚乙二醇(polyethylene glycol,PEG)上用二硫键桥连鬼臼毒素和转铁蛋白受体靶向肽Pep,另一种是PEG上仅用二硫键桥连鬼臼毒素,将2种聚合物混合后制备胶束,赋予该体系更高的肿瘤靶向能力。
负载化疗药物的氧化还原响应型聚合物前药自组装胶束体系,可以显著提高药物的抗肿瘤疗效、增强疏水性药物特异性、延长药物在血液中的循环时间、并降低药物副作用。总之,氧化还原响应型聚合物前药自组装胶束是具有前景的抗肿瘤药物载体。现已有大量研究能够证明其肿瘤靶向递药的高效性。对于氧化还原响应型聚合物前药自组装胶束大规模地广泛应用仍需进一步的探索,特别是在其代谢过程、药物传递机制以及给药体系的合理构建等方面。
3.2 聚合物前药自组装凝胶
除胶束以外,凝胶作为一种新型纳米载体,也广泛应用于聚合物前药组装体中。凝胶是由交联的聚合物网络组成的三维矩阵,使亲水性聚合物链能够固定住大量的水分子。凝胶在很多方面与人体组织十分类似,因而表现出良好的生物相容性。目前,纳米凝胶因其具有高载药量、高稳定性和对环境因素的响应能力,在智能纳米给药系统中的应用非常广泛。其中,氧化还原响应型聚合物前药自组装凝胶递送系统在肿瘤治疗领域已被广泛研究,其响应性释药通常可以通过聚合物硫醇化作用实现,即基于可逆的硫醇-二硫化物的转化实现药物的可控释放[35-39]。
目前,大部分早期研究只是将小分子药物通过物理包埋的方法包封在纳米凝胶中[35],导致药物易被提前释放,从而降低治疗效果并产生副作用。因此,基于化学共价键合实现药物按需释放的纳米凝胶备受关注。例如,Qu等[37]利用二硫键将甲基丙烯酸(methacrylic acid,MAA)、喜树碱(camptothecin,CPT)和N,N-亚甲基双丙烯酰胺(N,N-methylene bisacrylamide,Bis)桥连在一起,构建一个氧化还原/pH双敏感的前药纳米凝胶,有效改善CPT水溶性差的问题。此外,二硫键的化学键合作用不仅使体系结构更加稳定,同时借助二硫键的氧化还原响应性和PMAA的pH响应性,前药纳米凝胶中CPT的释放具有氧化还原/pH双重依赖性,有利于实现药物在肿瘤细胞和肿瘤组织微环境中的按需释放。
聚合物前药自组装凝胶递药系统,仍需要进一步的改进和完善,比如提高聚合物前药自组装凝胶的载药量。Peng等[26]利用共价连接将阿霉素(doxorubicin,DOX)桥连到含有二硫键N-乙烯基吡咯烷酮-co-N-乙烯基甲酰胺共聚物中,构建一种在高还原环境中粒径减小的纳米凝胶。通过控制交联密度进而实现载药量的调控。结果表明,随着交联密度的增加,DOX的载药量也随之增加,且载药量均高于50%,最大为57.9%。值得注意的是,DOX的释药速度将随着交联密度的增加而降低。因此,该体系在载药量和释药速率方面需要进行平衡,以达到更佳的药物递送效果。此外,为防止纳米凝胶的聚集,还可以通过在纳米凝胶结构中交联亲水性聚合物(如PEG)进行改善。同时,还可以在纳米凝胶表面上的官能团修饰靶向基团提高药物的体内靶向递送。
聚合物前药自组装纳米凝胶递送系统因具有良好的生物相容性和可控的释药性,具有非常好的应用前景。在此基础上,在载药量和特异性释药等方面不断取得突破,为进一步提高药物递送效率打下良好的基础。
3.3 聚合物前药自组装共递送纳米载体
聚合物前药不仅可以作为前药分子在肿瘤组织特异性激活中发挥相应疗效,还可以作为纳米载体实现多种药物的共递送。目前,已经上市多种不同作用机制的化疗药物,但这些作用通路并非毫无关联,可能存在相互促进的协同机制。因此,将2种药物包载于同一种纳米载体中不仅能实现药物的高效共递送,还能显著增强协同治疗效果。而聚合物前药分子中疏水端键合的药物分子与其他药物之间存在的π-π堆积等分子间作用力是实现多种药物的高效共载的基础。
在临床治疗中,肿瘤耐药性一直是亟待解决的关键问题。目前常用的2种解决策略是联合递送多种化疗药物或联合应用不同治疗方式。利用肿瘤与炎症高度相关性,Chai等[40]构建聚合物前药自组装共递送纳米载体,通过共递送非甾体抗炎药布洛芬和DOX,显著提高高转移性乳腺癌的治疗效果。肿瘤组织高表达的环氧合酶-2(cyclooxygenase-2,COX-2)赋予肿瘤组织更强的侵袭性和转移性,布洛芬通过抑制COX-2介导的肿瘤转移与DOX协同增强抗肿瘤效果。此外,也有研究基于聚合物前药自组装共递送纳米载体实现2种化疗药物的共递送。Sun等[41]以二硫桥连的达沙替尼聚合物前药纳米胶束为基础,通过包封DOX实现二者的共递送。也有研究将吲哚胺2,3-双加氧酶(indoleamine 2,3-dioxygenase,IDO)抑制剂NLG919通过二硫键共价连接到聚合物上,并包载DOX进行共递送和肿瘤免疫治疗[31]。
此外,将聚合物前药自组装共递送纳米载体用于肿瘤诊疗一体化也一直是研究的热点。例如,Yang等[42]报道一种以壳聚糖为载体的还原响应聚集诱导发光(aggregation-induced emission,AIE)生物荧光探针。壳聚糖分子具有很多羟基,在空间距离较远的一对羟基中,一端连接具有AIE结构的分子四苯乙烯(tetraphenyl ethylene,TPE),另一端则连接具有二硫键的羧酸。在肿瘤细胞内的高GSH浓度条件下,二硫键断裂,羧基脱离,聚合物纳米粒的空间结构发生改变,进而产生AIE效应,可用于肿瘤的荧光成像和诊断,通过光动力疗法还可以治疗肿瘤。在这个系统中,可以将二硫键另一端的羧基再进一步连接其他药物,同时,由于TPE分子具有多个共轭的苯环,理论上能通过物理包埋的方式实现多种药物的共递送。
虽然基于聚合物前药的氧化还原敏感共递药纳米组装体具有稳定性好、靶向性强和肿瘤抑制效率高等优点,但不可忽视的是共递送药物系统中小分子药物依旧是以物理包埋的方式进行负载,始终存在药物提前泄露的风险。此外,并不是所有药物都能够实现共递送,这可能取决于前药和小分子药物的结构。如何对自组装过程中的驱动力形成完整认知并利用这个规律实现药物的共递送是需要面临的首要挑战。随着计算机与药学的紧密结合,利用计算机手段进行分子动力学计算是目前分析分子自组装构象和驱动力的重要手段[20],尽管其准确性很大程度上受到分析环境等条件影响,但仍可以提供一定的参考。
4 氧化还原敏感的小分子前药纳米组装体
不可否认,聚合物前药纳米组装体确实能够增加药物的载药量和稳定性,并延长药物的血液循环时间,从而提高肿瘤递药效率。然而,这类纳米组装体在临床转化过程中仍然存在一些问题,首先是安全性问题,经过修饰的聚合物前药载体可能会发生生物安全性变化;其次是成药性问题,聚合物自身的纯度问题将直接影响聚合物前药纳米组装体的成药性,以及在临床中如何精确控制给药剂量等。相对于大分子聚合物前药,小分子前药组装体受到业界广泛的关注,为前药纳米给药系统注入新鲜血液。
小分子前药与聚合物前药的根本性区别在于将小分子药物偶联到另一个小分子结构而非聚合物结构上。小分子前药因非“药”成分所占比例更低,且化学结构固定明确,使得载药量更高、成药性更强、易于精准判断临床用药剂量。此外,目前应用于临床的大部分小分子抗肿瘤药物存在清除快、靶向性差、毒性大等缺点。将小分子药物修饰成前药并基于分子间作用力自组装成纳米递药系统则能够显著克服这些缺陷。在这里,将重点介绍氧化还原敏感的小分子前药纳米组装体,根据前药分子的亲水-亲脂性,主要分为两亲性小分子单体前药组装体、疏水性小分子单体前药组装体和二聚体小分子前药组装体3个部分。
4.1 两亲性小分子单体前药纳米组装体
两亲性小分子前药通常由1个疏水性和1个亲水性小分子结构组成。这样的组合既可以是疏水性药物结合亲水性侧链[43-45],也可以是亲水性药物结合疏水性侧链[46]。通过调控前药的分子结构使其亲水-疏水作用力达到平衡,才能在水介质中实现稳定的自组装。在临床常用化疗药物中疏水性药物所占比例较大,如紫杉烷类药物和喜树碱类药物等。因此,在疏水性药物上键合1个亲水侧链是目前比较常用的策略,这增强了其自组装过程中的稳定性。此外,还能够通过侧链的选择,实现对纳米粒功能化修饰。比如常用的亲水侧链包括氨基酸或多肽、氨基酸或多肽的衍生物和乳糖等。乳糖和一些多肽除了发挥亲水性功能之外,还能促使纳米组装体肿瘤靶向递送。例如,Lu等[43]将CPT和乳糖通过二硫键相连,合成并制备还原敏感的两亲性小分子前药纳米粒,显著增加药物的肿瘤蓄积并且降低CPT对正常组织器官的副作用。此外,Wang等[44]通过二硫键将神经腺苷受体-1(NRP-1)靶向肽RGDK与7-乙基-10-羟基喜树碱(SN 38)相连,构建了一个还原敏感的小分子前药纳米胶束(SN 38-Pep),不仅可提高载药量,还具有良好的肿瘤靶向性。
值得注意的是,前药化学结构的细微差别会直接影响其自组装稳定性,从而影响其释放速率和体内长循环效果。SN 38具有2个羟基,分别对其修饰得到SN38(10)-CRGDK和SN38(20)-CRGDK 2种小分子前药纳米胶束。其中,由于酚羟基(10位羟基)相比醇羟基(20位羟基)具有更强的亲水性,且能与血清蛋白发生相互作用,SN38(10)-CRGDK更有利于药物的自组装,也有利于体内的长循环。大部分的两亲性小分子前药在水溶液中自组装会形成胶束,然而胶束的稳定性受到临界胶束浓度(critical micelle concentration,CMC)的影响。静脉给药后,血液稀释可能导致胶束解体。相对于胶束结构,在前药结构中引入多肽的二级结构能够形成具有特殊形状且更加稳定的纳米组装体。例如,Lin等[45]将紫杉醇通过二硫键修饰到短肽Tau上,Tau的β-片状结构使前药自组装形成纳米纤维,比纳米胶束结构具有更好的稳定性。
4.2 疏水性小分子单体前药纳米组装体
相对于两亲性小分子单体前药,对疏水性小分子单体前药的研究更加广泛。这是由于疏水性小分子单体前药自组装纳米粒一定程度上克服大多数两亲性小分子前药自组装胶束广泛存在的体内长循环稳定性问题。然而,如何使其在水溶液中自组装形成稳定的纳米组装体是当前面临的主要挑战。在早期的研究中,一般认为疏水性单分子前药因过强的疏水性,在水介质中更趋向于形成沉淀。随着研究的深入,一些不饱和脂肪酸等具有特定结构的小分子或二硫键等特殊化学键的引入会促使疏水性小分子前药在水介质中自组装形成稳定的纳米粒。显然,由于前药的空间构象和化学键的键角在自组装过程中的独特作用,使得疏水性前药的空间结构能够在水性介质中进行灵活调整,有效阻碍分子聚集沉淀,助力自组装过程。近年来,已发现疏水作用力、π-π堆积作用力、氢键、离子键等多种作用力均能促进疏水性前药自组装形成纳米粒。
在氧化还原敏感的疏水性小分子单体前药纳米组装体中,常用的氧化还原敏感化学桥连有单硫键、二硫键和二硒键。其中,笔者课题组首次报道单硫键的氧化还原双敏感特性[18],并将其应用于构建氧化还原双敏感的紫杉醇-油酸前药自组装纳米粒。笔者课题组在解析自组装机制,发现不饱和脂肪酸中的双键以及分子间π-π堆积作用力在前药自组装过程中扮演着重要角色。与单硫键相比,二硫键在前药自组装方面更具有优势,这是由于其键角更接近于90°,赋予前药分子最大化的空间灵活性。此外,尽管二硫键一直以来被认为是还原单敏感的化学键,笔者课题组首次报道二硫键的氧化还原双敏感性,并发现二硫键距离相邻酯键的距离会显著影响前药的氧化还原响应能力[19]。除单硫键和二硫键外,二硒键也被广泛用于构建氧化还原敏感的纳米药物递送系统。笔者课题组就含硫、硒及碳化学键对前药自组装及前药自组装纳米粒递送效率的影响进行了探讨和研究[47]。其中,共构建包括单硫键、二硫键、单硒键、二硒键、碳键和碳碳键6组不同化学键桥连的紫杉醇-香茅醇前药,发现二硒键桥连的紫杉醇-香茅醇前药比其他前药具有更好的自组装能力、更稳定的纳米结构和更高的体内药物递送效率。这是由于二硒键具有比其他化学键更加接近90°的键角和二面角。
4.3 二聚体小分子前药纳米组装体
与小分子单体前药不同,二聚体小分子前药是直接将2个抗肿瘤药物分子通过一定的化学键进行共价键合。其没有引入额外的“非药”侧链,因而具有更高的载药量,并且可以通过合理设计前药结构发挥多种功能。根据前药的分子结构可将其分为同型二聚体前药和异型二聚体前药。同型二聚体小分子前药是指将同一药物的2个分子通过适合的化学键进行键合;异型二聚体小分子前药是指将2个不同药物分子通过适合的化学键进行键合。其中,单硫键、二硫键和二硒键都被广泛用于合成氧化还原敏感的二聚体小分子前药。除这些常见的氧化还原敏感化学键以外,笔者课题组最近报道了还原敏感的三硫键[20]。与单硫键和二硫键相比,三硫键在DOX二聚体前药自组装纳米递药系统中更具有优势。首先,在自组装稳定性方面,三硫键含硫键角更多且更接近90°,形成的2个二面角也更接近90°,其更加有利于二聚体前药自组装;其次,在还原敏感释药方面,三硫键中含有0价态的硫原子,是一个非常容易被进攻的位点,具有更好的还原敏感性;此外,在体内抗肿瘤效果方面,三硫键桥连的DOX二聚体前药自组装纳米粒具有更高肿瘤抑制率,且安全性良好。同时,单硒键和单碲键也是重要的桥连键。如Xia 等[48]分别合成单硫键、单硒键和单碲键桥连的紫杉醇二聚体前药。与单硫键相比,单硒键具有更高的氧化敏感性,单碲键则在ROS和GSH协同刺激时才能更好地发挥抗肿瘤作用。
如上所述,同型二聚体前药的自组装能力较差,研究人员通过在体系中引入其他药物,能够显著改善自组装稳定性,同时还能实现联合给药。例如,笔者课题组设计合成二硫键桥连的紫杉醇二聚体前药,与光敏剂DiR共组装后能够实现化疗与光热治疗协同抗肿瘤效果[49]。同样地,Pei等[50]基于人血清白蛋白(human serum albumin,HSA)、单硫键桥连的紫杉醇二聚体(PTX2-S)和光敏剂IR780碘化物,构建以PTX2-S和IR780为疏水内核,以HSA为亲水外壳的氧化、还原和光三重敏感的纳米体系,实现化疗与光热的协同抗肿瘤效果。此外,Gao等[51]利用二硒键的免疫特性,构建放疗-免疫-化疗三元协同的二聚体小分子前药共递药自组装纳米粒。其中γ射线的照射不仅能直接杀伤肿瘤细胞,还可以触发二硒键的断裂和氢键的破坏,释放培美曲塞。同时,断裂的二硒键能形成亚硒酸,增强自然杀伤细胞(natural killer,NK)介导的免疫治疗作用。最终该体系发挥放疗-免疫-化疗三元协同抗肿瘤效果。
除同型二聚体小分子前药以外,异型二聚体小分子前药的优势在于可以实现2个不同药物的高度同步递送,如紫杉烷类药物-DOX异二聚体小分子前药纳米组装体。目前,多种氧化还原敏感的化学桥连被应用于构建异型二聚体小分子前药纳米组装体。例如,笔者课题组制备单硫键桥链的紫杉醇-DOX前药自组装纳米粒[51]。在该体系中,紫杉醇的载药量达46.5%,DOX的载药量达30%。此外,Ma等[52]报道的二硫键桥连的紫杉醇-DOX二聚体前药纳米组装体,并将微流控技术应用于纳米粒的制备,能够通过调节二聚体前药在溶剂中的浓度和流速灵活调控纳米粒的粒径。此外,异型二聚体除了在自组装方面具有更大优势外,还可以利用药物的协同作用增强抗肿瘤效果。如笔者课题组[28]利用光触发释放的ROS与肿瘤细胞微环境中的ROS协同促进单硫键的断裂,设计单硫键桥连的光敏剂PPa和紫杉醇前药。如上所述,单硫键具有非常好的氧化敏感性,光敏剂在光照下产生的ROS不仅能直接破坏肿瘤细胞,还可以促使单硫键氧化加快释药速度。该设计既可提高药物在靶部位的快速释放和蓄积,还可以通过控制光照部位进一步确保用药安全性。除协同作用外,异型二聚体还能够赋予纳米粒更多功能,如Sun等[53]构建的二硫键桥连的药物和染料dyr前药结构,不仅实现了光热和化疗协同治疗肿瘤,且dyr染料的自发射荧光能够准确提供前药在体内的激活和生物分布等实时信息。
5 结语
纳米药物递送系统的快速发展极大地丰富了药物递送方式和策略,促进了化学、纳米科学、材料学和药剂学等多学科交叉融合。其中,前药纳米组装体将共价连接化学和纳米递药技术进行了有机结合,逐渐形成一类独具特色的纳米药物递送系统。其中,药物通过共价键合的方式被包载于纳米结构,甚至药物本身成为纳米载体的核心部分,药物与载体材料不再是独立的个体,而是相互交融。这种独特的递送系统赋予体系更高的载药效率和稳定性,还延长了药物的血液循环时间,且通过特定刺激条件响应化学桥连的引入,能够实现在肿瘤细胞内高氧化还原的微环境中选择性智能释药,提高治疗选择性,降低副作用。然而,前药纳米组装体自身也存在一定的局限性。首先,不是所有药物都适合被开发成为前药,药物必须有可被化学修饰的基团(如羟基、羧基和氨基等);其次,前药结构设计和氧化还原敏感化学桥连的选择极具挑战,必须平衡好在靶前保持稳定和在靶部位快速激活这一关键问题,且不同的药物之间因性质差异大,使得很难有通用的策略和明确的规律可循。
从整个纳米药物开发的角度讲,尽管生物纳米技术和药物载体材料的蓬勃发展极大促进了纳米药物递送系统的进步,但纳米药物的临床转化前景仍不容乐观,甚至备受质疑。究其原因,可以归结为以下几个方面: 1)生产工艺受限导致放大制备和工业化生产难度较大; 2)多数聚合物载体材料的结构非常新颖,但药理和毒理学资料匮乏,距离开发成为真正的药用辅料任重而道远;3)大部分纳米载体的载药量较低,且大量载体材料在体内蓄积易引发相关副作用; 4)物理包载药物(非共价方式)使得药物易在存储过程中从纳米载体中结晶或泄露出来,从而可能导致疗效不佳和毒性风险增加; 5)多数纳米载体的释药驱动力是纳米结构内外的药物浓度梯度,缺乏疾病特异性和选择性; 6)纳米药物临床试验对象多数为晚期癌症患者,但临床晚期实体瘤患者的EPR效应几乎消失,这已成为纳米药物临床转化的最大障碍。因此,纳米药物的临床转化之路仍充满挑战,完全从纳米载体设计的角度很难取得实质性进展,可能要从聚合物药用辅料开发和毒理学研究、可工业化生产纳米制剂制备技术开发、纳米药物治疗控制技术开发以及纳米药物临床试验患者适用性研究等多个方面进行同步研究和推进,才能真正意义上快速推进纳米药物的临床转化,特别是优效型纳米制剂的研发和临床转化。

