盐湖提锂的萃取分离研究现状与展望
赵汝真,魏琦峰,任秀莲
(哈尔滨工业大学(威海) 海洋科学与技术学院,山东 威海 264200)
锂的物理和化学性质优异,在航空[1]、电源[2]、润滑剂[3]、玻璃及陶瓷[4]领域都发挥着重要作用,特别在电池领域的需求量日渐增多。我国具有丰富的盐湖锂储量,但特点是镁锂比较高[5],因其间相似的性质而使得从卤水中提锂的难度上升。
针对从盐湖中提锂的方法,主要有沉淀法[6]、煅烧浸取法[7]、吸附法[8]、膜分离法[9]和溶剂萃取法[10]。其中溶剂萃取法因其提锂容量大、镁锂高效分离、可操作性强等特点而受到广泛关注。目前主要使用的萃取体系包括有机磷[11]、冠醚[12]、β-双酮[13]和离子液体[14]。本文将主要介绍此4种萃取体系的特点及研究进展,分析应用溶剂萃取法进行盐湖提锂的发展趋势,并对未来发展方向进行展望。
1 溶剂萃取法提锂研究进展
1.1 中性有机磷萃取剂的研究进展
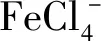
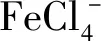

图1 萃取法卤水提锂常规流程[19]Fig.1 Conventional process for extracting lithium from brine

目前TBP-FeCl3-煤油萃取体系最适应高镁锂比盐湖卤水的提锂现状,在对盐湖进行中试放大实验中,Li+产率达95%以上[22],但运转一段时间后,TBP出现水中溶损过大、反萃时在酸性条件下易分解等现象,特别对萃取设备有较强的腐蚀性,工业化应用受到限制。
1.2 离子液体体系的研究进展
离子液体作为一种新型的绿色溶剂,具有宽液体温度范围、低蒸汽压、高热化学稳定性、良好的导电性和宽电化学窗口、良好的溶解性、可设计性和较强的催化活性等特点。离子液体通常由有机阳离子和无机或有机阴离子组成,在阴离子结构相同的情况下,阳离子疏水性大小顺序为季胺>哌啶>吡咯>咪唑>吡啶时,其萃取率大小顺序为吡啶>咪唑>吡咯>哌啶>季胺,疏水性与萃取率呈反比关系,这是由于离子液体中的阳离子与水相中的锂离子交换,阳离子疏水性越强,越难引入水中与锂发生交换,由此季胺对锂的萃取率最低[23]。Shi[24-25]应用[Cnmim][PF6]-TBP-C2H4Cl2(n= 4,6,8)体系对盐湖进行提锂操作,相对于传统的萃取方法,离子液体对镁锂有较好的分离效果,同时在反萃阶段,用1 mol/L的HCl对负载有机相进行洗涤,其Li+的两级反萃率可达99%以上,相对于传统有机磷萃取剂中萃取酸浓度的4~6 mol/L,离子液体在反萃阶段避免了设备的严重腐蚀,且此萃取体系为自发的放热反应,低温对萃取有利[26]。离子液体作为一种新型的绿色溶剂,为有机相提供了离子环境,其在萃取体系中起到了协萃作用。


图2 FILs结构示意图Fig.2 Structure diagram of FILs
离子液体能较好的解决传统萃取体系中存在的有机溶剂挥发污染、设备腐蚀严重、易出现乳化等问题,同时它大大提高了体系对Li+的萃取率,对于高镁锂比盐湖提锂来说是一种绿色的方法。
1.3 冠醚类萃取体系的研究进展
冠醚是由[—CH2—CH2—O—]单元重复构成的环状物,因形状与王冠相似而被称为“冠醚”。冠醚环内电荷分布具有不均匀性,醚环内部具有多个氧原子而呈电负性,分子外层则呈现正电性,离子偶极矩间的作用表现为冠醚与金属离子的相互作用,离子固定在大环空穴内,或通过环外夹心的方式形成稳定的络合物[28]。冠醚类化合物能与碱/碱土金属离子形成化合物,因此被很多科学家用来萃取分离金属离子,但该过程会受许多条件的制约,如冠醚分子大小、冠醚分子取代基、锂盐的阴离子、反应温度和溶剂等。冠醚的种类不同,其孔腔直径就不同,因此冠醚对络合的金属离子就有了选择的能力,当冠醚的孔腔直径与金属离子直径相匹配时,二者之间的络合能力最大[29]。不同碱金属离子直径以及几种常见的冠醚孔腔直径的比较见表1。方胜强等[30]研究发现,供电子取代基能够促进冠醚与金属离子的络合,吸电子取代基会阻碍络合,冠醚本身易溶于水,在环上引入亲脂性侧链以提高其疏水性,从而增强对Li+的萃取能力。Nishizawa[31]研究了锂盐阴离子对冠醚络合Li+的影响,当阴离子的电荷密度越小,其与锂离子的静电作用力越低,使得冠醚与锂离子的作用力变强,从而分离系数逐渐变大。
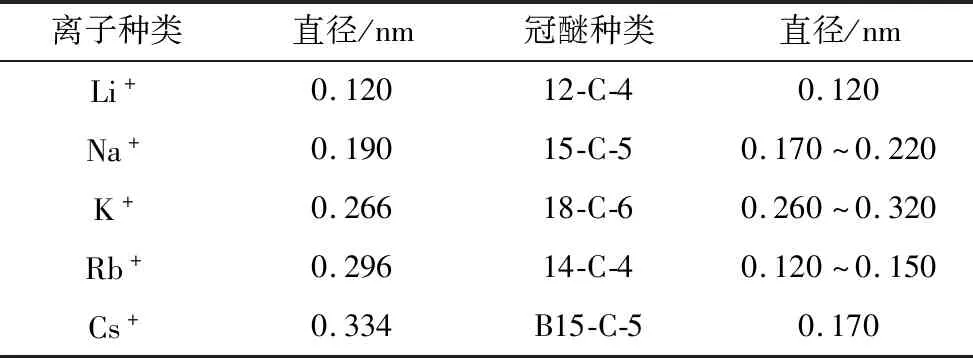
表1 不同碱金属离子直径以及几种常见冠醚的孔腔直径的比较Table 1 Comparison of different alkali metal ion diameters and pore diameters of several common crown ethers
目前,冠醚类物质对锂具有较高的萃取率,但合成过程复杂、成本高,目前研究仅限于实验室阶段,未见有工业化报道。
1.4 β-双酮类萃取体系的研究进展
在萃锂体系中,被应用过的醇类、酮类包括丙酮、甲基异丁基甲酮、环己酮、丙醇、戊醇、异丙醇、2-乙基己醇及异戊醇等,其中一些已经应用于工业。自20世纪60年代以后,主要研究的是β-双酮类,包括有苯酰丙酮、噻吩甲酰三氟丙酮(TTA)、苯酰三氟丙酮等,其中萃取率最好的是氟代类,但在使用此类萃取剂时,通常要与协萃剂共同萃取离子。β-双酮类萃取体系的提锂机理如下:Li+的半径小,螯合结构可通过Li+的sp3杂化轨道与β-双酮的烯醇式异构体形成,然后再与协萃剂形成相应的萃合物[22],具体总结见图3。
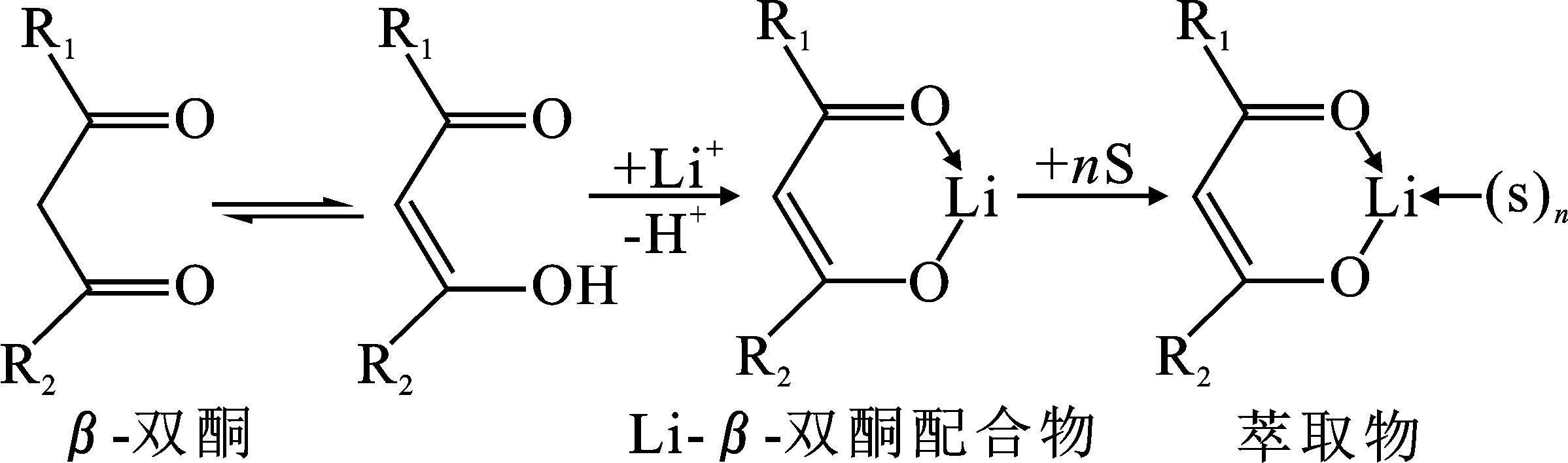
图3 β-双酮类萃取体系提锂机理(S,协萃剂)[32]Fig.3 Lithium extraction mechanism of β-diketone extraction system(S,coextractant)
Healy[13,33]首次研究了协同萃取碱金属(M+),以噻吩甲酰三氟丙酮(TTA)为萃取剂,并选取了不同的中性协萃剂如TBP和三正辛基氧化膦(TOPO),因TOPO具有较强的供电子效应,其协萃效果最好,不同碱金属与萃取剂的螯合形式为M(TTA)(TOPO)2。Kim等[34]以TTA为萃取剂、TOPO为协萃剂实现了微量锂的萃取(5.76×10-4mol/L),萃合物的主要成分为Li(TTA)(TOPO)2,在不同稀释剂条件下以间二甲苯的萃取效果最佳,其次依次为苯、甲基异丁基酮,正己烷和氯仿的效果不佳。除了中性协萃剂,Ishimori[35]考察了以1,10-邻菲咯啉(PHEN)为协萃剂的萃取体系,比较TTA-TOPO和TTA-PHEN的萃取效果,其中TTA-PHEN对Li+和Na+间的分离效果明显较好。Umetani等[36-37]发现4-酰基化-5-吡唑酮及其衍生物-TOPO体系对Li+有较好的选择性,可实现Li+与其他碱金属离子的分离,萃取物的形式为LiA(TOPO)2。
尽管双酮类萃取剂对锂有较高的萃取选择性,但其成本较高,且在碱性条件下溶损较为严重,循环再生困难,目前仅在实验室阶段。
2 结论
我国盐湖具有高镁锂比的特点,锂的分离较为困难,应用溶剂萃取法可有针对性地将Li+从溶液中萃取出来,本文分别介绍了有机磷萃取体系、离子液体体系、冠醚体系与β-双酮类萃取体系的萃取机理及效果。其中以中性有机磷TBP萃取体系最为深入,但TBP对萃取设备有较强的溶胀性和腐蚀性,工业化应用受到限制。新型的绿色溶剂离子液体,相对于有机磷体系具有低腐蚀性、高萃取率的特点,但在高镁锂比的条件下还需要继续探究Mg2+对萃取剂的萃取效率和选择性影响的问题。冠醚类和双酮类萃取剂对锂有较高萃取率,但合成工艺复杂、成本高,目前研究仅限于实验室阶段,未见有工业化报道。目前实现高镁锂比盐湖提锂技术的工业化应用还面临着一系列困难,且盐湖区域的生态环境薄弱,今后应针对Li+、Mg2+的特性,利用各萃取剂之间的协萃关系,研发具有高选择性和高萃取率的离子液体萃取体系;设计和改良应用于中试和工业生产的萃取、反萃取设备,提高其耐腐蚀性能;尽最大可能降低萃取体系及工艺对生态环境造成的危害,保护盐湖地区的生态环境,实现盐湖资源的可持续发展。

