尼洛替尼与伊马替尼治疗初诊慢性髓性白血病慢性期的疗效对比
何玉卓 郭学军 林晓燕 朱鸿斌
慢性髓性白血病(chronic myelogenous leukemia,CML)在全球范围内发病率约为万分之一,且近年来发病率逐年升高[1]。CML有慢性期(chronic phase,CP)、加速期(accelerate phase,AP)和急变期(blastic crisis phase,BC)三个阶段,疾病基础是t(9;22)(q34;q11)染色体易位形成BCR-ABL融合基因[2]。BCR-ABL能转录出一种新的mRNA,可编码融合蛋白p210BCL/ABL,p210BCL/ABL为致癌蛋白,能提高酪氨酸激酶活性,促使一系列信号蛋白发生持续性磷酸化,最终导致细胞异常增殖分化,细胞凋亡水平降低,进而导致CML发生。BCL/ABL在正常细胞中不表达,所以它是治疗CML的理想药物靶点[3-4]。目前临床上用于治疗CML的一线药物有尼洛替尼、伊马替尼和达沙替尼等,其中伊马替尼是第一代BCR/ABL酪氨酸激酶抑制剂,尼洛替尼是第二代BCR/ABL酪氨酸激酶抑制剂(tyrosinekinase,TKI),现有研究表明尼洛替尼治疗CML具有较好的效果[5]。本研究选用尼洛替尼与伊马替尼治疗初诊CML慢性期并对比两者疗效,为临床用药提供参考。
1 资料与方法
1.1 一般资料
选取2012年1月至2019年12月在我院就诊的初诊CML慢性期患者60例,按给药方式分为对照组和观察组,各30例。纳入标准[6]:病理学诊断显示为CML慢性期;患者肝功能、肾功能及心功能均正常;世界卫生组织行为状态评分≤3分;年龄18岁以上;BCR/ABL转录表达检测为阳性。排除标准[7]:诊断不明确;有严重其他系统疾病;处于非慢性期;年龄18岁以下。对照组男性17例,女性13例;年龄28~50岁,平均(40.14±4.68)岁;体重40~70 kg,平均体重(56.32±6.74)kg;高血压5例,冠心病1例。观察组男性18例,女性12例,年龄27~49岁,平均(39.43±5.98)岁;体重42~71 kg,平均体重(57.04±7.59)kg;高血压4例,冠心病1例。2组资料有可比性。
1.2 方法
对照组患者采用伊马替尼(Novartis Pharma Schweiz AG,进口药品注册证号H20150112,100 mg×60粒)治疗,给药剂量为400 mg/次,每天1次,连续治疗12个月;观察组患者在采用尼洛替尼治疗(Novartis Pharma Schweiz AG,进口药品注册证号H20140333,200 mg×120粒),给药剂量为300 mg/次,1日1次,连续给药治疗12个月。
1.3 观察指标
1.3.1 血液学缓解标准[8]生化法检测患者治疗前后外周血中白细胞以及血小板水平。完全血液学缓解:临床无贫血、出血、感染及白血病细胞浸润表现;白细胞水平≥10×109/l,血小板水平≥100×109/l,检测不到异型细胞,骨髓象原始细胞加早幼阶段细胞(或幼稚细胞)≤5%。部分血液学缓解:临床、血象及骨髓象3项中有1项未达到完全缓解标准,骨髓象中原始细胞加早幼细胞<20%,检测不到异型细胞,外周血存在幼稚髓细胞。未缓解:未达到以上标准。总有效=完全血液学缓解+部分血液学缓解。
1.3.2 细胞遗传学反应标准[9]G显带法检测治疗前后2组患者骨髓标本。完全细胞遗传学缓解:Ph检测结果为阴性。部分细胞遗传学缓解:Ph阳性占比为1%~34%。微小细胞遗传学缓解:Ph阳性占比为35%~90%;未缓解:未达到以上标准。总有效=完全细胞遗传学缓解+部分细胞遗传学反应+微小细胞遗传学缓解。
1.3.3 分子生物学缓解标准[10]实时荧光定量PCR(Quantitative Real-time PCR,RT-PCR)检测2组患者治疗前后外周血BCR/ABL转录水平。完全分子学缓解:RT-PCR水平检测BCR/ABL表达结果显示为阴性。主要分子学缓解:RT-PCR水平检测BCR/ABL表达结果显示BCR/ABL表达水平下降3个对数级别以上。无效:未达到以上标准。总有效=完全分子学缓解+主要分子学缓解。
1.3.4 不良反应[11]观察并记录患者用药治疗期间不良反应发生情况。
1.4 统计学方法
统计学软件SPSS17.0处理数据,计数资料以n表示,采用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 2组患者血液学疗效对比
给药治疗12个月后,对照组血液学缓解总有效率显著低于观察组(χ2=4.812,P=0.028),见表1。

表1 2组患者血液学疗效对比(例,%)
2.2 2组患者细胞遗传学疗效对比
给药治疗12个月后,对照组较观察组细胞遗传学缓解率显著较低(χ2=4.320,P=0.038),见表2。
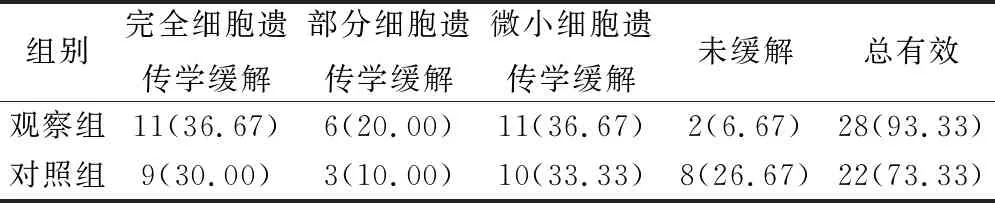
表2 2组患者细胞遗传学疗效对比(例,%)
2.3 2组患者分子生物学疗效对比
用药治疗12个月后,对照组分子生物学有效率显著低于观察组(χ2=4.800,P=0.028),见表3。

表3 2组患者分子生物学疗效对比(例,%)
2.4 2组患者不良反应比较
研究结果表明患者给药治疗期间,对照组与观察组比较,不良反应发生率较高(χ2=4.267,P=0.039),结果见表4。

表4 2组患者不良反应发生情况对比(例,%)
3 讨论
CML是临床上发病率较高的白血病类型,近年来发病率越来越高。CML是由于骨髓内造血干细胞异常克隆性增殖引起的,具有发病缓慢、早期症状不典型的特点[12]。CML临床上分为慢性期、加速期及急变期,其中慢性期一般持续1~4年,主要症状有乏力、低烧、多汗、体重减轻等[13]。CML慢性期若不采取有效的措施治疗,CML发展到加速期与急变期极易导致患者死亡,因此在CML慢性期对患者展开针对性的治疗可提高CML患者生存率[14]。
传统CML治疗以干扰素、细胞毒药物羟基脲以及异基因造血干细胞移植为主,但治疗效果不理想,患者预后3年的生存率仅50%左右,并可导致骨髓抑制、发热等副作用,且不能消除BCR/ABL融合基因,移植相关并发症发生率高、死亡风险大[15];20世纪90年代以来TKI的应用,明显提高了CML的治疗效果、改善了CML的预后[16-17]。伊马替尼是第一代TKI药物,是目前临床上用于治疗CML慢性期的常用药物,但近年来临床使用发现,伊马替尼不耐受、耐药等问题逐渐显现,治疗效果不理想[18-19]。
尼洛替尼是基于伊马替尼基本结构研发出的二代CML药物,尼洛替尼与ABL激酶结合的亲和力是伊马替尼30倍左右,能抑制多种细胞系中BCR/ABL自身磷酸化,并且对多种突变为伊马替尼耐药的基因位点依旧具有较高亲和力,活性较高,具有很强的BCR/ABL抑制能力[20]。体外研究表明尼洛替尼与BCR/ABL结构域结合的亲和力远高于伊马替尼[21]。现有外国学者研究表明,与其它治疗方式比较,尼洛替尼治疗早期CML疗效更好,医疗成本更低[22]。本次研究使用尼洛替尼和伊马替尼治疗CML慢性期12个月后比较2组患者治疗效果,研究结果表明,尼洛替尼治疗CML慢性期分子生物学缓解率、细胞遗传学缓解率、血液缓解率均高于对照组,这与王雅云等[23]研究结果基本一致。以上研究结果表明尼洛替尼对CML有较好的治疗效果,且其可以从基因以及蛋白层面缓解CML,这可能与尼洛替尼高度抑制了BCR/ABL基因活性有关。本次研究还发现,与伊马替尼相比,尼洛替尼治疗CML慢性期不良反应发生率显著降低。
综上所述,尼洛替尼代替伊马替尼治疗CML慢性期,可明显提高CML临床治疗分子生物学、细胞遗传学及血液缓解率,降低了CML临床治疗过程中的不良反应发生率,疗效显著。

