化生性胸腺瘤9例临床病理分析及文献复习
刘 静 李 扬
化生性胸腺瘤是原发于胸腺的上皮源性肿瘤,具有独特的临床病理特征,非常少见,目前国内外文献多是个案报道。本文报道9例化生性胸腺瘤,并结合文献复习,对其临床病理特征、免疫表型、鉴别诊断及预后进行总结性分析。
1 资料与方法
1.1 临床资料
收集南京医科大学第一附属医院病理学部2009年至2019年诊断的化生性胸腺瘤9例,均为临床资料完整的病例。所有患者的随访信息通过预留电话咨询获取,最后随访时间为2020年6月。
1.2 方法
包括常规HE染色和免疫组织化学染色。标本经10%中性福尔马林固定,石蜡包埋,常规切片,HE染色。免疫组织化学检测在罗氏Ventana全自动免疫组化染色仪上进行,以DAB显色、苏木精对比染色。一抗为CK 、CK5/6、CK19 、EMA、Vimentin、Ki67、CD20、CD3、CD5、CD117、TdT、CD34、STAT6、S-100、P63等,免疫组化试剂所用抗体均购自福州迈新生物技术开发有限公司,操作步骤按说明书进行。
1.3 结果判读
免疫组织化学:TdT、STAT6、S-100、P63、Ki-67标记物的阳性信号定位于细胞核,CK、CK5/6、CK19、EMA、Vimentin、CD20、CD3、CD5、CD117和CD34等定位于细胞膜/质。强度判读方法:1+,阳性细胞数百分比5%~25%;2+,阳性细胞数百分比26%~50%;3+,阳性细胞数百分比>50%。
2 结果
2.1 临床特征
9例患者中男性6例,女性3例,男女比例2∶1。患者年龄35~68岁,中位年龄50岁。肿瘤均位于前纵隔,包括前上纵隔和前中纵隔各1例,左前纵隔和右前纵隔各2例。7例患者均无明显症状,系检查中无意发现,另外2例有胸痛气急症状。术前均行影像学CT或MRI或彩超检查:显示前纵隔软组织肿块影,强化不明显或轻度强化,除1例与左心缘边界不清,其余均与周围组织境界清楚。术中发现肿块表面光滑,包膜完整,质硬,其中有3例与心包粘连,见表1。
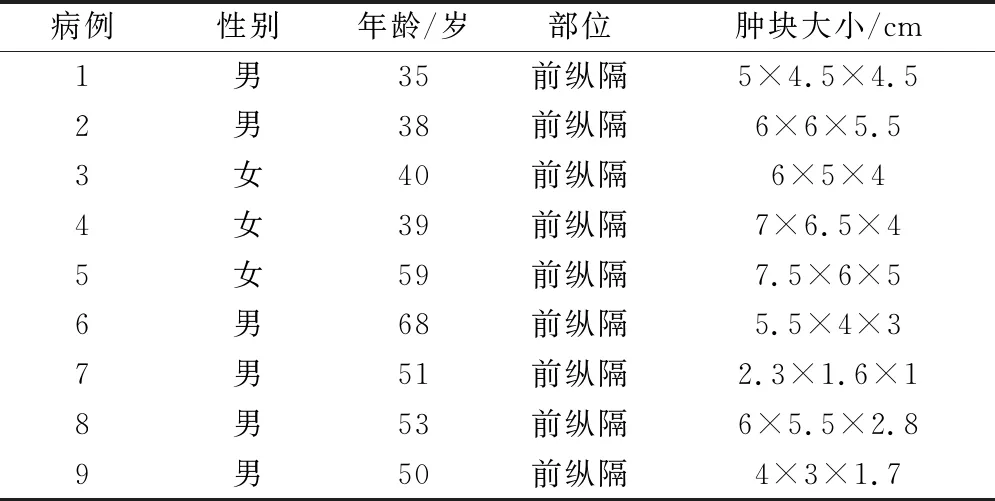
表1 9例化生性胸腺瘤临床特征
2.2 巨检
肿瘤最大径2.3~7.5 cm,平均5.3 cm。除1例送检为碎组织,仅见部分包膜外,其它病例肿块包膜完整,切面呈灰白灰黄色,质地中等偏韧,部分病例可见散在的小囊腔,1例明显囊性变,囊性区内含褐色液体。
2.3 镜检
组织学上肿瘤呈明显的双相分化特点,即上皮细胞区域与梭形细胞区域交错分布,并可见相互移行改变。上皮细胞呈相互吻合的束状、岛状、旋涡状及粗梁状排列,细胞呈多边形、卵圆形或圆形,胞质嗜酸性,细胞核圆形、卵圆形,有小核仁,部分病例可见核内空泡或核内假包涵体,偶见核分裂像,细胞轻至中度异型性。梭形细胞呈束状或席纹状排列,细胞温和,呈纺锤形,染色质均匀,似纤维母细胞,未见核分裂像。间质中可见小淋巴细胞散在分布,肿瘤周边可见残存的胸腺组织。其中有2例(例6和例8)可见核大深染、多形性的上皮细胞。
2.4 免疫组化结果
上皮细胞CK、CK5/6、CK19和P63呈强阳性表达,梭形细胞表达Vimentin,EMA局灶阳性,两种区域中Ki-67增殖指数均较低(<5%),其中例6和例8热点区Ki-67指数分别为8%、15%,核大深染、多形性细胞Ki-67呈阴性表达。CD5、CD117阴性表达,3例肿瘤间质中可见CD3、CD20阳性淋巴细胞,1例肿瘤内见散在少许TDT阳性的T淋巴细胞。肿瘤细胞CD34、STAT6、S-100呈阴性表达。
3 讨论
3.1 起源和命名
化生性胸腺瘤是非常少见的胸腺瘤亚型,起源于胸腺上皮细胞,以往曾被称为伴肉瘤样间质的胸腺瘤、双相性胸腺瘤、低级别化生性癌、多边形细胞和梭形细胞混合型胸腺瘤。对该肿瘤争议的焦点是梭形细胞是否为肿瘤性成分,一些学者认为梭形细胞为反应性增生的纤维母细胞和肌纤维母细胞[1],另有学者认为肿瘤内上皮成分与梭形细胞成分相互移行,梭形细胞为肿瘤性成分[2],可能是上皮成分发生了上皮间质转化。目前多数学者认为梭形细胞系肿瘤性成分。1999年WHO将其放入胸腺上皮性肿瘤,2004年正式将其命名为化生性胸腺瘤,ICD编码为8580/3。
3.2 临床特点
化生性胸腺瘤主要见于成人,笔者查阅近年来已发表的国内外文献,收集整理报道病例共计61例,其中男性25例,女性36例,女性多于男性,男女比例0.69∶1,年龄22~71岁,中位年龄51岁,平均年龄49岁。资料显示,肿瘤好发于前纵隔,少数发生于中纵隔,多数患者无特异性临床症状,多在体检时发现。少数患者因胸闷气短、活动后气急、胸背痛等就诊。多数患者不伴重症肌无力及其他副肿瘤综合征,仅个别病例报道伴有重症肌无力。文献报道伴有重症肌无力(myasthenia gravis,MG)的化生性胸腺瘤共3例,2例患者血清中检测到抗乙酰胆碱受体抗体升高,1例在上皮样细胞巢周边可见多量TDT阳性、CD3阳性T淋巴细胞,1例在肿瘤周边见少量TDT阳性细胞[3-5]。化生性胸腺瘤多发生于胸腺,胸腺外非常罕见,侯卫东等报道1例发生在甲状腺内的化生性胸腺瘤[6]。CT检查显示前纵隔圆形、椭圆形或不规则形实性肿块,密度均匀,与周围分界清楚,强化不明显或轻度强化。PET-CT示FDG代谢增高,SUV值升高,与胸腺癌类似[7]。
3.3 病理学特点
大体检查:化生性胸腺瘤大体上呈孤立性肿块,有完整包膜,文献报道的肿瘤最大径2.8 cm~25 cm,切面灰白灰黄色,质中或质韧,无分叶或分叶不明显,无明显坏死,可有囊性变和钙化。有报道1例源于胸腺囊肿的化生性胸腺瘤,病变呈囊性,在囊壁内见化生性胸腺瘤肿瘤成分[8]。光镜特点:肿瘤缺乏典型胸腺瘤的拼图样生长方式和血管周围间隙。肿瘤细胞呈独特的双相分化,上皮细胞呈束状、岛状、梁状或旋涡状排列,相互吻合,细胞呈多边形、卵圆形或短梭形,胞浆中等或丰富,嗜酸,细胞核卵圆形,染色质均匀,略深染,可见小核仁,细胞可见轻度到中度异型,部分病例中可出现核大、深染的多形性上皮细胞和核内假包涵体,但核分裂像罕见。梭形细胞呈短束状或席纹状排列,细胞温和,核呈胖梭形或长梭形、纺锤形,染色质均匀,核仁较小或不明显,胞质较丰富,核分裂像罕见。上皮细胞与梭形细胞多呈交错分布,两者之间有过渡或相互移行。间质中无或可见少量成熟小淋巴细胞散在分布。部分病例中可见钙化,少数病例见大量砂粒体。免疫组织化学特点:上皮细胞CK、CK5/6、E-cadherin弥漫阳性,CK19、EMA表达程度不一(阳性、弱阳性、局灶阳性或阴性),vimentin阴性。梭形细胞vimentin弥漫阳性,EMA局灶阳性,E-cadherin阴性。Ki-67增殖指数低(<5%),背景淋巴细胞CD3、CD5、CD20阳性,TDT阴性。少数病例可见少量TDT阳性淋巴细胞,仅Tajima报道的病例上皮细胞巢周围见多量TDT阳性淋巴细胞[5]。超微结构显示,上皮细胞间有桥粒和半桥粒,胞质内可有成束的张力丝和少量糖原颗粒,梭形细胞胞质内可见少量张力丝和扩张的内质网,但不见桥粒结构[9]。目前关于化生性胸腺瘤的分子研究还比较少,liu等发现其与EBV感染无关,染色体无异常,c-KIT、cerbB-2、P53、EGFR均未见突变[10]。Vivero M等研究发现,化生性胸腺瘤有YAP1-MAML2融合基因改变,不同于A型或AB型胸腺瘤,没有GTF2I基因突变[11]。
本组共9例患者,均无重症肌无力及其他副肿瘤综合征,除1例患者有强直性脊柱炎病史外其他均无特殊。肿瘤细胞均呈双相分化,上皮细胞与梭形细胞可见过渡或移行,与文献报道一致,均未见钙化,1例伴出血囊性变。值得注意的是例6和例8肿瘤中均出现核大深染的多形性上皮细胞,胞浆丰富嗜酸,核空泡状,可见核内假包涵体,但核分裂像并不容易找见,且均未见凝固性坏死,免疫组化显示ki67呈阴性表达,推测可能是伴有退行性改变的肿瘤细胞。这与Yoneda等[2]报道的病例类似,其报道的5例病例中有3例伴有类似改变,其用多形性(pleomorphism)来描述这些细胞。另一值得注意的是本组3例患者肿瘤间质中可见CD3、CD20阳性T、B淋巴细胞,1例内见散在的少许TDT阳性的T淋巴细胞,但该患者无重症肌无力症状。
3.4 诊断及鉴别诊断
该肿瘤形态特殊,比较少见,在常规外检中容易漏诊或误诊,需要与以下肿瘤鉴别:①AB型胸腺瘤:患者常常伴重症肌无力,肿瘤细胞呈明显分叶状生长,肿瘤背景中见多量TDT阳性淋巴细胞,聚集成巢状、片状,可与化生性胸腺瘤鉴别。 ②胸腺肉瘤样癌:肿瘤常常没有包膜,边界不清,常伴有出血和坏死,细胞异型性明显,染色质粗糙,核仁明显,核分裂像易见,坏死常见, Ki-67增殖指数多比较高。③双相分化的恶性间皮瘤:同时具有上皮样和肉瘤样双相特征的恶性间皮瘤,排列方式可能与化生性胸腺瘤相似,但该肿瘤细胞异型性明显,且免疫组化表达间皮标记如calretenin、HMBE-1等,可与化生性胸腺瘤鉴别。④孤立性纤维性肿瘤(Solitary fibrous tumor,SFT):肿瘤由交替分布的细胞丰富区与稀疏区组成,与化生性胸腺瘤上皮细胞区和梭形细胞区交互分布方式不同,并且前者常见鹿角形血管,SFT常常CD34、STAT6阳性,CK很少弥漫成片阳性,且分子检测可显示有NATB2-STAT6融合基因。⑤脑膜瘤:少数病例肿瘤内见多量砂粒体,且脑膜瘤细胞EMA、vimentin阳性,有可能会给诊断带来困扰,但脑膜瘤细胞常呈明显漩涡样、洋葱皮样排列,不表达 CK、CK19及P63,PR呈阳性反应,可资鉴别。
3.5 治疗及预后
目前化生性胸腺瘤的治疗首选手术切除,文献报道显示大部分患者术后预后良好。Yoneda等[2]报道了1例化生性胸腺瘤术后14个月局部复发,6年后患者死亡;另有2例源于化生性胸腺瘤的肉瘤样癌的报道[12-13]。目前关于化生性胸腺瘤中肉瘤样变诊断标准及影响化生性胸腺瘤预后的因素尚不明确。文献报道,发生肉瘤样癌的病例,肿瘤在一年内迅速增大,并伴有组织学上细胞丰富,明显异型,核分裂像增多,ki67增殖指数增高,以及局灶可见凝固性坏死等特点。Liu等[10]报道的病例中其中1例局灶可见肿瘤性坏死,然而肿瘤完整切除后随访患者无复发。Yoneda等报道的复发死亡病例,患者并未出现肉瘤变或癌变,细胞无明显异型,核分裂像少,ki67增殖指数低(3%),未见凝固性坏死,与其他病例不同的是该例患者肿瘤浸润周围组织,手术不确定肿瘤是否完全切除,临床Masaoka分期Ⅲ期。因此,我们推测化生性胸腺瘤的预后除了与病理形态有关,还可能与肿瘤是否浸润周围组织、Masaoka分期以及肿瘤是否能够彻底切除有关。本组9例患者随访至2020年6月,最长的1例随访时间为11年,最短的1例为12个月,均未见复发,预后良好,但病例6和病例8仍需要长期随访。总体来说,大多数化生性胸腺瘤是一种相对惰性的恶性肿瘤,其生物学行为尚有待于大宗病例报道及长期随访观察。

