葡萄糖胺-6-磷酸合成酶的异源表达及其酶学性质表征
王 涛, 冯君瑞, 李姝璇, 杜 响, 刘晓环, 吴绵斌
葡萄糖胺-6-磷酸合成酶的异源表达及其酶学性质表征
王 涛1, 冯君瑞1, 李姝璇1, 杜 响1, 刘晓环1, 吴绵斌2
(1. 济宁医学院 生物科学学院,山东 日照 276826;2. 浙江大学生物质化工教育部重点实验室, 浙江大学 化学工程与生物工程学院,浙江 杭州 310027)
葡萄糖胺-6-磷酸合成酶(GFA)是己糖胺生物合成中的一个关键酶,为建立一条高效的GFA生产工艺,其研究对象GFA来源于致病菌白色假丝酵母(ATCC 64548),通过基因克隆,然后在大肠杆菌中进行异源表达。结果显示,GFA的最佳异源表达条件为:诱导剂浓度为0.1 mmol×L-1,诱导温度为28 ℃,诱导时间为15 h,诱导时机为菌体浓度OD600达到1.0。其最佳的反应条件为:反应温度为37 ℃,反应pH为7.2,反应时间为20 min。通过双倒数作图法得到该酶的M值为0.47 mg×mL-1;当反应体系中加入抑制剂(bacilysin)时,GFA转氨酶活性会被显著抑制,酶活降低约54.8 %。结果表明,研究所采取的方法能够高效地异源表达葡萄糖胺-6-磷酸合成酶,提高其应用潜力,这对于加快新型抗真菌药物的研发具有重要意义。
葡萄糖胺-6-磷酸合成酶;异源表达;酶学性质;抗真菌靶点
1 前 言
葡萄糖胺-6-磷酸合成酶(GFA,EC 2.6.1.16)是氨基己糖代谢通路中第一个关键酶[1-2],也是含糖胺生物大分子(如:几丁质)代谢调控过程中一个关键的节点[3]。其能够利用-谷氨酰胺,不可逆地催化-果糖-6-磷酸转化成-葡萄糖胺-6-磷酸(GlcN6P)。GFA是酰胺转移酶超家族中一员,其结构由两个行使不同功能的结构域组成:转氨酶结构域和异构酶结构域[4-5]。通过抑制葡萄糖胺-6-磷酸合成酶的活性,能够导致相关糖蛋白及几丁质的生物合成受阻,致使致病菌无法合成细胞壁而死亡[6]。但在哺乳动物中,该酶被抑制短时间内不会对个体造成严重的伤害,其所造成的结果因组织不同而异。因此, GFA也被认为将成为抗细菌和抗真菌新药研发中极具前景的潜在靶点[7-8]。
研究表明:无论在胞内还是在胞外,GFA的存在形式(活性的二聚体与无活性的六聚体)都处于一种平衡状态[9]。同时研究发现,随着蛋白浓度的增加及产物(GlcN6P)浓度的提高,GFA更倾向于以六聚体形式存在,造成其比活力将随之降低[10]。这必将大大增加GFA的生产及应用方面的成本,严重影响其应用潜力。此外,来源不同的GFA往往在异源表达的过程中存在表达量少、提取困难等问题,因此迫切需要通过合适的手段,建立一条高效的生产工艺。本研究中,来源于真菌致病菌(白色念珠菌)中的GFA在大肠杆菌BL21(DE3) Codon plus中成功实现异源表达,并对其酶学性质进行了表征,大大提高了其生产效率。在此基础上,验证其作为抗真菌靶点的可行性,为其进一步在抗真菌新药研发中的应用提供基础。
2 实验部分
2.1 试剂与仪器
(1) 本实验使用的菌种主要有:实验室保藏的大肠杆菌BL21(DE3) Codon plus,大肠杆菌DH5α白色念珠菌(ATCC 64548)。
(2) 主要试剂有:1 mmol×L-1的GLUPA(-谷氨酰对硝基苯胺);pH 7.2的磷酸盐(PBS)缓冲液;LB(Luria-Bertani)培养基(pH 7.2,胰化蛋白胨10 g×L-1、酵母提取物5 g×L-1和NaCl 10 g×L-1);对硝基苯胺(天津大茂化学试剂厂);Bacilysin(实验室保存)。质粒提取试剂盒(Solarbio,D1100),琼脂糖凝胶回收试剂盒(Omega,D2500-01)。
2.2 实验过程
2.2.1 对硝基苯胺标准曲线的绘制
用pH为7.2的PBS缓冲液分别配制终浓度为10、20、30、40、50 mmol×L-1的对硝基苯胺溶液,溶解后,使用可见光分光光度计,以pH为7.2的PBS缓冲液为空白对照,测量吸光度A420,并绘制标准曲线。
2.2.2基因制备与表达载体的构建
从NCBI基因文库调取白色念珠菌细胞GFA的基因序列(,GenBank:NC-032091.1),设计上游引物5¢-CGCATGTGTGGTATTTTTGGTTACGTCAATT-3¢、下游引物5¢- CCGTTACTCAACAGTAACTGATTTAGCCAAGTT-3¢(下划线部分分别为I、I酶切位点)。以白色念珠菌基因组为模板进行 PCR 扩增。PCR克隆该基因过程中在该序列的上下游分别引入限制性内切酶I/I 的酶切位点,将 PCR 扩增产物用I/I双酶切后并克隆至载体 pET28(a)。经酶切和PCR 验证后,对所获得的阳性克隆进一步测序验证,将测序正确的阳性质粒命名为 pET28(a)-G。
PCR 反应条件:98 ℃ 预变性2 min,30 次扩增循环 (98 ℃、30 s;55 ℃、30 s;72 ℃、3 min),72 ℃ 延伸 10 min。
2.2.3 重组质粒pET28(a)-G的转化与GFA的诱导表达
将 pET28(a)-G重组质粒通过 CaCl2法转化大肠杆菌BL21(DE3)-Condon Plus感受态细胞,挑取单菌落接种到 5 mL LB 培养液中,37 ℃培养过夜,次日以2% 的接种量转至 10 mL LB 培养液中,在菌体浓度OD600达到 0.6 后,加入 IPTG(异丙基硫代半乳糖苷,终浓度为 0.5 mmol×L-1),16 ℃诱导过夜,取1 mL 菌液,12 000 r×min-1离心 2 min,收集菌体细胞,超声破碎,5 000 r×min-1离心 10 min,用聚丙烯酰胺凝胶电泳(SDS-PAGE)分别定性检测沉淀和上清中重组GFA的表达量,并分析重组蛋白的可溶性。
2.2.4 SDS-PAGE蛋白电泳
将发酵液于10 000~12 000 r×min-1离心5 min,取上清液进行SDS-PAGE电泳[11]。离心后所得沉淀用相同浓度的缓冲液溶解后,取样进行蛋白电泳。采用的聚丙烯酰胺浓度为12%,染色液为0.1% 的考马斯亮蓝 R-250,脱色液配方中甲醇:水:乙酸(体积比)为2:7:1。
2.2.5 GFA酶活力测定
将1 mL 酶液加入2 mL的反应体系中。反应体系如下(终浓度):
1 mmol×L-1底物(GLUPA),1 mmol×L-1EDTA(乙二胺四乙酸),1 mmol×L-1DTT(二硫苏糖醇),及0.5 mmol×L-1PMSF(苯甲基磺酰氟) 溶解于 20 mmol×L-1HEPES(4-羟乙基哌嗪乙磺酸) 缓冲液中,在pH为7.5,37 ℃下反应10 min。反应结束后,100 ℃煮沸5 min终止反应,冷却至室温,将反应体系置于420 nm下,利用分光光度计测量产物的吸光值度A420,以未加底物的反应体系为空白对照。
测定酶活时,将单位时间(10 min)催化产生1 μmol对硝基苯胺的酶量(mL)定义为一个酶活单位。
2.2.6 GFA异源表达条件的优化
1) 诱导时间的优化
诱导时间分别为10、12、14、16、18、20 h,诱导结束后取酶液分别测定不同诱导时间条件下的GFA活力,确定最佳诱导时间。酶活测定条件同2.2.5节。
2) GFA最佳诱导温度的确定
诱导温度分别设定为15、20、25、30、35 ℃,诱导结束后取酶液分别测定不同诱导时间条件下的GFA活力,确定最佳诱导时间。酶活测定条件同2.2.5节。
3) GFA最佳诱导剂IPTG浓度的确定
在GFA诱导过程中,分别在每个培养基中加入终浓度为0.06、0.125、0.25、0.50、1.0、2.0 mmol×L-1的IPTG,诱导结束后取酶液分别测定不同诱导时间条件下的GFA活力,确定最佳诱导时间。酶活测定条件同2.2.5节。
4) GFA最适反应 pH 值的确定
分别配制不同pH的PBS缓冲液:pH值为5.6、5.8、6.0、6.3、6.5、7.0、8.0,取酶液分别测定不同 pH 条件下的GFA活力。其他条件同2.2.5节。
5) GFA最适反应温度的确定
将反应温度设为30、35、40、45、50、55、60、65和70 ℃,测定试样在pH 7.0 时的GFA活力。
2.2.7 应用双倒数作图法确定葡萄糖胺-6-磷酸合成酶的max(最大反应速度)和M(米氏常数)
分别配制浓度为0.1、0.2、0.5、1.0、2.0 mmol×L-1的底物,取5支试管,每支试管分别放入不同浓度的底物和2 mL的酶液,37 ℃水浴反应30 min。以4 mL的水为空白对照。测量反应体系的吸光度(A420),计算出对硝基苯胺的浓度,然后以对硝基苯胺的生成速度倒数与底物浓度的倒数作图,求出M及max。
2.2.8 Bacilysin对GFA的抑制作用研究
取5支试管,每支试管中加入1 mL的酶液,1 mL底物,1 mL 30 mg×mL-1的抑制剂,使抑制剂的终浓度为10 mg×mL-1。37 ℃水浴加热,每隔20 min取一次样,以纯水为空白对照,测量A420,然后计算出酶活。
取5支试管,每个试管中加入2 mL的酶液和2 mL的底物,放在37 ℃水浴锅中加热,仍是每隔20 min取一次样,以纯水为空白对照,测量A420,然后计算出酶活。
3 结果与讨论
3.1 葡萄糖胺-6-磷酸合成酶表达优化的结果与分析
3.1.1 葡萄糖胺-6-磷酸合成酶的异源表达
图1中标记的条带即为过表达的葡萄糖胺-6-磷酸合成酶,相对分子质量约为80´103,与文献报道的结果吻合(约78.4´103)[12-13]。由上图可以明显发现,在大肠杆菌BL21(DE3)Codon plus中过表达的GFA,基本处于可溶状态,包涵体的成分较少,说明来源于致病菌细胞内的葡萄糖胺-6-磷酸合成酶,可以在该宿主中正常表达。同时,通过后续酶活的测定(见3.2节)表明,本研究中所得到的重组GFA蛋白基本为活性状态的可溶性蛋白。

图1 SDS-聚丙烯酰胺凝胶电泳结果
(M: Marker G-S: Supernatant of the bacteria lysate G-C: precipitation of the bacteria lysate C-S: supernatant of the bacteria lysate (control) C-C:precipitation of the bacteria lysate (control))
3.1.2 诱导时间与酶活的关系
如图2所示,加入IPTG对GFA的进行诱导表达后,酶活随诱导时间延长而升高,这是因为IPTG不会被大肠杆菌代谢,从而产生持久的诱导效果;当诱导时间为15 h时酶活达到最高,约为14.4 U×mL-1;继续增加诱导时间,会造成酶活降低。这主要是由于IPTG对宿主细胞具有一定的毒性(抑制)作用,会造成细胞的裂解[14]、宿主细胞内蛋白的降解[15],从而影响外源蛋白的表达。随着诱导时间的延长这种抑制作用越明显[16]。因此,考虑到GFA的催化活性与生产效率,其最佳的诱导时间确定为15 h。
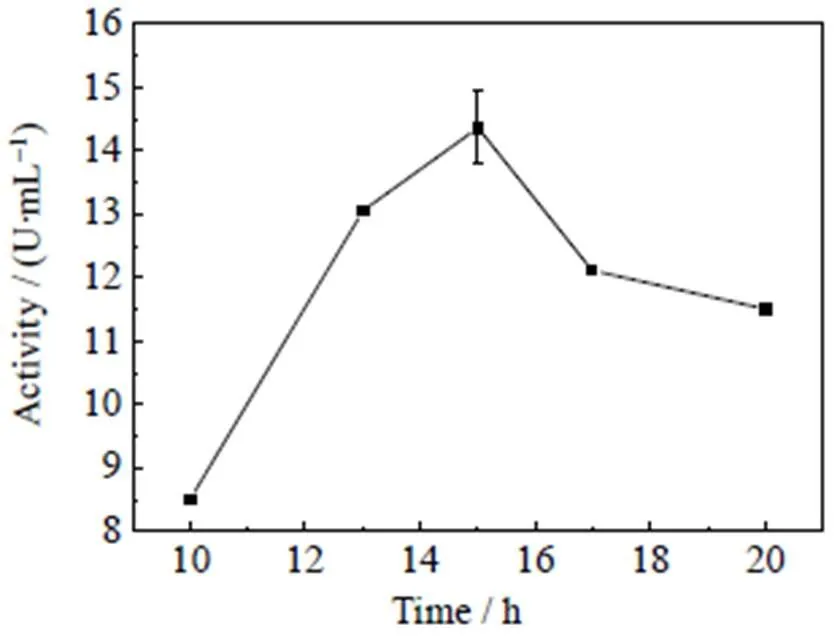
图2 诱导时间对酶活的影响
3.1.3 诱导剂浓度的优化
据报道,IPTG的摄取进入细胞需要利用细胞膜表面的质子泵,这会大大增加细胞生长的负担,对细胞造成“毒性”,从而抑制菌体的生长及外源蛋白的表达[17-18]。因此,IPTG 终浓度是影响外源蛋白表达的重要因素之一。由图3可知,随着诱导剂浓度增加,酶活显著提高。当诱导剂的终浓度为0.1 mmol×L-1时,酶活最高,达到19.5 U×mL-1;但继续增加诱导剂浓度,酶活又会表现出显著的降低。因此,综合各方面的考虑,在GFA的诱导表达过程中,诱导剂(IPTG)的浓度确定为0.1 mmol×L-1。
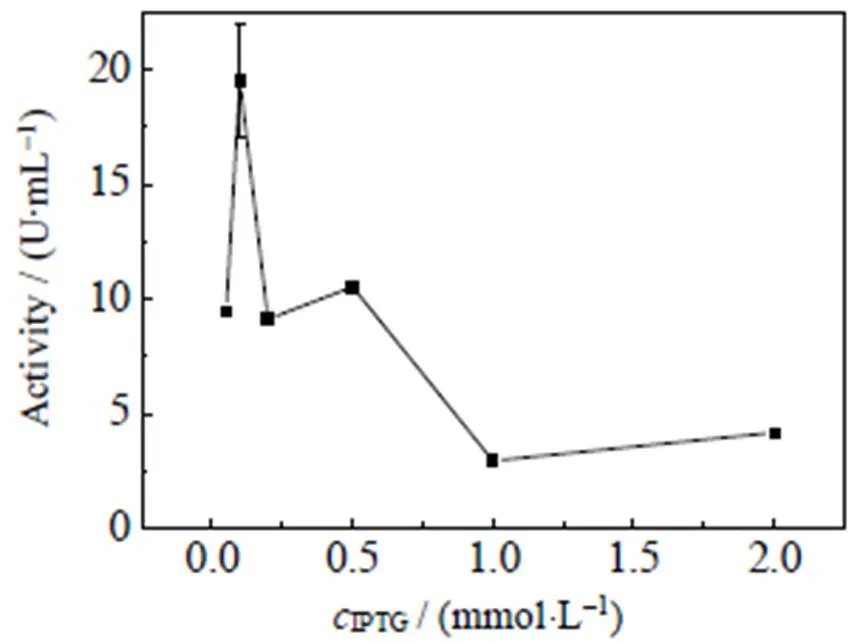
图3 诱导剂浓度对酶活的影响
3.1.4 诱导温度与酶活关系的结果分析
由图4可知,诱导温度对异源表达的GFA活性具有十分明显的影响。随着诱导温度的增加(15~30 ℃),酶活逐渐增加,当30 ℃进行诱导时,此时酶活达到最高约为18 U×mL-1。当诱导温度处于30~40 ℃时,酶活又逐渐降低。这是因为随着温度的升高,大肠杆菌繁殖速度加快,导致蛋白表达量急剧增加,从而增加其空间结构折叠错误的概率,形成无活性的包涵体,导致酶活降低[19]。虽然大肠杆菌的最适生长温度为37~38 ℃,但利用其作为宿主进行外源蛋白的异源表达时,考虑到重组GFA蛋白的可溶性及其生化活性的维持,因此在进行异源表达时采用相对较低的诱导温度,约为28 ℃。
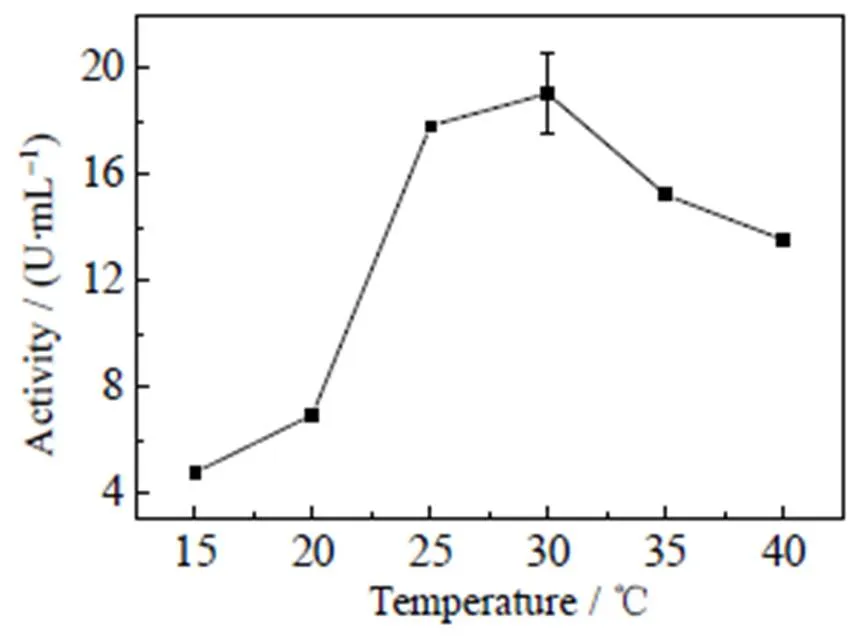
图4 诱导温度与酶活的关系
3.1.5 菌体浓度与酶活的关系
如图5所示,诱导时机的不同将显著影响外源蛋白的活力。随着菌体浓度的增加,其经过诱导所生产的酶,活力也随之增加。当OD600为1.0左右时,酶活最高,约34.1 U×mL-1;继续培养,当OD600超过1.0时,酶活会有所降低。这一方面可能是因为菌体浓度太高,瞬间表达的蛋白浓度较高,从而形成非正常折叠、无定型的包涵体,使酶活降低。另一方面,研究表明[20],当在宿主细胞内进行蛋白的异源表达时,不同的诱导时机对宿主所造成的负担不尽相同:指数期前期进行诱导,对宿主所造成的负担要远高于在指数期后期所造成的负担。这不仅会造成外源蛋白表达量的下降,同时也会造成宿主细胞中一些非必须蛋白的生物合成,从而影响宿主细胞的生长速率。Dykhuizen等[21]指出,造成这种结果的原因主要涉及蛋白的转录与翻译过程,与总蛋白浓度无关。因此,选择一个恰当的诱导时机(OD600为1.0左右),无论对于GFA的表达量还是宿主细胞的生长速率都有重要的意义。
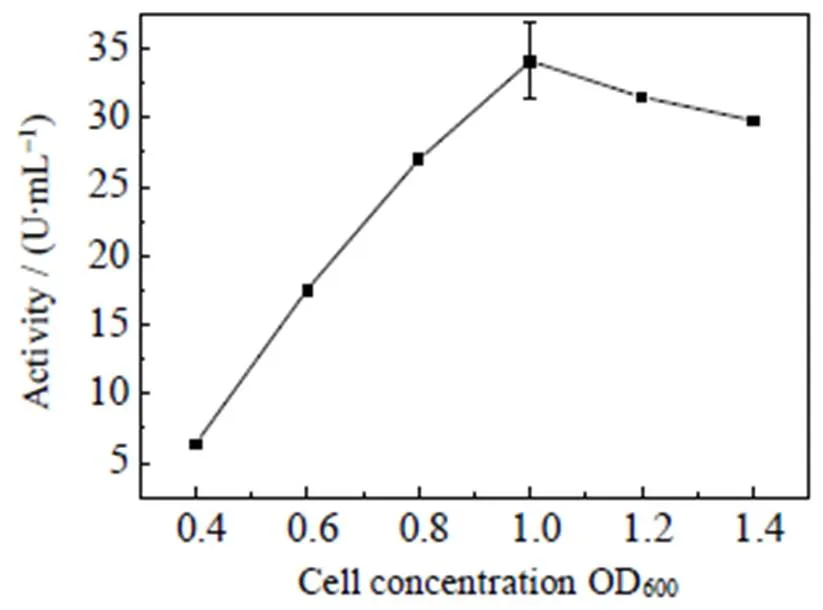
图5 菌体浓度对酶活的影响
3.2 葡萄糖胺-6-磷酸合成酶的酶学性质表征
3.2.1 反应pH与酶活的关系
由图6可知,在pH为7.2的时候,酶活最高,表明葡萄糖胺-6-磷酸合成酶的最适反应pH为中性,偏酸或偏碱都会影响其结构的稳定性,造成酶活降低。
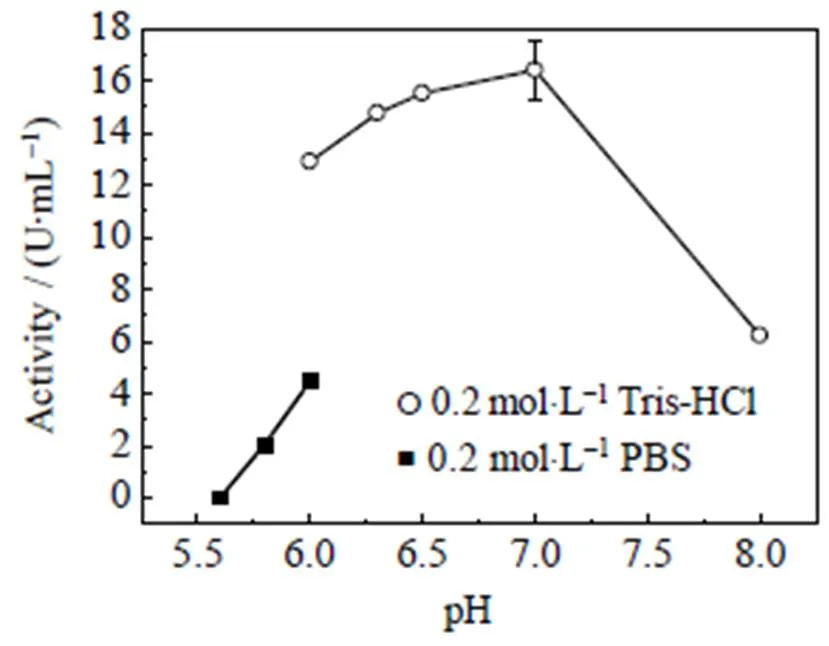
图6 反应体系pH与缓冲液种类对酶活的关系
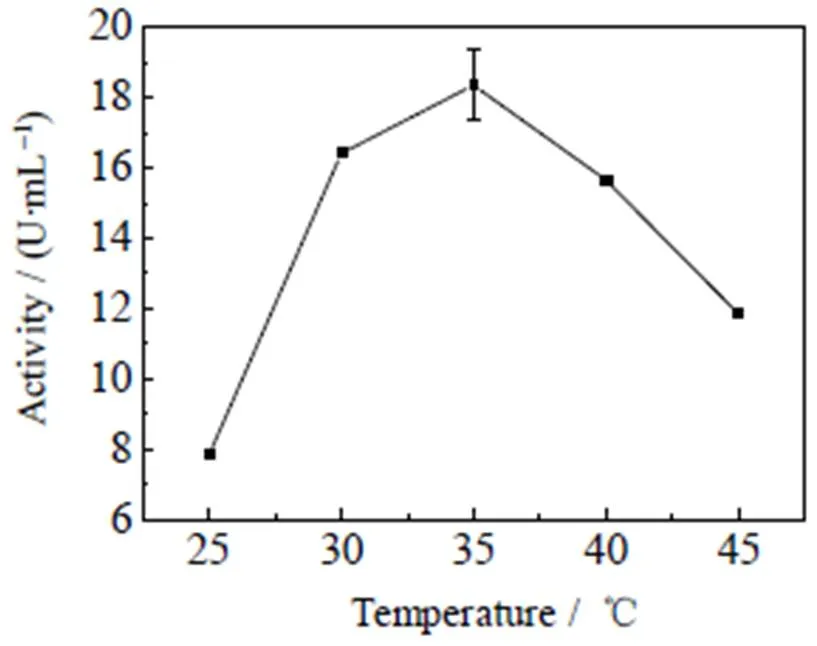
图7 反应温度与酶活的关系
3.2.2 反应温度优化与酶活的关系
由图7可知,葡萄糖胺-6-磷酸合成酶酶活最高点所对应的温度是37 ℃,在37 ℃之前,酶活随着温度升高而增加,这是因为在一定温度范围内,温度升高会使分子热运动加速,从而提高化学反应速率;但酶的本质是蛋白质,温度过高会破坏其空间结构。所以随着温度的持续升高,酶活会显著降低。
3.2.3 双倒数作图确定最大反应速度与反应速率
通过对硝基苯胺的生成速度倒数与底物浓度的倒数作图(Lineweaver-Burk双倒数作图),如图8所示,得到双倒数方程(double-reciprocal plot):=0187 9+0.040 32(2=0.992 59),图中,为反应速度,substrate为底物质量浓度,其中横轴截距为-1/M,纵轴截距为1/max。由双倒数字方程可获得最大反应速度max和反应速率M,当=0时,=1/max,即max=24.80 mg×(mL×min)-1;当=0时,=-1/M,M=0.47 mg×mL-1,即当反应速率达到1/2max时,substrate为0.47 mg×mL-1。
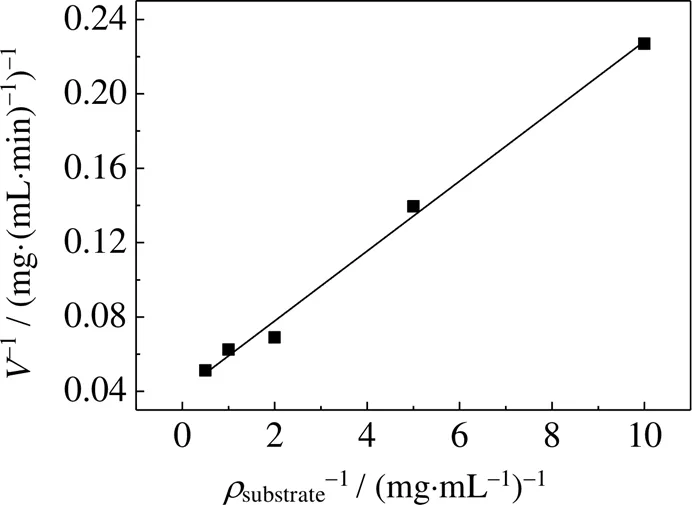
图8 双倒数作图分析GFA酶学性质
3.2.4 葡萄糖胺-6-磷酸合成酶作为抗真菌靶点的应用
前期研究发现,bacilysin是一种新型的、高效的抗真菌化合物[22]。由于bacilysin在结构上属于谷氨酰胺的结构类似物,因而探索其对谷氨酰胺类化合物的代谢过程调控具有重要的意义。本研究中,当在GFA的反应体系中加入bacilysin后,其转氨酶活性明显降低,20 min内其残余酶活仅剩45.2%,且随着时间的延长,该酶的催化活力剧烈下降(图9)。这与作者之前的研究结果吻合,其最低抑菌浓度达到1.8 μg×mL-1[23]。这主要是由于抑制N-乙酰--葡糖胺的生成,造成白色念珠菌的细胞壁无法正常合成[24],实现高效的抗真菌作用。
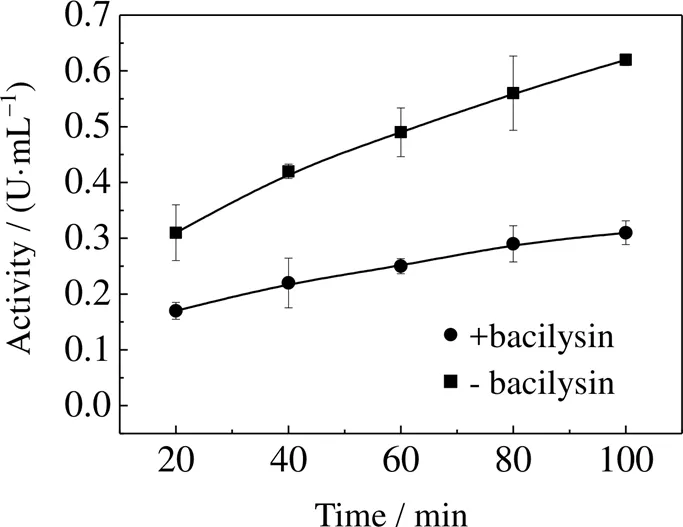
图9 Bacilysin对GFA酶活的抑制作用
4 结 论
通过本研究,在大肠杆菌BL21(DE3) Codon plus中成功表达来源于致病菌白色假丝酵母(ATCC 64548)中、具有活性的葡萄糖-6-磷酸合成酶。通过诱导条件优化,得到GFA的最佳异源表达条件为:诱导剂浓度为0.1 mmol×L-1;诱导温度为28 ℃;诱导时间为15 h;诱导时机为OD600达到1.0。
确定了最佳的反应条件:反应温度为37 ℃;反应pH为7.2,反应时间为20 min,通过双倒数方程确定米氏常数M为0.47 mg×mL-1。在此基础上探索其在抗真菌领域的应用,当反应体系中加入抑制剂(bacilysin)时,GFA转氨酶活性会显著降低54.8 %,且随着时间的增加抑制作用越明显。
本研究对于进一步提高葡萄糖胺-6-磷酸合成酶的应用潜力,加快新型抗真菌药物的研发具有重要意义。
[1] MILEWSKI S. Glucosamine-6-phosphate synthase-the multi--facets enzyme [J]. Biochimica Et Biophysica Acta, 2002, 1597(2): 173-192.
[2] DURAND P, GOLINELLI-PIPANEAU B, MOUILLERON S,. Highlights of glucosamine-6P synthase catalysis [J]. Archives of Biochemistry & Biophysics, 2008, 474(2): 302-317.
[3] MOUILLERON S, BADET-DENISOT M A, BADET B,. Dynamics of glucosamine-6-phosphate synthase catalysis [J]. Archives of Biochemistry & Biophysics, 2011, 505(1): 1-12.
[4] WANG S, LI P, SU J,. Characterization and expression of glucosamine-6-phosphate synthase from Saccharomyces cerevisiae in[J]. Biotechnology Letters, 2014, 36(10): 2023-2028.
[5] MISZKIEL A, WOJCIECHOWSKI M. Long range molecular dynamics study of interactions of the eukaryotic glucosamine -6- phosphate synthase with fructose-6-phosphate and UDP-GlcNAc [J]. Journal of Molecular Graphics & Modelling, 2017, 78: 14-25.
[6] KATO N, DASGUPTA R, SMARTT C T,. Glucosamine:fructose-6-phosphate aminotransferase: gene characterization, chitin biosynthesis and peritrophic matrix formation in[J]. Insect Molecular Biology, 2010, 11(3): 207-216.
[7] FLOQUET N, RICHEZ C, DURAND P, et al. Discovering new inhibitors of bacterial glucosamine-6P synthase (GlmS) by docking simulations [J]. Bioorganic & Medicinal Chemistry Letters, 2007, 17(7): 1966-1970.
[8] RAMAKRISHNAN J, RATHORE S, RAMAN S. Review on fungal enzyme inhibitors-potential drug targets to manage human fungal infections [J]. RSC Advances, 2016, 6(48): 42387-42401.
[9] MOUILLERON S, BADET-DENISOT M A, PECQUEUR L,. Structural basis for morpheein-type allosteric regulation ofglucosamine-6-phosphate synthase: equilibrium between inactive hexamer and active dimer [J]. Journal of Biological Chemistry, 2012, 287(41): 34533-34546.
[10] BENEITO-CAMBRA M, GAREIL P, BADET B,. First investigations for the characterization of glucosamine-6-phosphate synthase by capillary electrophoresis [J]. Journal of Chromatography B, 2017, 1072: 130-135.
[11] 夏颖, 赵杰, 夏黎明. 一种新型内切--葡聚糖酶基因在里氏木霉中的重组与表达[J]. 高校化学工程学报, 2016, 30(3): 626-632.
XIA Y, ZHAO J, XIA L M. Recombination and expression of a novel endo--glucanase gene fromin[J]. Journal of Chemical Engineering of Chinese Universities, 2016, 30(3): 626-632.
[12] RACZNSKA J, OLCHOWY J, KONARIEV P V,. The crystal and solution studies of glucosamine-6-phosphate synthase from[J]. Journal of Molecular Biology, 2007, 372(3): 672-688.
[13] HUANG X, TSUJI N, MIYOSHI T,. Characterization of glutamine: Fructose-6-phosphate aminotransferase from the ixodid tick, Haemaphysalis longicornis, and its critical role in host blood feeding [J]. International Journal for Parasitology, 2007, 37(3/4): 383-92.
[14] WANG Y H, JING C F, YANG B,. Production of a new sea anemone neurotoxin by recombinant: Optimization of culture conditions using response surface methodology [J]. Process Biochemistry, 2005, 40(8): 2721-2728.
[15] MURBY M,. UHLEN M, STAHL S. Upstream strategies to minimize proteolytic degradation upon recombinant production in[J]. Protein Expression & Purification, 1996, 7(2): 129-136.
[16] BEIGI L, KARBALAEI-HEIDARI H R, KHARRATI-KOPAEI M. Optimization of an extracellular zinc-metalloprotease (SVP2) expression inBL21 (DE3) using response surface methodology [J]. Protein Expression & Purification, 2012, 84(1): 161-166.
[17] KRZEWINSKI F, BRASSART C, GAVINI F,. Characterization of the lactose transport system in the strainDSM 20082 [J]. Current Microbiology, 1996, 32(6): 301-307.
[18] MALAKAR P, VENKATESH K V. Effect of substrate and IPTG concentrations on the burden to growth ofon glycerol due to the expression of lac proteins [J]. Applied Microbiology and Biotechnology, 2012, 93(6): 2543-2549.
[19] VILLAVERDE A, CARRIO M M. Protein aggregation in recombinant bacteria: Biological role of inclusion bodies [J]. Biotechnology Letters, 2003, 25(17): 1385-1395.
[20] SHACHRAI I, ZASLAVER A, ALON U,. Cost of unneeded proteins in E. coli is reduced after several generations in exponential growth [J]. Molecular Cell, 2010, 38(5): 758-767.
[21] STOEBEL D M, DEAN A M, DYKHUIZEN D E. The cost of expression oflac operon proteins is in the process, not in the products [J]. Genetics, 2008, 178(3): 1653-1660.
[22] WANG T, LIU X H, WU M B,. Molecular insights into the antifungal mechanism of bacilysin [J]. Journal of Molecular Modeling, 2018, 24(5): 118-128.
[23] WANG T, WU M B, CHEN Z J,. Separation, determination and antifungal activity test of the products from a new[J]. Natural Product Research, 2016, 30(10): 1215-1218.
[24] WEI W L, MONARD M, GAULD J. Computational insights into substrate binding and catalytic mechanism of the glutaminase domain of glucosamine-6-phosphate synthase (GlmS) [J]. Rsc Advances, 2017, 7(47): 29626-29638.
Heterologous expression and enzymatic characterization of glucosamine-6-phosphate synthase
WANG Tao1, FENG Jun-rui1, LI Shu-xuan1, DU Xiang1, LIU Xiao-huan1, WU Mian-bin2
(1. School of Biological Science, Jining Medical University, Rizhao 276826, China;2. Key Laboratory of Biomass Chemical Engineering of Ministry of Education,College of Chemical and Biological Engineering, Zhejiang University, Hangzhou 310027, China)
Glucosamine-6-phosphate synthase (GFA) is a key enzyme in the biosynthesis of hexosamine. In order to establish an efficient GFA production process, the heterologous expression of GFA from pathogenic bacteriumATCC 64548 was expressed inBL21(DE3) Codon plus. The results show that the optimal expression conditions of GFA were: the concentration of IPTG 0.1 mmol×L-1; induction temperature 28 ℃; induction time 15 h; induction timing (OD600) reaching 1.0. The optimum reaction conditions were determined as: reaction temperature 37 ℃; reaction pH 7.2, and reaction time 20 min. TheMvalue of GFA was determined as 0.47 mg×mL-1by Lineweaver-Burk. When the inhibitor (bacilysin) was added, the transaminase activity of GFA was significantly inhibited and reduced by 54.8 %. With the method developed in this study, glucosamine-6-phosphate synthase could be expressed heterologously, which would greatly increase its application and help accelerate the development of new antifungal drugs.
glucosamine-6-phosphate synthase; heterologous expression; enzymatic characterization; antifungal target
Q 556.9
A
10.3969/j.issn.1003-9015.2021.03.015
1003-9015(2021)03-0500-07
2019-06-11;
2019-08-30。
山东省自然科学基金博士基金(ZR2019BB062);2019年大学生创新创业训练计划(201910443059)。
王涛(1988-),男,山东青岛人,济宁医学院副教授,博士。
王涛,E-mail:tao-wang@zju.edu.cn

