肝藏血中肝郁血滞病机的实验探查
钱梦, 岳晨, 杨宗纯, 朱昊如, 范方馨, 谢鸣
(北京中医药大学方剂学系,北京 100029)
肝郁血滞是指肝气郁滞与血行不畅并存的一种病理变化。中医学认为,气行则血行,气滞则血滞或血瘀。肝藏血是指肝具有摄血、贮藏血液和调节血量的功能[1]。若肝不藏血可导致贮血不足,肝血亏虚,甚或不能制约肝阳,肝阳上亢,收摄失常引起出血诸证。肝主疏泄是指肝具有疏达舒发、调畅气机的功能,与肝藏血的功能密切相关。肝之疏泄有度,气机调畅,才能有效地储藏、调节、收摄血液;当肝疏泄不及,气机不畅,则可引起血行不畅,甚则留而成瘀[2],所谓“气结则血凝”(《血证论》)。但目前有关“肝藏血”内涵多侧重于肝疏泄太过或肝阳亢旺引起的出血方面[3],有关疏泄不及导致的血行不畅的探讨较少。从中医病机的角度来看,肝郁与血滞作为不同的病理环节,二者在病机演变中存在相互关系,特别是肝脏在气郁血滞证中扮演的角色及其现代病理生理学内涵尚不清楚。目前了解到中医血瘀证可能涉及血郁、血滞、血瘀、血结等不同类型,但血行障碍则是其共同的病理生理特点,血液循环和微循环障碍、血液高黏滞状态以及血小板活化和黏附聚集性增强是中医血瘀证的重要病理生理学基础[4]。基于中医气血相关及肝主藏血的理论和现代有关血瘀证内涵的认识,本研究拟在前期观察到的束缚应激肝郁大鼠模型伴有血液黏度异常[5]的基础上,进一步动态观察该模型复制过程中血液流变及凝血功能的变化,以探查肝郁证形成及发展中血液运行的功能状态,为认识中医“肝藏血”及“肝郁血滞”病机的现代内涵提供一定的实证理解,现将研究结果报道如下。
1 材料与方法
1.1 动物健康雄性Wistar大鼠40只,体质量210~220 g,级别SPF/VAF,动物许可证号为SCXK(京)2012-0001,由北京维通利华实验动物技术有限公司提供。所有动物提前3 d购入,于动物房适应性常规饲养。饲养条件:光照节律12-12 h(6∶00 a.m.—6∶00 p.m.),温度20~25℃,相对湿度50%±5%。本次实验方案获得了北京中医药大学伦理委员会的批准(编号:BUCM-4-2018060415-2019)。
1.2 试剂大鼠皮质酮(CORT)酶联免疫检测试剂盒(批号:20190316.60170R)、大鼠5-羟色胺(5-HT)酶联免疫检测试剂盒(批号:20190316.60087R)、大鼠去甲肾上腺素(NE)酶联免疫检测试剂盒(批号:20190316.60075R)、血浆抗凝蛋白C(PC)酶联免疫检测试剂盒(批号:20190316.60441R)、游离蛋白S(FPS)酶联免疫检测试剂盒(批号:20190316.60398R)、抗凝血酶Ⅲ(AT-Ⅲ)酶联免疫检测试剂盒(批号:20190316.60473R),以上试剂盒均由北京瑞格博生物技术有限公司提供。
1.3 仪器自制束缚筒为有机玻璃制成的圆筒状结构,主筒长25 cm,筒口外径7 cm,内径5 cm。前端置有一直径小于主筒的、可以前后调节的带有透气孔的、便于大鼠头伸进的有机玻璃前罩,后端为可调节间距的开关阀门。
旷场实验箱:木质,100 cm×100 cm×40 cm,内壁为黑色,底部线条为白色,箱底被划分为25个全等正方形格子,中心9个格作为中心区域,其余周边格为周围区域。敞箱顶部的摄像头视野覆盖整个旷场箱。采用The Observer Video-Pro&Echo Vision 3.0系统分析大鼠的行为。
Beckmancoulter UniCel DxC 600 Synchron全自动生化分析仪(美国Beckmancoulter公司);Thermo Multiskan MK7全自动酶标仪[Thermo(原芬兰雷勃)公司];ACL TOP全自动血凝分析仪(美国Beckman Coulter公司);LBY-N6C全自动血流变仪(北京普利生公司)。
1.4 造模方法参考文献[6]采用慢性束缚应激的方法复制肝郁证大鼠模型:将大鼠放入有机玻璃束缚装置中,每天束缚3 h(8∶00—11∶00 a.m.),连续造模28 d。
1.5 分组处理健康雄性Wistar大鼠40只,适应性喂养3 d后,随机分为正常组和模型组,每组各20只。造模组大鼠按上述方法造模,正常组不予任何处理,2组均常规饲养。分别于实验2周末和4周末随机挑选正常组与模型组各10只大鼠进行糖水与旷场试验,处杀并低温取下丘脑及收集血液样本,进行相应指标检测。
1.6 检测指标
1.6.1 行为学指标
1.6.1 .1 一般外观表征 于实验进行的每周二和周六观测并记录各组大鼠的一般外观行为(行为状态、活跃程度、情绪反应、睡眠状态)的变化,并给予评分。外观行为的各项评分标准参考文献[7]。统计每周各组大鼠外观行为各项积分的变化,取每周2次观测的均值。最后,将性质相近的外观表征合并为2个指标群(活动状态、情绪睡眠),并分别统计各指标群的积分。
1.6.1 .2 糖水偏嗜试验 参考文献[8]于造模第2周末和第4周末进行糖水试验测试。具体操作方法:每只动物单笼饲养,分别给予2瓶100 mL的水。第1个24 h内,2瓶水均为1%蔗糖水;第2个24 h内,给予1瓶1%蔗糖水,1瓶蒸馏水;第3个24 h内,动物禁食禁水;于第4个24 h内,进行糖水/纯水偏嗜试验,给予每只大鼠1瓶1%蔗糖水,1瓶蒸馏水,自由饮水1 h后取出2瓶水,并对2瓶称质量,记录大鼠的糖水消耗量与纯水消耗量并计算糖水偏嗜度。糖水偏嗜度=(糖水消耗量/总液体消耗量)100%。
1.6.1 .3 旷场试验 参考文献[9]于实验的第2周末和第4周末进行。将大鼠缓慢放入黑色敞箱底部中央后开始同步录像,每只大鼠计时5 min,记录大鼠5 min内的运动轨迹,存档后待分析。实验保证在室内光线柔和、安静的条件下进行,并于每只大鼠测试结束后清理尿液和粪便,再进行下只大鼠的测试。
1.6.2 实验室指标 ①下丘脑:NE,酶联免疫法检测。②血浆:CORT、5-HT、AT-Ⅲ、PC和FPS,酶联免疫法检测。③全血:血液流变学,血流变仪检测;凝血4项[凝血酶原时间(PT)、活化部分凝血活酶时间(APTT)、凝血酶时间(TT)、纤维蛋白原(FIB)],发色底物法检测;血小板聚集率,二磷酸腺苷(ADP)诱导法检测。
1.7 统计方法釆用SPSS 20.0统计软件分析处理全部数据,计量资料以均值±标准差(±s)表示。2组间比较采用t检验;多组间比较采用单因素方差析(one-way ANOVA)进行检验后,采用Student Newman Keuls Test检验;非正态分布采用非参数检验。以P<0.05为差异有统计学意义。所有图表均用GraphPad Prism 7软件制作。
2 结果
2.1 造模不同时间点的中医证候外观表征的变化
2.1.1 体质量和一般外观表征的变化 由表1可见,正常组和模型组大鼠体质量由第1~4周均逐渐增加,其中,正常组大鼠的增长速度高于模型组。与正常组比较,模型组大鼠第1~4周的体质量均显著降低(P<0.05或P<0.01)。从表2中可以看出,与正常组比较,模型组大鼠第1~4周活动状态积分明显升高(P<0.01)。从表3中可以看出,与正常组比较,模型组大鼠第1~4周情绪睡眠积分明显升高(P<0.01)。
表1 肝郁模型大鼠不同时间点体质量的变化Table 1 Comparison of the changes of body mass in rats with liver stagnation syndrome at different time points (±s,g)

表1 肝郁模型大鼠不同时间点体质量的变化Table 1 Comparison of the changes of body mass in rats with liver stagnation syndrome at different time points (±s,g)
①P<0.05,②P<0.01,与正常组比较
?
表2 肝郁证模型大鼠不同时间点活动状态积分的变化Table 2 Comparison of the changes of active state in rats with liver stagnation syndrome at different time points (±s,分)

表2 肝郁证模型大鼠不同时间点活动状态积分的变化Table 2 Comparison of the changes of active state in rats with liver stagnation syndrome at different time points (±s,分)
①P<0.01,与正常组比较
?
表3 肝郁证模型大鼠不同时间点情绪睡眠积分的变化Table 3 Comparison of the changes of emotionalsleep scores in rats with liver stagnation syndrome at different time points (±s,分)

表3 肝郁证模型大鼠不同时间点情绪睡眠积分的变化Table 3 Comparison of the changes of emotionalsleep scores in rats with liver stagnation syndrome at different time points (±s,分)
①P<0.01,与正常组比较
?
2.1.2 糖水实验和旷场实验 各组大鼠糖水实验的结果见表4。由表4可见,与正常组比较,模型组大鼠第2周和第4周糖水偏嗜度均明显降低(P<0.05或P<0.01)。
表4 肝郁证模型大鼠不同时间点糖水偏嗜度变化Table 4 Comparison of the changes of sugar water preference in rats with liver stagnation syndrome at different time points (±s,%)

表4 肝郁证模型大鼠不同时间点糖水偏嗜度变化Table 4 Comparison of the changes of sugar water preference in rats with liver stagnation syndrome at different time points (±s,%)
①P<0.05,②P<0.01,与正常组比较
?
各组大鼠旷场实验的结果见表5。由表5可见,与正常组比较,模型组大鼠第2周爬行里程数明显增加(P<0.01),中央区停留时间明显降低(P<0.05),第4周爬行里程数与中央区停留时间均明显降低(P<0.05或P<0.01)。
表5 肝郁证模型大鼠不同时间点的自主行为变化Table 5 Comparison of the changes of autonomic behaviors in rats with liver stagnation syndrome at different time points (±s)

表5 肝郁证模型大鼠不同时间点的自主行为变化Table 5 Comparison of the changes of autonomic behaviors in rats with liver stagnation syndrome at different time points (±s)
①P<0.05,②P<0.01,与正常组比较
?
2.2 造模不同时间点实验室指标的变化
2.2.1 神经-内分泌相关指标的变化 由表6可以看出,与正常组比较,模型组大鼠第2周和第4周的血浆5-HT水平均明显降低(P<0.05或P<0.01),第4周下丘脑NE水平明显降低(P<0.01),血浆CORT水平明显升高(P<0.05)。
表6 肝郁证模型大鼠不同时间点实验室指标的变化Table 6 Comparison of the changes of laboratory indexes in rats with liver stagnation syndrome at different time points (±s)

表6 肝郁证模型大鼠不同时间点实验室指标的变化Table 6 Comparison of the changes of laboratory indexes in rats with liver stagnation syndrome at different time points (±s)
①P<0.05,②P<0.01,与正常组比较
?
2.2.2 血液流变及凝血功能相关指标的变化
2.2.2 .1 血液流变学的变化 表7结果显示:与正常组比较,模型组大鼠第4周全血黏度低切、中切、高切以及血浆黏度均升高,但差异无统计学意义(P>0.05)。由表8可以看出,与正常组比较,模型组大鼠第4周全血黏度低切、中切、高切以及血浆黏度均明显升高(P<0.01)。
表7 肝郁证模型大鼠第2周血液流变的变化Table 7 Comparison of the hemorheologicalchanges in rats with liver stagnation syndrome in the second week(±s)

表7 肝郁证模型大鼠第2周血液流变的变化Table 7 Comparison of the hemorheologicalchanges in rats with liver stagnation syndrome in the second week(±s)
?
表8 肝郁证模型大鼠第4周血液流变的变化Table 8 Comparison of the hemorheological changes in rats with liver stagnation syndrome in the fourth week(±s)
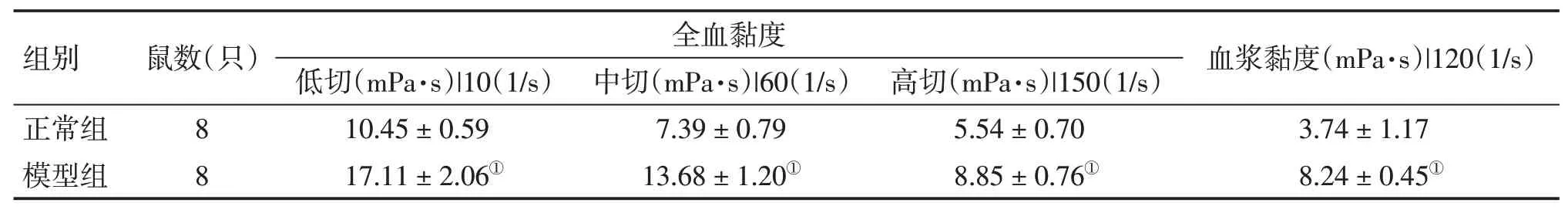
表8 肝郁证模型大鼠第4周血液流变的变化Table 8 Comparison of the hemorheological changes in rats with liver stagnation syndrome in the fourth week(±s)
①P<0.01,与正常组比较
?
2.2.2 .2 凝血4项的变化 由表9、10可以看出,与正常组比较,模型组大鼠第2周PT、APTT、TT均明显降低(P<0.01),FIB明显升高(P<0.05),第4周PT和APTT均明显降低(P<0.01),FIB明显升高(P<0.05),TT降低但差异无显著性意义(P>0.05)。
表9 肝郁证模型大鼠第2周凝血4项的变化Table 9 Comparison of the changes of four blood coagulation indexes in rats with liver stagnation syndrome in the second week (±s)

表9 肝郁证模型大鼠第2周凝血4项的变化Table 9 Comparison of the changes of four blood coagulation indexes in rats with liver stagnation syndrome in the second week (±s)
①P<0.05,②P<0.01,与正常组比较
?
2.2.2 .3 血小板聚集率的变化 由表11可以看出,与正常组比较,模型组大鼠实验第2周的3 min血小板聚集率明显升高(P<0.01);第4周的1、3、5 min血小板聚集率均明显升高(P<0.01)。
表11 肝郁证模型大鼠不同时间点血小板聚集率的变化Table 11 Comparison of the changes of platelet aggregation rate in rats with liver stagnation syndrome at different time points (±s)

表11 肝郁证模型大鼠不同时间点血小板聚集率的变化Table 11 Comparison of the changes of platelet aggregation rate in rats with liver stagnation syndrome at different time points (±s)
①P<0.01,与正常组比较
?
表10 肝郁证模型大鼠第4周凝血4项的变化Table 10 Comparison of the changes of four blood coagulation indexes in rats with liver stagnation syndrome in the fourth week (±s)

表10 肝郁证模型大鼠第4周凝血4项的变化Table 10 Comparison of the changes of four blood coagulation indexes in rats with liver stagnation syndrome in the fourth week (±s)
①P<0.01,与正常组比较
?
2.2.2 .4 血浆抗凝辅助因子的变化 由表12可以看出,与正常组比较,模型组大鼠血浆PC、FPS、AT-Ⅲ的表达水平均明显降低(P<0.01)。
表12 肝郁证模型大鼠抗凝辅助因子的变化Table 12 Comparison of the changes of anticoagulation cofactor in rats with liver stagnation syndrome (±s)

表12 肝郁证模型大鼠抗凝辅助因子的变化Table 12 Comparison of the changes of anticoagulation cofactor in rats with liver stagnation syndrome (±s)
①P<0.01,与正常组比较
?
3 讨论
3.1 肝郁证模型的复制与评价肝郁证动物模型复制方法较多[10-11],目前学界多倾向于基于中医发病学特点采用情志刺激法诱导的相关模型,如捆绑束缚法[12]、夹尾激怒法[13]和不可预知慢性刺激法[14]等,模型评价标准通常包括中医证候外观表征、相关实验室指标、糖水偏嗜实验和旷场实验[15-17]等在内的多项综合指标体系。
研究发现,采用孤养联合慢性不可预见性温和刺激法[18]和孤养联合慢性束缚应激法[19]诱导3周的肝郁证模型大鼠随着造模时间的延长逐渐出现体毛干枯、活动减少、精神萎靡等症状,第2周与第3周糖水偏嗜度明显降低,穿格次数明显降低、中央区停留时间明显增加,皮质及海马内5-HT含量明显降低,血浆CORT明显升高;采用慢性束缚应激法4周建立的肝郁证模型大鼠的糖水偏嗜度明显降低,皮质内5-HT和NE表达明显降低,外周血CORT含量显著增加[20]。表明肝郁证动物不仅表现出心情低落,情绪调节的障碍,而且伴有中枢与外周5-HT和NE水平的异常和HPA功能的亢进。
本研究发现,采用束缚应激法诱导的肝郁证模型大鼠在第1~2周出现躁动、易激惹等表现,旷场试验中的爬行里程数明显增加,但随着时间的延长至束缚第4周时则表现出萎靡、少动、扎堆、反应迟缓等表现;模型大鼠在第2~4周时糖水消耗率明显降低,旷场试验中的爬行里程数、中央区停留时间均明显降低,出现贴边,探索减少。表明模型大鼠具有阶段性发展,即中枢由兴奋逐渐转为抑制的特点。本研究也观察到,该模型大鼠下丘脑NE、血浆5-HT含量在第2周和第4周均明显降低,同时,血浆CORT持续升高,表明模型大鼠出现交感活性的降低和HPA轴功能亢进。故该模型符合中医肝郁证外观表征和神经-内分泌变化特征[21]。
3.2 肝郁证模型大鼠的血液流变学状态中医学认为,肝主藏血,参与全身血行的调节,肝气郁滞会影响到肝藏血的功能。既往临床研究曾观察到,肝郁证患者血浆还原黏度和血沉方程K值明显升高[22],肝郁气滞型原发性开角型青光眼患者低、中、高切变率下的全血黏度明显升高[23]。有实验研究发现:采用夹尾法2 d复制的肝郁证模型大鼠血小板聚集率、血沉、全血黏度及血浆黏度均明显增加[24];采用束缚四肢法2周建立的肝郁模型大鼠不同切变率下的全血黏度和血浆黏度明显升高[25]。结果提示,肝郁证存在血液流变学方面的异常,但有关中医肝藏血内涵及肝郁与血滞在病机上的联系尚不清楚。
已知血液流变可直接反映血液流动性、凝滞性和血液黏度的变化;凝血4项包括PT、APTT、TT、FIB,是目前临床用于评估凝血功能最常见的指标[26]。其中,PT与APTT反映血浆中凝血因子水平,是评估凝血功能的主要指标;TT为纤维蛋白原转化为纤维蛋白所需时长,反映血浆中有无出血抗凝物和是否存在纤溶现象;FIB是纤维蛋白的前体,反映血中纤维蛋白原的含量,纤维蛋白原可通过凝血酶酶促转化为纤维蛋白,起到阻塞血管,防止过度出血的作用,其含量高低表明机体是否处于高凝状态[27-28]。血小板聚集试验主要反映血小板的聚集功能,其聚集强度与血液高凝状态密切相关。这些指标均在一定程度上反映了机体血液流行状态。为全面地探讨肝郁与血行之间的关系,本研究对肝郁大鼠模型复制过程中反映血液流行状态的相关指标进行了动态观察。
结果观察到,造模2周时的大鼠全血黏度和血浆黏度、血小板聚集率与正常组大鼠无显著区别,但至第4周时10/s、60/s、150/s不同切变率下的全血黏度和血浆黏度均显著升高,1、3、5 min的血小板聚集率均明显升高,表明慢性束缚中的持续应激可使模型大鼠血液黏度增高。本研究还观察到,模型大鼠造模第2周和4周时的PT、APTT、TT均显著缩短,FIB明显升高,表明大鼠在模型复制早期的血凝状态即呈增强趋势,且随着造模时间的延长,进一步出现血液黏度增高,凝血功能增强,并处于高凝状态,此与模型大鼠随着造模时间的延长,肝郁外观表征和神经-内分泌异常变化的显现及加重的结果相一致,提示肝郁发展中伴随有血液流变方面的异常变化,此可为中医肝郁血滞的病机联系提供一定的现代理解。
3.3 肝郁证模型大鼠血液流变异常的机制肝脏在维持凝血状态的平衡中有着非常重要的作用。肝脏不仅是大部分凝血因子生成分泌的脏器,而且还能够通过产生AT-Ⅲ和PC等抗凝辅助因子来抑制血液高凝及异常的血栓生成。其中:AT-Ⅲ与激活的凝血因子结合、水解,从而阻断凝血级联[29];PC活化后与FPS结合,降解凝血因子Va和Ⅷa,防止其活化形成凝血酶,达到抑制血小板活化的作用。由此可以看出,肝脏通过产生凝血因子和抗凝辅助因子,调节凝血/抗凝血的平衡,以维持血液正常流行状态。本研究观察到,束缚4周的大鼠血浆抗凝辅助因子PC、FPS、AT-Ⅲ明显降低,结合该模型大鼠出现血液黏度和血小板聚集性增高,血浆PT和APTT缩短及FIB升高等变化,推测肝脏对凝血和抗凝辅助因子的生成调节可能参与该模型大鼠的血液流变异常的病理发生,也可能是中医学肝郁与血滞病机关联的脏腑病理生理学基础之一。
3.4 中医肝郁证与现代抑郁症目前认为,中医肝郁证与现代抑郁症二者甚为类近,其在内涵上有很多交集[30-33]。临床研究曾观察到:中医肝郁证患者血浆还原黏度和血沉方程K值明显升高[22],全血黏度明显升高[23];抑郁症患者纤维蛋白原[34]、血小板的活化[35]和聚集率[36]均明显增加,且纤维蛋白原水平和血小板活化程度均与抑郁症严重程度相关[34-35]。本研究采用的慢性束缚应激法也是抑郁症动物模型复制的常用方法之一[37]。既往曾有研究发现,慢性束缚应激可以增强小鼠血小板激动剂凝血酶和ADP刺激血小板聚集的能力[38]。本次研究观察到,束缚应激模型大鼠不仅出现中医肝郁证的外部表现和相关实验指标的异常,而且伴有血流变障碍及凝血和血小板聚集功能的增强,这与由其他方法复制的抑郁症动物模型所表现出的神经-内分泌[39]和血液学异常[40]具有较多的类同,进一步证明中医肝郁与西医抑郁症二者在病理生理学方面具有的同质性。提示该法建立的中医肝郁模型用于抑郁症中医药防治及其机制研究方面具有潜在价值。
本研究动态观察了肝郁证模型大鼠造模过程中的中医证候和血液流变/凝血状态的变化,结果显示:束缚过程中大鼠经历由早期的神经兴奋状态逐渐转为抑郁状态的变化过程,束缚4周不仅表现出少动喜静、行动迟缓、情绪低落等抑郁状态,而且伴有交感神经活性降低和HPA轴的亢进等神经内分泌变化特点。大鼠束缚第2周即出现凝血活性的增强,至第4周进一步出现全血黏度和血浆黏度及血小板聚集率的显著升高,血液呈现出一定程度的高凝状态,同时,血中源于肝脏的凝血因子增强和抗凝辅助因子降低。表明随着肝郁的形成及发展,逐渐出现血行方面的障碍,肝脏可能参与了其中的部分调节,但其确切的机制有待进一步研究。本研究为揭示中医“肝藏血”及“肝郁血滞”病机的现代内涵提供了一定的实验依据。

