耐紫杉醇肺原位小鼠移植瘤模型的建立和鉴定
杨晓华,郭莉莉,路丽明
(1.上海市胸科医院,上海交通大学附属胸科医院,实验中心,上海 200030;2.上海市免疫学研究所,上海交通大学医学院,上海 200025)
肺癌临床表现复杂症状隐蔽,难于早期发现,所以肺癌后期的化疗成为了肺癌治疗的主要方法。然而化疗耐药性,尤其是多药耐药(multidrug resistance,MDR),成为了肿瘤化疗失败的重要原因[1-3]。之前对MDR进行研究,多采用体外细胞系的方法。由于体外细胞系无法模拟与MDR具有密切关系的动物内环境和免疫系统,因而建立了耐药细胞株动物模型,如肺癌耐药A549/DDP动物模型[4],耐紫杉醇(Taxol)肺癌细胞动物模型[5]。
以往建立的动物模型均采用皮下成瘤的方法,这种方法具有成瘤率高、耐药性好、肿瘤遗传特性稳定等优点。但由于皮下异位使肿瘤并不处于肺部原位组织,因而不具有肺癌肿瘤细胞的生长环境和生物学特性,也很难模拟出肺癌肿瘤的临床表征[6-7]。将耐药肺癌细胞移植到肺部原位处能够很好的模拟肺癌肿瘤的内部生长环境,保留其在体内原位处的生理特性。这种动物模型可实现对肺癌肿瘤细胞的“全真模拟”,对MDR机制的深入研究,抗癌药物的研发及逆转MDR药物的筛选都具有重要意义。
1 材料与方法
1.1 材料
1.1.1 实验动物
40只4~6周龄SPF级雄性裸鼠,每组20只,分别为A549组和A549-Taxol组。体重16 g左右,购自上海杰思捷实验动物有限公司【SCXK(沪)2018-0004】,按照SPF级动物饲养标准在上海市胸科医院【SYXK(沪)2018-0016】进行饲养。饲养环境:昼夜各半循环照明,湿度恒定,室温(23±2)℃,裸鼠分笼饲养,自由饮水、摄食。实验过程中对动物的处置符合2006年9月科技部颁布的《关于善待实验动物的指导性意见》,所有操作均符合实验动物伦理学要求(伦理审查号:KS2028)
1.1.2 细胞
人肺腺癌细胞(A549)由本室常规传代培养,耐紫杉醇人肺癌腺细胞株(A549-Taxol)由本实验室建立[8],培养于10%灭活胚胎牛血清的高糖DMEM培养液,并在含有浓度5%的CO2,37℃的培养箱中培养。细胞传代使用0.25%的胰蛋白酶处理。
1.1.3 主要试剂与仪器
胚胎牛血清(BSA)和高糖DMEM培养基均购自Gibco公司;胰蛋白酶,四甲基偶氮唑盐(MTT),二甲基亚砜(DMSO)均购自Sigma公司;谷胱甘肽S-转移酶(GST-π)抗体,糖蛋白(P-gp170)抗体和基质金属蛋白酶(MMP-7)抗体,均购自北京中山生物科技有限公司;带U6启动子的过表达质粒pCDHCMV-MCS-EF1-GFP-T2A-Puro(带阴性质粒)和PLVX-shRNA-GFP购自ADDGENE公司pCDH(Promega,Madison,WI)。
超净工作台(Thermo,美国);全自动酶标仪(Biotek,美国);CO2培养箱(Thermo,美国);离心机(Thermo,美国);倒置相差显微镜(Leica,德国)。
1.2 方法
1.2.1 裸鼠肺部原位移植瘤模型的建立
原位移植瘤模型的建立主要采用穿刺法,将裸鼠用0.05 g/mL氯胺酮按每只0.1 mL腹腔麻醉后,右侧卧位固定。分别向小鼠肺部注入肿瘤细胞悬液。取不同量的原代培养的A549和A549-Taxol细胞用胰蛋白酶消化处理成悬液,并与一定体积的matrigel混合至终体积3 mL,使用灭菌针头将每个具有一定细胞数量的混合液,沿小鼠左肩胛第5肋间缓慢进针约5 mm后向肺内注射细胞液,每只实验裸鼠接种细胞数约每毫升5×106,稍作停留后抽出针头。注射完毕松开实验裸鼠,观察至其恢复正常呼吸后放回饲养笼饲养,以防实验意外[9]。A549组和A549-Taxol组小鼠各20只。
1.2.2 实验裸鼠状态观察及体重测量
接种肿瘤细胞后每日观察A549组和A549-Taxol组实验裸鼠临床症状、每周2次称量并记录其体重,绘制体重变化曲线。
1.2.3 细胞耐药性测定
小鼠皮下成瘤3代后,将成肿瘤小鼠处死,在无菌条件下分离肿瘤组织,并用筛网制备单细胞悬液,然后采用MTT法测定耐药性。将细胞以每毫升3×104个接种于96孔培养板,每孔100μL。Taxol用培养液稀释成终浓度为20、40、80、160、320、640递增至20 480μg/L,每一浓度重复3孔,同时,使用100μL培养液作为对照。培养48 h后,每孔加入20μL 5 g/L的MTT溶液,继续培养4 h后,弃上清,每孔加入DMSO,震荡混匀后,在540 nm下测定各孔光密度值,计算50%细胞抑制所需的药物浓度(IC50),并根据公式计算耐药指数:耐药指数=耐药细胞IC50/亲代细胞IC50。
1.2.4 P-gp170干扰和过表达载体构建
根据P-gp170 mRNA选择目标序列按shRNA的设计原则设计多聚核苷酸序列保留BamHI或XbaI的酶切位点并确定其为特异性序列。正义、反义序列分别为5’-CCUGGACAAUGACAAGUACAUTTT-3’和5’-AUGUACUUGUCAUUGUCCACCTT-3’。
两条寡核苷酸链经过混合、变性、退火形成双链寡核苷酸。载体经过酶切成线性,将退火的寡核苷酸连接到载体后、转化、摇菌、铺平板挑选单克隆进行细菌扩增,最后利用质粒小抽试剂盒获得干扰载体。过表达载体是基于pCDH-CMV-MCS-EF1-GFP-T2A-Puro骨架构建的,首先根据NCBI找到P-gp170基因编码序列,然后PCR扩增序列,通过酶切酶连的方法连接目标序列和质粒骨架,再通过转化扩增及质粒小抽试剂盒,获得过表达载体。最后,上述的干扰载体和过表达载体都经过细胞转染,进行载体验证和后续实验。
1.2.5 RT-PCR
用TRIzol试剂提取细胞总RNA,在MMLV逆转录酶的作用下合成cDNA,然后以此为模板进行PCR,比较GST-π、P-gp170和MMP-7基因的表达情况。目的基因GST-π:上游引物5’-CCCTACACCG TGGTCTATTTCC-3’,下游引物5’-CAGGAGGCTTT GAGTGAGC-3’;目的基因MMP-7:上游引物5’-GAGTGAGCTACAGTGGGAACA-3’,下游引物5’-CTATGACGCGGGAGTTTAACAT-3’;目的基因Pgp170:上游引物5’-GGGAGCTTAACACCCGACTTA-3’,下游引物5’-GCCAAAATCACAAGGGTTAGCTT-3’;内参基因GAPDH:上游引物5’-TCACCATC TTCCAGGAGCG-3’,下游引物5’-AGTGAGCTT CCCGTTCAGA-3’;扩增后15 g/L琼脂糖凝胶电泳,凝胶成像扫描系统扫描分析。
1.2.6 Western Blot
预冷的PBS洗涤3次,加入150μL上样缓冲液95℃煮5 min,短暂离心,800 rpm LSDS-PAGE电泳,每孔上样60μL。样品分离后转移至硝酸纤维素(NC)膜(转印缓冲液含20 mmol/L Tris,200 mmol/L甘氨酸,200 mmol/L甲醇)。转印后NC膜室温干燥于4℃保存。检测前将NC膜置于含50 mL/L牛血清白蛋白的TBST缓冲液中室温封闭1 h,分别加入羊抗人多克隆抗体GST-π、P-gp170、MMP-7(4℃孵育过夜)和GAPDH(室温孵育2 h),TBST再次漂洗,然后加入辣根过氧化物酶标记的二抗(抗羊、抗鼠)室温孵育2 h,TBST漂洗后DAB显色,凝胶成像扫描系统扫描分析。
1.2.7 免疫组化和切片
标本经4μm连续切片,分别做HE和免疫组化染色。免疫组化染色采用两步法(EnVisionTM)。具体如下:切片脱蜡至水,尿素消化,3%过氧化氢封闭,用柠檬酸缓冲液进行微波修复,冷却,10%羊血清封闭,加一抗4℃过夜;从冰箱取出37℃复温,用自来水冲洗抗体,加入抗兔二抗(EnVision)和抗鼠二抗,37℃恒温反应(中间各步用PBS洗),加DAB显色,在显微镜观察终止显色。用苏木素轻微复染,脱水透明封片,在光镜下观察,对照组设阳性、阴性和空白对照。
1.2.8 双免疫荧光
加P-gp170一抗4℃过夜等步骤同上,第2天复温后加FITC标记的山羊抗兔抗体,37℃恒温40 min,PBS洗;加V-ATPase鼠抗,4℃过夜,PBS洗,加TRITC标记的红色抗鼠荧光抗体,37℃40 min,PBS洗,甘油封片,激光共聚焦镜观察、照相。
1.2.9 细胞划痕实验和迁移实验
将A549-Taxol耐药细胞与A549细胞分别接种于6孔板中,待细胞贴壁后,进行划线。分别拍照记录划线后0、24、48 h的细胞划痕的宽度。细胞迁移实验利用了Transwell小室,将两种细胞悬液加入Transwell小室中,待24 h和48 h后,用结晶紫染色拍照。
1.3 统计学分析
本文的实验数据均用平均值±标准差(±s)表示,并用GraphPad Prism软件处理,两组组间比较使用独立样本t检验,以P<0.05表示差异具有显著性。
2 结果
2.1 细胞耐药性测定
A549-Taxol耐药细胞经BNX小鼠皮下传代3代,增强其成瘤性后,检测A549-Taxol细胞IC50为(6349±0.87)μg/L,而亲代A549细胞IC50为(12.5±0.42)μg/L,A549-Taxol细胞耐药指数是亲代细胞的508。
2.2 耐药基因表达情况
为了探讨紫杉醇耐药细胞的耐药机制,通过比较紫杉醇耐药细胞和A549细胞中耐药蛋白GST-π[10-11]、P-gp170[12-13]和 MMP-7[14]的 表 达。RT-PCR和Western Blot结果显示:GST-π和P-gp170在耐药细胞株中表达显著高于正常组A549肺癌细胞(P<0.001)(图1),免疫荧光结果也显示耐药细胞株的耐药蛋白表达明显升高(图2)。研究报道紫杉醇是p-糖蛋白的潜在底物,p-糖蛋白的高表达可抑制药物吸收从而导致耐药[12-13]。此外,GST-π的异常表达也与肿瘤对化疗药物耐药的发生发展有关,紫杉醇也可能作为GST-π的底物通过催化偶联反应直接代谢[10-11]。因此,结果说明紫杉醇耐药细胞可能通过高表达GST-π和p-gp170阻碍紫杉醇吸收从而产生耐药。另一方面,研究发现耐药细胞株中MMP-7的表达量也显著性高于正常组A549细胞(图1),细胞划痕实验(图3A)和侵袭实验(图3B)显示紫杉醇耐药细胞株也有更强的迁移和侵袭能力。这说明紫杉醇耐药株细胞可能通过增加细胞迁移和侵袭能力起到耐药的作用。

图1 耐药和正常A549细胞内耐药蛋白的表达情况Note.Compared with A549,*P<0.05,**P<0.01.(The same in the following figures)Figure 1 Expression of drug-resistant protein in Taxol and normal A549 cells
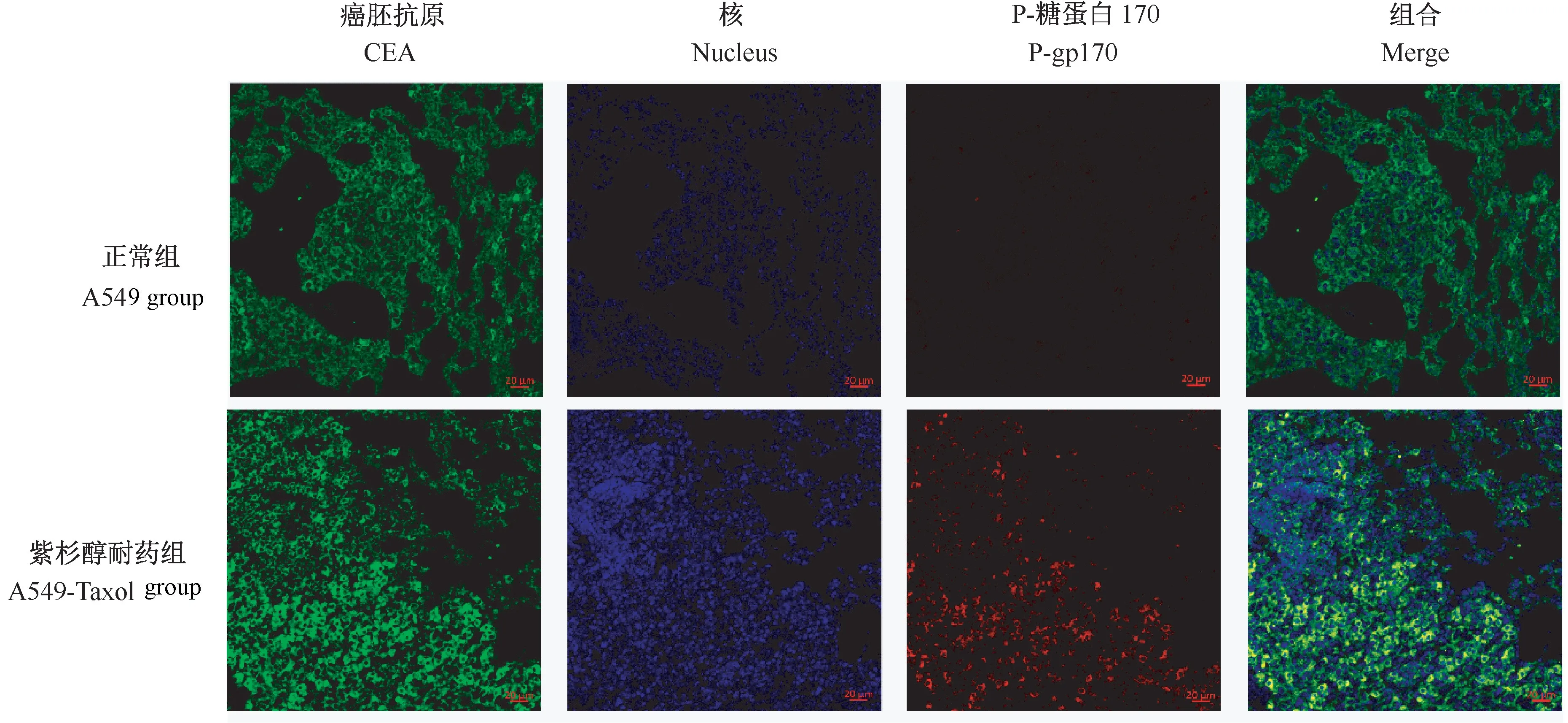
图2 耐药蛋白P-gp170在耐药和正常A549细胞内的表达情况Figure 2 Expression of drug-resistant protein P-gp170 in Taxol and normal A549 cells

图3 紫杉醇耐药细胞和正常A549细胞的迁移情况Note.A.Woundhealing test.B.Transwell test.Figure 3 Migration capacity of Taxol and normal A549 cells
2.3 P-gp170耐药基因的验证
为了进一步的验证耐药基因与紫杉醇耐药之间的直接关系,以P-gp170为例,构建了p-gp170的过表达细胞株和沉默表达的细胞株。经过细胞转染后验证的结果得出:过表达P-gp170后,P-gp170基因明显高表达。干扰shRNAP-gp170后,P-gp170基因极显著低表达。图4结果发现,A549-Taxol耐药细胞转染载体后,组别为耐药株、干扰空载、干扰shRNA P-gp170、过表达空载、过表达PCDH p-gp组,对应的IC50依次为(6349±0.87)μg/L、(6544±42)μg/L、(3256±56)μg/L、(6233±61)μg/L、(8649±122)μg/L。其中,干扰shRNA P-gp170组相对于耐药组IC50降低2倍左右,明显不耐药。而过表达PCDH p-gp组相对于耐药组IC50增加1.4倍左右,耐药程度增加。结果说明p-gp170的表达与紫杉醇耐药直接相关,可能是通过阻碍紫杉醇吸收导致细胞耐药。

图4 A549细胞中耐药蛋白p-gp170的表达情况Note.Compared with Taxol resistant strains,**P<0.01.Figure 4 Expression of drug-resistant protein p-gp170 of A549 cells
2.4 A549-Taxol裸鼠生长情况
结果发现,紫杉醇耐药细胞株的建立提供了一种研究模型,可以在体外研究紫杉醇耐药机制。但是对于临床研究来说,体外实验不能很好的反应真实情况,因此需要建立小鼠模型。为了更贴近患者实际情况,本研究采用了原位移植的方法,将小鼠左肩胛第5肋间作为进针位点,注射肿瘤细胞(图5 A)。原位移植裸鼠后1~1.5周,A549和A549-Taxol组小鼠体重未见明显变化;1.5~2.5周,两组小鼠体重急剧上升;第2.5周开始,A549和A549-Taxol组小鼠弓背明显;腹部逐渐出现膨隆,体重有所下降,A549-Taxol组小鼠症状较为严重,两组小鼠体重变化曲线(图5B)。

图5 肺癌原位移植模型图与小鼠体重变化Note.A.Model of tumor implantation.B.Change of body weight.Figure 5 Orthotopic lung cancer model and the change of body weight
2.5 成瘤率、肺部组织形态及HE染色观察
饲养3周后,统计两组裸鼠的成瘤率,A549组和A549-Taxol组的成瘤率分别为80%和85%,图6A和图6B为A549组和A549-Taxol组裸鼠的肺部组织形态,可见已有团装肿瘤组织生长。图6C和图6D为两组小鼠HE染色图片,可见团状肿瘤组织周围肺组织及细支气管受压,病灶内有血管穿行。肿瘤细胞呈圆形、椭圆形或梭形,胞浆稀少,核大且圆,核浆比增加,可见病理性核分裂,病灶内肿瘤细胞呈巢团状排列。

图6 小鼠原位成瘤Figure 6 Orthotopic tumor of mice
2.6 肿瘤组织中耐药蛋白表达
免疫组化显示GST-π、P-gp170和MMP-7在A549-Taxol组裸鼠中明显表达(图7),PCR和Western Blot定量分析耐药的表达结果显示GST-π、P-gp170和MMP-7在A549-Taxol组裸鼠肿瘤组织中表达明显升高(图8)。

图7 肿瘤组织内耐药蛋白的表达情况Figure 7 Expression of drug resistant protein in tumor tissues

图8 肿瘤组织内耐药蛋白的表达情况Figure 8 Expression of drug resistant protein in tumor tissues
综上所述,GST-π、P-gp170和MMP-7与肺癌紫杉醇耐药相关,通过对肺癌紫杉醇耐药细胞的研究发现,P-gp170可能通过阻碍紫杉醇吸收导致细胞耐药,此外紫杉醇耐药细胞通过提高MMP-7的表达量增加侵袭性,也间接导致细胞耐药。为了更贴近临床实际情况,研究人员采用5×106细胞量、进针5 mm的注射法建立了耐紫杉醇肺癌细胞肺部原位移植动物模型,通过实验证明了此动物模型的稳定性,可用于多种实验研究。
3 讨论
肺癌成为肿瘤死因的首位,2012年公布的数据显示肺癌患者的5年生存率仅为10%~15%[15],肺癌化疗的多药耐药(MDR)成为肿瘤治疗的主要阻碍。因此,深入了解肺癌MDR的机制,对于开发抗肿瘤药物、提高肿瘤化疗成功率具有重要意义。近年来国内外已经建立了多种多耐药细胞株,在体外对MDR进行研究发现生物膜表面蛋白基因过量表达产生的P-gp170,细胞内还原型谷胱甘肽GSH和GST-π及肺耐药蛋白等都与MDR有着密切关系[16-17]。但是体外与体内实验仍存在一定差异,因而建立肿瘤耐药模型显得尤为必要。
目前已成功建立了肝癌、胃癌、胶质瘤等肿瘤多药耐药动物模型[18-20],但肺癌耐药动物模型的报道并不多,实体瘤耐药移植模型多采用皮下移植和原位移植两种途径。然非原位移植的皮下瘤与在肺部原位处的肿瘤之间生物学特性相差很大,因此借助于非原位移植皮下瘤模型的研究结果,与实际临床效果之间必然具有某些不同。所以原位移植瘤模型的建立就显得尤为重要,因为这种模型能够更加接近癌症患者体内的真实情况,更好地模拟人晚期肺癌的特征,更好地应用于临床诊断治疗和MDR机制的研究。如果临床上想要利用消融手术治疗耐药性肺癌,可以利用本研究建立的肺癌原位移植耐药肿瘤模型进行消融研究,给临床治疗提供有效的建议。
紫杉醇与长春新碱、长春花碱、多柔比星等有交叉耐药现象[21-22]。本实验室已成功建立A549-Taxol细胞株,其耐药指数为512倍,此次研究中采用此细胞株进行裸鼠皮下成瘤,然后将注射后的小鼠进行SPF级饲养,进而采用免疫印迹、免疫染色等手段对小鼠体内的成瘤细胞进行相关生物学特性测定。结果表明注入细胞量为每毫升5×106,进针深度为5 mm时,成瘤率为85%,耐药指数为508倍,从而初步建立了一个耐紫杉醇肺癌细胞肺部原位移植动物模型。
本研究基本建立耐紫杉醇肺原位移植瘤模型,此肺癌模型将可以更好地模拟肺癌病人耐药后肿瘤的生长、浸润、转移等临床特征,为开发筛选有效逆转肿瘤多药耐药的新型药物及深入探索肿瘤耐药机制奠定基础。

