西太平洋沿海石斑鱼属鱼类DNA条形码及分子系统进化研究
梁日深 唐丰寿 何浩斌 汪 健 李江涛 李清清 陈轶之 林 蠡 张 凯
(1. 仲恺农业工程学院动物科技学院, 广东省水环境与水产品安全工程技术研究中心, 广东省水禽健康养殖重点实验室,广州市水产病害与水禽养殖重点实验室, 广州 510225; 2. 深圳市里维生鲜科技开发有限公司, 深圳 518052)
石斑鱼属(Epinephelus)隶属鲈形目(Perciformes), 鲈亚目(Percoidei), 鮨科(Serranidae)石斑鱼亚科(Epinephelinae), 是石斑鱼亚科中物种数量最多的一个属, 广泛分布于全球热带、亚热带海域, 是珊瑚礁的重要鱼类, 也是重要的海洋经济名贵食用鱼类。世界上石斑鱼属98种[1], 我国约40余种, 主要分布于东海及南海[2—6]。
形态上, 石斑鱼属鱼类近缘物种十分相似, 许多种类在外部形态特征如体色和斑纹都非常接近,且许多种类体色与斑纹还会随着个体的发育发生巨大变化, 幼鱼与成鱼的形态截然不同[1,3]。另外,在不同的生活环境及生理应激状态下, 许多石斑鱼的体色花纹会出现明显变化, 给传统基于外部性状的系统分类带来巨大的困扰, 许多种类的分类与命名存在巨大争议[1—6]。如云纹石斑鱼(Epinephelus moara)与褐石斑鱼(Epinephelus bruneus), 斜带石斑鱼(Epinephelus coioides)与马拉巴石斑鱼(Epinephelus malabaricus), 均存在同种异名的分类争议。在分子水平研究上, Craig等[7]最先针对东太平洋及西大西洋分布石斑鱼类进行较为系统的分子分类学研究。而对于西太平洋分布的种类, 国内也有部分研究报道, 如丁少雄等[8]利用16S rRNA及庄轩等[9]利用Cytb基因分析我国近海20余种石斑鱼属鱼类系统分类关系; 陈兴汉等[10]基于Cytb基因分析南海10种石斑鱼属鱼类的分类关系等。但上述研究主要是围绕石斑鱼亚科的研究中涉及部分石斑鱼属的种类, 针对西太平洋石斑鱼属的详细系统演化关系研究还存在一定空白。
DNA条形码(DNA Barcoding)技术是通过一个标准目的基因的DNA序列分析而进行物种鉴定的技术, 它能在分子水平上成功区分物种, 为物种分类提供一种快速有效的辨别方法[11,12]。在鱼类上,该基因是线粒体细胞色素C 氧化酶亚基Ⅰ(COⅠ)基因5′端一段长度为648 bp 的片段, 在前期许多研究中已验证其可作为许多鱼类有效的DNA条形码基因。如Pereira等[13]利用COⅠ条形码序列对新热带区的254 种淡水鱼类进行分子鉴定, 其中252 种鱼类能被清晰区分, 并确定23个隐存种; 张楠等[14]基于DNA条形码技术对江门沿岸海域夏季鱼卵的鉴定, 获得鱼卵个体有效线粒体COⅠ序列信息217个, 成功鉴定鱼卵5目14科19属20种(未知种2种)。TMO-4C4是一个单拷贝的核基因, 被认为是与肌联蛋白titin相似, 与肌肉组装和静息张力有关,最初由Streelman和Karl[15]分离, 目前国外广泛用于鱼类的系统发育研究[16—18], 解决了许多鱼类分类争议问题, 而国内利用TMO-4C4标记进行鱼类系统进化研究的相对较少[19]。本研究选择COⅠ和TMO-4C4基因, 线粒体DNA与核DNA标记相结合, 共同分析西太平洋35种石斑鱼分子系统分类关系, 同时探讨COⅠ基因在石斑鱼属物种分子鉴定的有效性,为解决石斑鱼属分类争议问题及物种有效鉴定提供分子水平依据。
1 材料与方法
1.1 样品采集
石斑鱼属鱼类样品于2018—2019年在中国广东、福建、海南和香港等沿海地区的水产市场及渔港码头进行野外采集, 另有部分种类采集于菲律宾、印度尼西亚和澳大利亚等西太平洋国家。最后共获得石斑鱼属鱼类样品35种共142个个体。采集标本根据《Grouper of the World》[1]、《中国鱼类分类检索》[2]和《台湾鱼类志》[3]等主要分类资料进行初步形态鉴定。所有样品取肌肉或鳍条于95%酒精中固定, 用于实验室总基因组DNA的提取。石斑鱼样品种类与来源见表1。
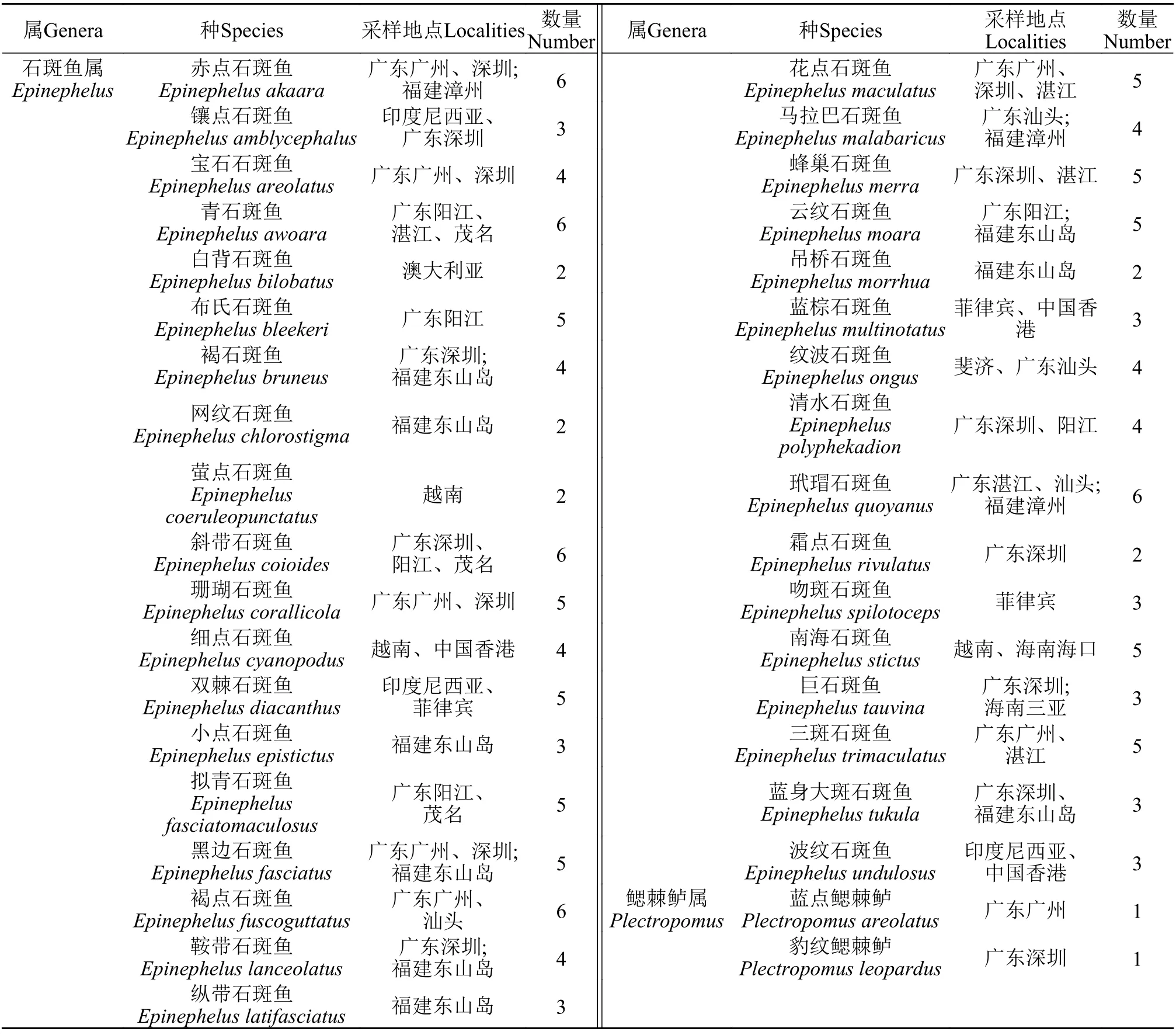
表1 实验材料的种类和采集地Tab. 1 Species and localities of experimental samples
1.2 总基因组DNA的提取
取约50 mg酒精固定的样品组织, 利用动物组织DNA提取试剂盒 (天根生化科技有限公司), 按照使用说明书进行提取。最后提取的总基因组DNA溶解于100 μL灭菌蒸馏水, 电泳检测, –20℃保存备用。
1.3 PCR扩增和测序
本研究扩增的基因片段为线粒体COⅠ基因与核基因TMO-4C4。参考文献[20], 选择扩增COⅠ基因片段的通用引物为COⅠ-F1: 5′-TCAACYAATCA YAAAGATATYGGCAC-3′和COⅠ-R1: 5′-ACTTCYG GGTGRCCRAARAATCA-3′。扩增TMO-4C4基因片段的引物为TMO-4C4-F1: 5′-GAAAAGAGT GTTTGAAAATGA-3′和TMO-4C4-R1: 5′-CATC GTGCTCCTGGGTGACAAAGT-3′[15]。PCR反应体系总体积为50 μL, 其中包括PCR Mix反应混合液(天根生化科技有限公司)25 μL、灭菌蒸馏水21 μL、上下游引物(10 μmol/L)各1 μL、DNA样品2 μL。PCR反应条件为94℃预变性5min, 94℃变性30s,55℃退火30s, 72℃延伸1min, 设置35个循环, 最后72℃再延伸5min。PCR产物用1%琼脂糖凝胶电泳检测, 纯化回收后送天一辉远生物技术有限公司双向测序。
1.4 数据分析方法
测序所得序列运用 BioEdit 软件查看序列结果并辅助测序峰图进行人工校正, 序列经NCBI的Blastn工具进行相似性检索, 验证序列的准确性。利用Clustal W[21]软件进行排序比对, 去掉两端冗余序列, 得到一致序列进行后续的分析计算。利用MEGA 7.0[22]软件计算序列的碱基组成、序列转换颠换值、保守位点、变异位点和遗传距离(基于Kimura-2-Parameter模型)等数据。系统进化树的构建采用最大似然法及贝叶斯法, 以石斑鱼亚科的鳃棘鲈属2种鱼类作为外类群。利用jModelTest 2.1.5进行最佳进化模型预测[23], 最大似然树在RAxML 8.0[24]软件中完成, 分支的置信度采用重复抽样分析方法,重复抽样的次数为1000次。贝叶斯法分析在Mr Bayes 3.1.2[25]软件中完成, 随机选取起始树, 计算1000000代, 取样代数100, 系统进化树节点置信度由后验概率(Posterior probabilities)提供。
2 结果
2.1 序列特征分析
扩增获得35种142个石斑鱼个体COⅠ序列同源片段为636 bp, 利用MEGA 7.0软件分析可知, 序列中 A、T、G和C 碱基平均含量分别为24.4%、29.9%、17.8%和27.9%, 其中 A+T 含量(54.3%)高于 G+C 含量(45.7%), 编码212个氨基酸, 无碱基插入与缺失。在 636 bp编码序列中, 密码子第1位4种碱基含量差异不大, 其中G-1 (30.0%)最高, T-1(18%)最低; 密码子第2位, T-2 含量(42.0%)最高, 明显高于其他3种碱基, A-2(15.1%)最低; 密码子第3位中T-3、A-3和C-3三种碱基含量相差不大, 而G-3含量最低(8.9%), 表现出明显的反 G 偏倚。在 G+C含量中, 密码子第 1位点 G+C 含量(55.9%)高于第2和第3位(42.5%, 38.7%)。此外, 在长度为 636 bp序列中, 除去外类群, 保守位点 403 个(63.4%), 变异位点 233(36.6%), 简约性信息位点 205 (32.2%)。
在TMO-4C4基因中, 同源序列为486 bp, 编码162个氨基酸。碱基A、T、G和C平均含量分别为28.2%、25.1%、27.1%和19.6%, A+T含量(53.3%)高于G + C(46.7%)。密码子第1与第2位4种碱基含量差异较大, 密码子第1位碱基含量最高为G-1(43.0%), 最低是C-1(14.2%), 密码子第2位最高是A-2(37.6%), 最低是G-2(9.6%), 明显的反G偏倚。而密码子第3位4种碱基含量分布较为平均, 均在20%—30%。序列的保守位点443个(67.5%), 变异位点43个(32.5%), 简约性信息位点23个(18.6%)。与COⅠ基因相比,TMO-4C4基因序列保守, 变异位点数远低于COⅠ基因, 物种间序列差异性较小。
基于Kimura 2-Parameter 模型计算COⅠ与TMO-4C4基因序列转换与颠换之比值分别为4.104和2.772, 两基因转换明显大于颠换。另外, 基于DAMBE7[26]软件对COⅠ与TMO-4C4基因转换颠换突变饱和分析。根据分析所得的散点图, 随着遗传距离的增大, 转换与颠换均呈线性递增趋势, 转换增加的速率大于颠换增加的速率, 显示COⅠ与TMO-4C4基因均未突变饱和, 可用于后续进化树的分析。另外, 汇总出COⅠ与TMO-4C4基因序列核苷酸平均变异情况(表2)。在COⅠ基因中, 相同碱基对平均555个, 转换碱基对63个, 颠换碱基对18个;TMO-4C4基因相同碱基对平均479个, 转换碱基对5个, 颠换碱基对2个。两基因转换与颠换均属第3密码子出现最多(表2)。这可能与密码子第3位发生的碱基替换不易造成氨基酸突变, 而第 1和第 2位点的替换容易引起氨基酸突变有关。

表2 COⅠ与TMO-4C4基因片段碱基转换和颠换数Tab. 2 Numbers of transition and transversion of COⅠ and TMO-4C4 gene sequences
利用MEGA 7.0基于Kimura 2-parameter模型计算出35种石斑鱼COⅠ与TMO-4C4种内与种间遗传距离。在COⅠ基因中, 除去外类群, 在35种石斑鱼中, 种内遗传距离为0.000—0.008, 其中吊桥石斑鱼种内遗传距离最大, 为0.008, 其次是波纹石斑鱼与青石斑鱼, 均为0.006, 其他种类种内遗传距离均不大于0.005, 平均遗传距离为0.0027, 显著低于Hebert等[11]所推荐的物种鉴定最小种间遗传距离0.020(2%)。35种石斑鱼属鱼类种间平均遗传距离为0.144, 是种内平均遗传距离的48倍, 其中种间遗传距离最大为玳瑁石斑鱼与网纹石斑鱼(0.202), 其次是蜂巢石斑鱼与霜点石斑鱼(0.200); 种间遗传距离最小为云纹石斑鱼与褐石斑鱼(0.027), 其次是斜带石斑鱼与马拉巴石斑鱼(0.036), 均大于Hebert等[11]设定的种间遗传距离2%的遗传差异。这表明COⅠ基因可以清晰区分石斑鱼属不同物种。
在TMO-4C4基因中, 遗传距离是0.000—0.030,平均遗传距离为0.015, 可知核基因TMO-4C4比线粒体基因COⅠ保守很多, 遗传距离最大在南海石斑鱼与鞍带石斑鱼之间(0.032), 其次是网纹石班鱼与鞍带石斑鱼(0.029); 遗传距离最小值为0.000, 两物种间序列无显著差异, 如褐石斑鱼与云纹石斑鱼,斜带石斑鱼与玛拉巴石斑鱼, 细点石斑鱼与蓝棕石斑鱼等。TMO-4C4序列十分保守, 在亲缘关系很近的物种间存在的遗传差异极小, 甚至无法区分物种。
2.2 分子系统进化关系分析
基于COⅠ、TMO-4C4和COⅠ+TMO-4C4联合序列, 以鳃棘鲈属中2种鳃棘鲈作为外类群进行进化树构建。根据jModelTest 2.1.5预测, 3种序列最佳核苷酸替代模型均为GTR + G + I, 系统进化树利用最大似然法及贝叶斯法2种方法进行构建。每种序列基于2种方法构建的进化树进行合并, 树上的节点分别为最大似然法支持率及贝叶斯法后验概率(图1、图2和图3)。其中基于COⅠ+TMO-4C4联合序列构建的进化树各节点支持率及后验概率相对较高, 物种分类地位比较清晰, 这里主要针对COⅠ+TMO-4C4联合序列构建的系统进化树进行分析。在进化树上, 同种石斑鱼不同个体均能聚在一起, 形成该石斑鱼种内单系分支。鉴于个体样品数量多, 在进化树无法一一显示, 故进化树图片仅汇总35种石斑鱼种间聚类关系, 每种石斑鱼后标明样品个体数。35种石斑鱼大致分成两大类群, 类群Ⅰ由细点石斑鱼和蓝棕石斑鱼等22种石斑鱼聚成, 类群Ⅱ由吊桥石斑鱼和小点石斑鱼等13种石斑鱼组成。两大类群中亲缘关系较近的石斑鱼又聚成一些小分支, 部分物种在进化树上以高支持率聚成姐妹种, 如细点石斑鱼与蓝棕石斑鱼、白背石斑鱼与花点石斑鱼、吊桥石斑鱼与小点石斑鱼、萤点石斑鱼与珊瑚石斑鱼、云纹石斑鱼与褐石斑鱼、斜带石斑鱼与马拉巴石斑鱼等。

图1 35种石斑鱼属鱼类基于COⅠ序列利用最大似然法与贝叶斯法构建的分子系统进化树Fig. 1 Molecular phylogenetic trees of 35 Epinephelus fish based on COⅠ sequences constructed by maximum likelihood and Bayesian inference method
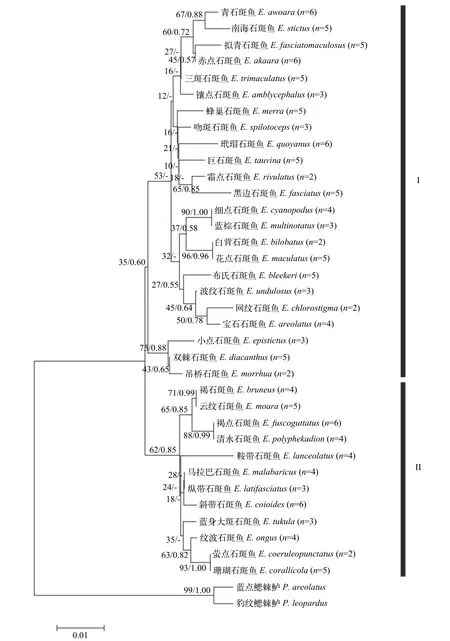
图2 35种石斑鱼属鱼类基于TMO-4C4序列利用最大似然法与贝叶斯法构建的分子系统进化树Fig. 2 Molecular phylogenetic trees of 35 Epinephelus fish based on TMO-4C4 sequences constructed by maximum likelihood and Bayesian inference method
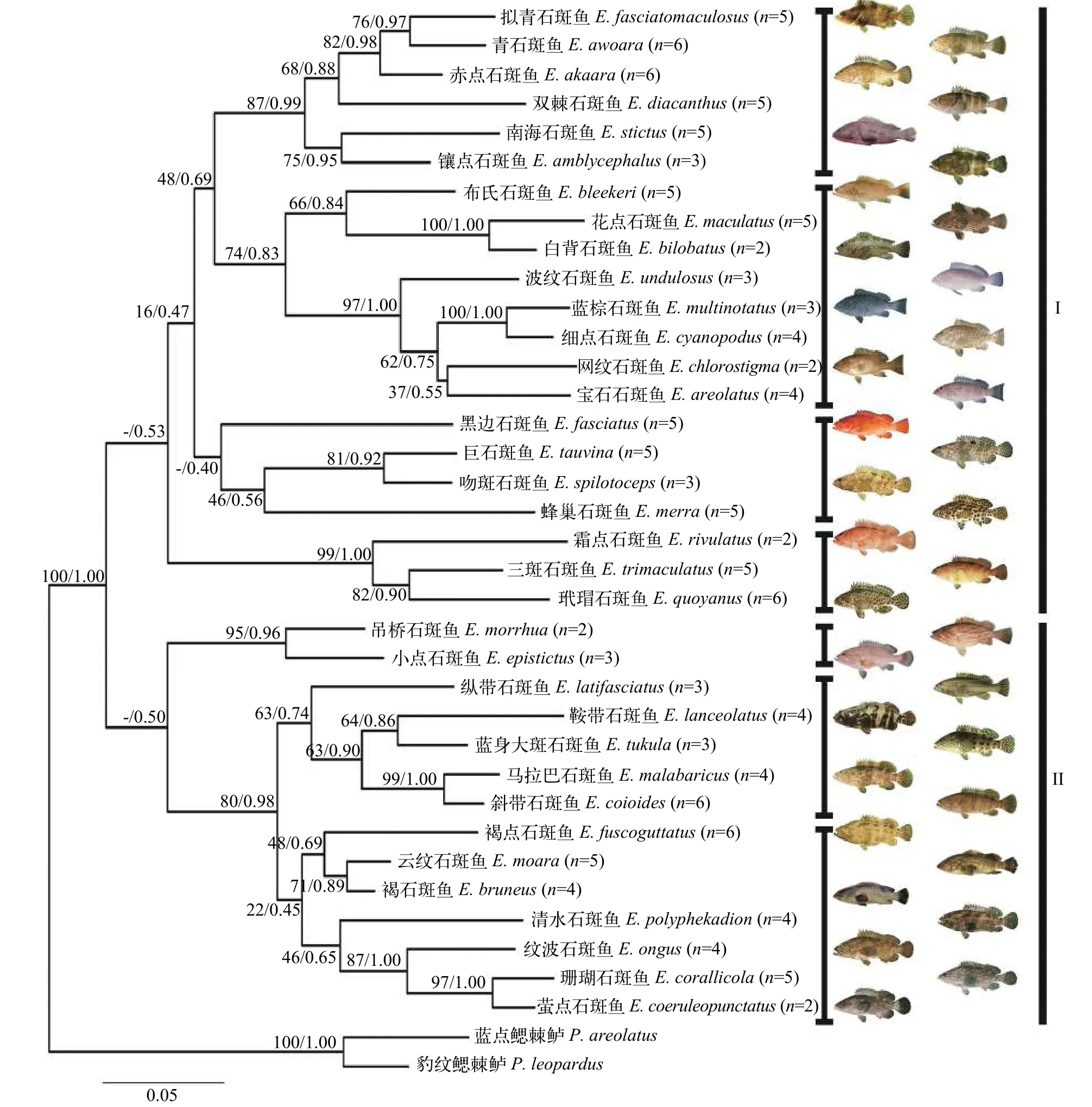
图3 基于COⅠ+TMO-4C4联合序列利用最大似然法与贝叶斯法构建的石斑鱼属35种鱼类分子系统进化树Fig. 3 Molecular phylogenetic trees of 35 Epinephelus fish based on COⅠ+TMO-4C4 combined sequences constructed by maximum likelihood and Bayesian inference method
3 讨论
3.1 COⅠ序列在石斑鱼属分类的可行性
前期研究表明,COⅠ基因在许多鱼类上已被验证可作为鉴定的标准DNA条形码序列, 可有效区分物种。目前在慈鲷科[27]、鲤科[28]、石首鱼科[29]、鲿科[30]和裂腹鱼亚科[31]等鱼类上均验证COⅠ基因可作为其物种识别标准序列。Hebert等[11]对11个门13320个物种的COⅠ基因分析得出物种内的COⅠ遗传距离基本小于2%。同时其提出, 利用COⅠ序列有效鉴定物种的关键是种间遗传距离必须大于种内遗传距离10倍以上。本研究的35种石斑鱼共142个个体样品中, 种内平均遗传距离为0.003, 种间平均遗传距离为0.143, 种间平均遗传距离是种内平均遗传距离的47倍, 远大于Hebert 等[11,12]提出的10倍差异值。另外, 石斑鱼属鱼类种内遗传距离为0.000—0.008, 均低于Hebert等[11]推荐的0.020(2%)作为物种鉴定最小遗传距离; 种间遗传距离为0.030—0.202, 均高于0.020(2%)的临界值, 辨析度清晰。可见COⅠ基因在石斑鱼属鱼类的分子系统分类上, 可作为有效的DNA条形码基因, 区分石斑鱼属内种间不同的物种。
3.2 基于DNA 条形码序列的石斑鱼属鱼类关系分析
石斑鱼属是石斑鱼亚科中种类最多的一个属,我国分布40余种[2—6], 本研究采集35种, 基本囊括目前我国分类资料有记载的常见代表种类, 具有一定代表性。基于COⅠ及TMO-4C4基因构建的ML系统进化树, 35种石斑鱼形成两个平行分支。这与丁少雄等[8]利用16S rRNA和庄轩等[9]利用Cytb构建的石斑鱼类分子系统进化结果一致。Schoelinck等[32]对分布印度-西太平洋石斑鱼亚科鱼类研究同样发现在石斑鱼属内存在2个分支。丁少雄等[8]在其西太平洋石斑鱼研究基础上结合东太平洋和大西洋石斑鱼16S rRNA数据联合分析发现, 石斑鱼属两大分支依然存在。其推测石斑鱼属共同祖先在演化初期先分化为两大支系, 两大支系种类再进一步种间分化并辐射分布于全球各海区。本研究基于COⅠ及TMO-4C4构建的进化树石斑鱼也形成两个分支, 聚类于两分支上的石斑鱼种类与前人研究基本一致[7,8,32], 结果也支持丁少雄等[8]关于石斑鱼系统演化的观点。
云纹石斑鱼(E. moara)与褐石斑鱼(E. bruneus)在前期分类研究中一直存在争议[1—3,33—36]。Heemstra等[1]编著的《Groupers of the World》认为两者是同种异名。Fishbase的鱼类名录中也仅记录褐石斑鱼(E. bruneus)的信息,E. moara为其同种异名[33]。而成庆泰等[2]所著《中国鱼类系统检索》中根据侧线孔鳞数目差异、前鳃盖骨隅角有大棘还是锯齿认为褐石斑鱼和云纹石斑鱼是两个不同物种。郭明兰等[34]比较了云纹石斑鱼与褐石斑鱼体表形态及骨骼系统, 发现两者存在显著差异, 认为云纹石斑鱼是区别于褐石斑鱼的有效种。Liu等[35]基于外部形态特征及内部构造, 结合线粒体全基因组序列比较分析云纹石斑鱼与褐石斑鱼的差异, 支持云纹石斑鱼是有效的物种。本研究测定分析了形态初步鉴定为云纹石斑鱼与褐石斑鱼的COⅠ序列差异,发现两者遗传距离为0.030, 大于 Hebert等[11]设定区分物种最小遗传距离2%。系统进化树上云纹石斑鱼与褐石斑鱼紧密聚为一支, 关系十分接近, 但两者种内不同个体均能聚成独立的物种单系分支, 没有交叉聚集在一起, 进化树的枝条长度也能有效把两种鱼区分, 因此本研究也支持前人研究的结果,认为云纹石斑鱼和褐石斑鱼是石斑鱼属2个独立的物种, 不是同种异名[34,35]。
斜带石斑鱼与马拉巴石斑鱼(也叫点带石斑鱼)在分类上也长期存在争议与混淆, 前期研究也存在把两种石斑鱼相互误鉴的情况[33,36,37]。《中国鱼类系统检索》[2]及《中国鱼类分类及分布名录》[6]仅有记载点带石斑鱼一种。而Heemstra等[1]根据幽门盲囊数的差异将斜带石斑鱼与马拉巴石斑鱼确定为2个种。沈世杰[2]主编的《台湾鱼类志》根据头部与体部是否有白斑, 胸鳍鳍条数差异将斜带石斑鱼与点带石斑鱼区分开。但由于两种鱼体表斑点与花纹过于相似, 目前许多资料对这两种石斑鱼依然存在误鉴, 在水产养殖生产中更是相互混淆, 存在混养与杂交的情况。本研究的斜带石斑鱼与马拉巴石斑鱼COⅠ基因遗传距离为0.036,大于Hebert等[11]设定的2%临界值, 遗传分化达到种间水平。在进化树上, 两者紧密聚成姐妹分支, 但种内不同个体依然形成独立的物种单系分支, 显示是独立的物种。
在系统进化树上, 部分石斑鱼以较高的支持率聚成紧密的姐妹分支, 如细点石斑鱼与蓝棕石斑鱼、白背石斑鱼与花点石斑鱼、吻斑石斑鱼与巨石斑鱼、萤点石斑鱼与珊瑚石斑鱼等。比较这些石斑鱼相互间形态特征, 在体型、斑纹和体色上均非常接近, 形态分类上也容易发生误鉴[1,33]。如细点石斑鱼与蓝棕石斑鱼身体均蓝色, 尾鳍截形, 主要区别是细点石斑鱼身体布满黑色细小斑点, 而蓝棕石斑鱼无此特征。在石斑鱼市场上两者均称为“蓝瓜子斑”, 容易混淆, 也存在用蓝棕石斑鱼冒充细点石斑鱼的现象。白背石斑鱼与花点石斑鱼斑纹异常相似, 两者体呈棕褐色, 身体密布有棱角褐色斑点,浅色部分构成了网状花纹, 背鳍基部均有黑白相间斑纹, 细微区别为白背石斑鱼背鳍基部有一条贯通的白色带, 而花点石斑鱼没有。吻斑石斑鱼与巨石斑鱼体色淡黄色, 背部存在多块深色暗斑, 身体与各鳍均密布棕色小斑点, 巨石斑鱼斑点偏圆形, 吻斑石斑鱼斑点偏多边形。萤点石斑鱼与珊瑚石斑鱼体灰褐色, 头部尖, 体型修长, 尾鳍圆形, 萤点石斑鱼身体具白色不规则圆斑, 珊瑚石斑鱼具黑色斑点。在分子水平上, 部分前人研究构建的石斑鱼亚科分子系统进化树也显示这些石斑鱼存在较近的亲缘关系, 进化树上也聚集在一起[28,39]。本研究中, 在COⅠ遗传距离上, 细点石斑鱼与蓝棕石斑鱼(0.044)、白背石斑鱼与花点石斑鱼(0.056)、吻斑石斑鱼与巨石斑鱼(0.046)、萤点石斑鱼与珊瑚石斑鱼(0.063)相互间的遗传距离也较小, 远低于石斑鱼属种间平均遗传距离(0.144), 表明许多石斑鱼进化过程中,外观表型进化与分子进化的趋势一致, 形态相似的种类其分子水平也接近。该结果可为揭示石斑鱼近缘物种分类关系, 澄清分类争议提供理论依据,针对形态相似的类群, 结合分子水平信息, 可更科学有效明晰石斑鱼属各物种间的分类关系。

