四川丘陵区水库浮游植物功能群季节演替特征及驱动因子
陶 敏 岳兴建 罗家林 郭 涛 王永明 刘 果 李 斌
(1. 内江师范学院, 生命科学学院, 内江 641112; 2. 长江上游鱼类资源保护与利用四川省重点实验室, 内江 641112)
浮游植物作为水生生态系统基础碳源的重要组成部分, 是水生生物食物链的基础环节, 促进了能量在食物链中的传递, 最终影响整个水域生态系统的稳定[1]。浮游植物种类组成、群落结构和生物量时空分布格局的变化既能反映水环境的变化[2],又能在很大程度上决定水域生态系统的结构和功能, 是指示水体富营养化程度和水质健康状况的重要指标[3], 尤其在饮用水源地和水产品产地等特殊水域中甚至关系着公共卫生与人类的健康[4,5]。因此, 在水生态研究中浮游植物常被用作评估水体健康状况的重要指示性生物类群[4]。
基于浮游植物分类的定性与定量研究是掌握其群落结构的变化趋势和生态功能的基础[6,7]。近年来, 功能类群分类法的提出为浮游植物群落生态学研究提供了一种新方法[8,9]。浮游植物功能类群分类法以浮游植物的功能性特征(包括生理、形态和生态特征)为基础, 将同一生境下共存的藻类归为一组, 同组内的浮游植物通常具有相同或相近的生态位及相似的环境适应性特征, 可以反映特定生境类型[8]。由Reynolds等[8]和Padisáketal等[9]确定的功能群(Functional Group, FG)是应用最广的功能类群分类标准。该标准是基于个体生态学的浮游植物功能类群划分, 能够与浮游植物群落演替过程有效结合, 最大限度地阐述浮游植物群落与水环境因子之间的动态关联, 可较好地预测群落生态功能的变化[5,10,11]。该方法将具有专门的适应特征或需求(如对营养水平、光照强度、水体交换速度等因子的需求、耐受性和敏感性)的浮游植物集群归为相同功能群[8], 目前共总结出39个群组, 分别命名为A、B、C、D、N、NA、P、MP、T、TC、TD、TB、S1、S2、SN、Z、X3、X2、X1、XPh、E、Y、F、G、J、K、H1、H2、U、Lo、LM、M、R、V、W1、W2、Ws、Wo和Q功能群[8,9]。目前该方法已作为林氏分类法的有力补充, 成为开展浮游植物群落演替研究的重要手段, 已被广泛应用于湖泊、水库和河流等多种水体的水生态系统研究中[12—21]。
1 材料与方法
1.1 研究区域概况
选取四川省东南丘陵地区10座代表性水库开展研究(图1)。该区域地处长江上游, 海拔274—900 m,属台状低山丘陵地形。气候类型为亚热带湿润季风气候, 冬暖夏热, 年降雨量约1000 mm, 多分布在夏秋季[22]。10座水库中有中型水库5座和小型水库5座, 大坝坐标范围29°20′02″N—29°54′51″N,104°37′12″—105°15′42″E, 总库容1.7×105—7.58×107m3。按面积与形状, 在每个水库中设置1—5个采样点, 于2016年8月(夏)、2016年11月(秋), 2017年2月(冬)和2017年5月(春)分季节开展采样工作。
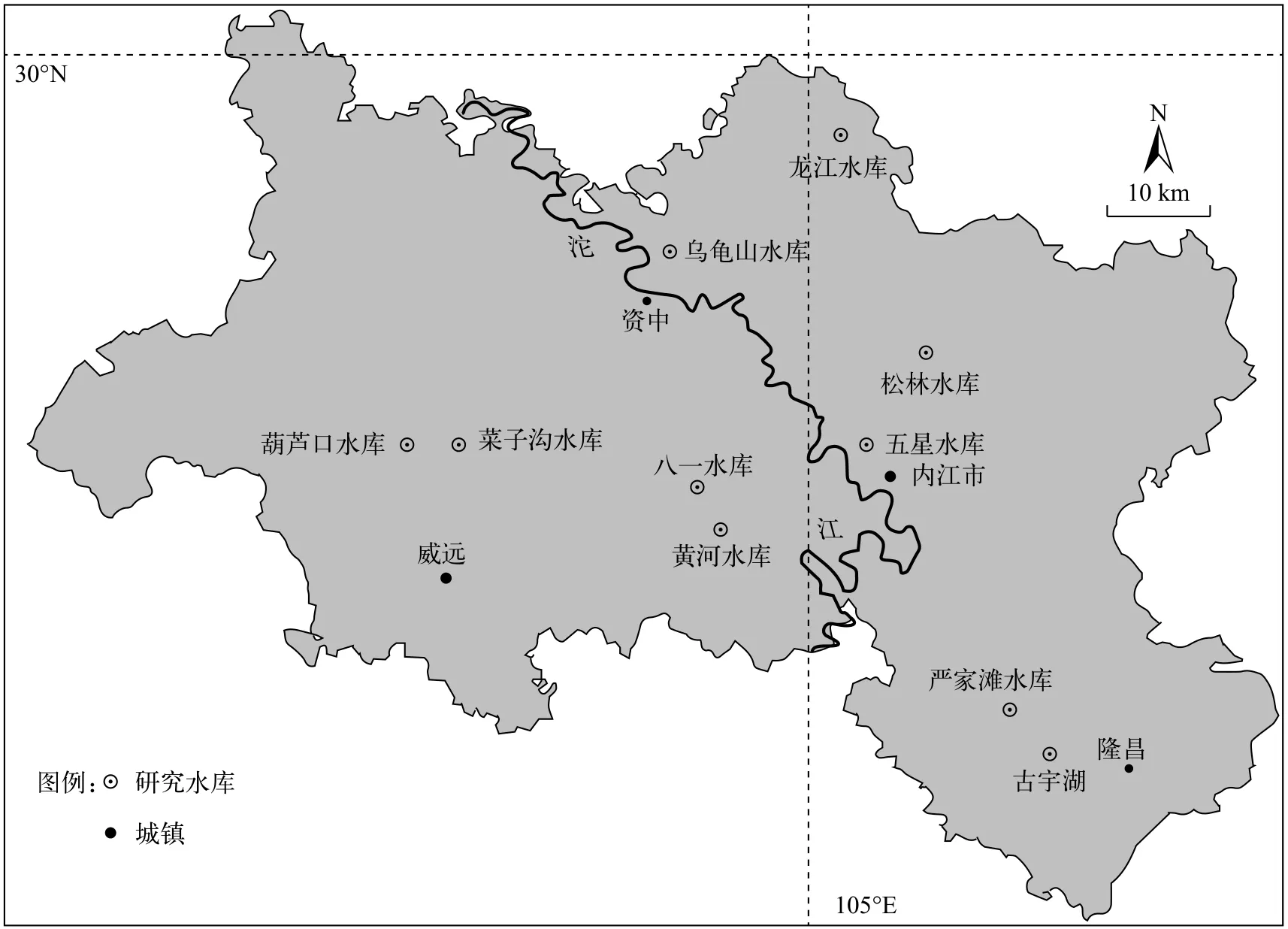
图1 研究水库地理分布Fig. 1 Spatial distribution of surveyed reservoirs
1.2 浮游植物样品采集与分析
用5 L采水器采集表层(水下0.5 m)水样1 L, 并立即加入1.5 mL浓缩鲁哥试剂现场固定, 避光带回实验室后重力沉降48h, 虹吸掉上清液后浓缩至30—50 mL, 并加入甲醛溶液数滴, 留作浮游植物定量观测。用25号浮游生物网(0.064 mm)在水面下0.5 m作“∞”字形捞取, 将网底管中的滤液收集起来现场加入4%甲醛固定, 留作浮游植物定性观测。浮游植物种类鉴定与计数方法参照相关文献[24,25]。在林氏分类的基础上, 按照不同种属浮游植物在FG功能群系统39个功能群(包括A、B、C、D、N、NA、P、MP、T、TC、TD、TB、S1、S2、SN、Z、X3、X2、X1、XPh、E、Y、F、G、J、K、H1、H2、U、Lo、LM、M、R、V、W1、W2、Ws、Wo和Q)中的归属, 进行浮游植物功能类群划分[5,8,9,19,26]。
1.3 理化指标的分析测定
采样点透明度(Secchi depth, SD)、水温(Water temperature, WT)、pH、溶解氧(DO)和氧化还原电位(ORP)等理化指标使用塞氏盘、便携式溶解氧测量仪(YSI-550A)和便携式pH计(METTLER TOLEDO Seven2Go)等设备进行原位测定。总氮(TN)、氨氮(NH4-N)、硝酸盐氮(NO3-N)、亚硝酸盐氮(NO2-N)、总磷(TP)、正磷酸盐(PO4-P)、高锰酸盐指数(CODMn)和叶绿素a(Chl.a)等指标的样品采集与测定参考相关文献[27]在实验室中进行。
1.4 数据分析
浮游植物功能群优势度分析优势功能群以Mcnaughton优势度指数(Y)值进行鉴别[19]:
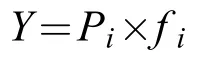
式中,Pi为第i种功能群丰度与样品中浮游植物种总丰度的比值(ni/N),fi为第i功能群在各采样点出现的频度。Y≥0.02[19]的功能群为优势功能群。选择优势功能群进行下一步的排序分析。
排序分析采用Canoco for Windows 4.5 软件对功能群数据和环境数据进行排序分析。浮游植物功能群矩阵经过lg(x+1)转换, 环境因子数据除ORP数据做lg[–(x+1)]转换外, 其他全部进行lg(x+1)转换[19]。首先进行去趋势对应分析(DCA)选择合适的排序和分析方法, 根据分析结果, 选择冗余分析(RDA)或典范对应分析(CCA), 以逐步迭代的方式筛选出有显著解释性的环境因子, 以揭示显著环境因子对优势浮游植物功能群的影响。单因素方差分析(One-way ANOVA)在SPSS 13.0中完成, 其他图表制作则通过Excel 2007进行。
2 结果
2.1 研究水库环境因子动态
表1显示了10个水库主要环境因子的变化情况。水温(WT)变化为12.8—34.2℃, 夏季最高, 冬季最低; 透明度变化幅度较大, 分布在35—370 cm, 秋季普遍较高。叶绿素a(Chl.a)含量春季稍低; 水体在调查期间基本呈弱碱性, 夏季稍高, 秋季稍低, 溶解氧(DO)与pH季节变化基本一致; 总氮(TN)、总磷(TP)和高锰酸盐指数(CODMn)均表现出冬季枯水期最高的趋势, 但最低出现时间不一致, 其中TN在夏季最低, TP和CODMn则在春季含量低于其他三季。
由图6可知,使用平均粒径为75 μm石英粉为原料合成的硬硅钙石纤维体积密度为73.5 kg/m3;随着石英粉粒度的减小,合成的硬硅钙石纤维体积密度逐渐降低,当石英粉平均粒径为23 μm时,硬硅钙石纤维体积密度最低仅为70.4 kg/m3。石英粉粒度继续减小时,合成的硬硅钙石纤维体积密度也随之增大,石英粉平均粒径为18 μm时合成的硬硅钙石纤维体积密度增大至79.5 kg/m3。由此可见,本试验中较适宜的石英粉平均粒径为23 μm。
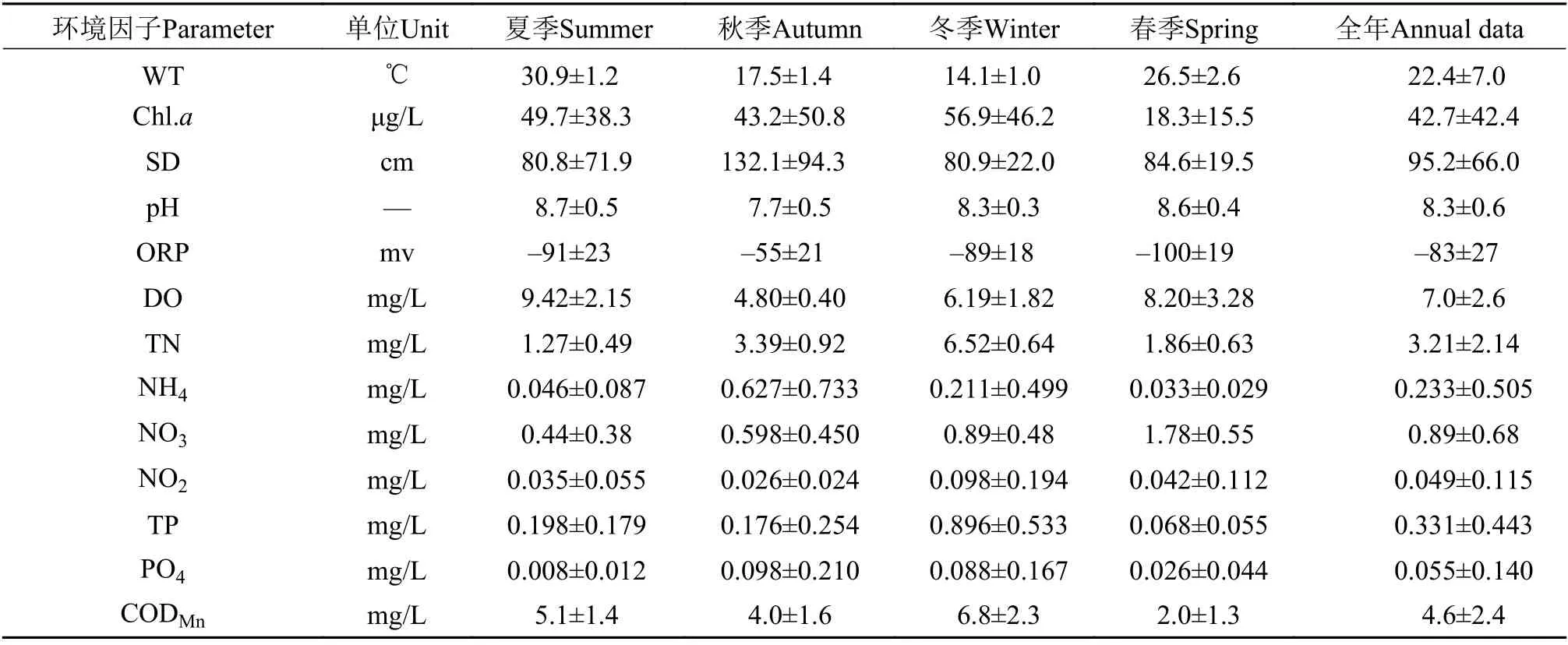
表1 四川丘陵水库环境因子季节变化Tab. 1 Seasonal variations of environmental factors in studied reservoirs (Mean±SD)
2.2 研究水库浮游植物功能群组成
浮游植物种类组成与功能群划分调查期间共检出浮游植物9门104属188种, 其中绿藻门出现的种类最多为48属84种, 占44.7%, 其次为硅藻门(15属35种, 占18.6%)和蓝藻门(19属34种, 占18.1%)。其余门类种类数均较少, 包括裸藻门5属12种, 金藻门8属10种, 甲藻门4属7种, 隐藻门2属4种, 种类数最少的黄藻门和定鞭藻门, 均只出现1属1种。根据功能群分类法, 研究水库中共出现24个功能群, 分别为B、C、D、E、F、G、H1、J、K、LO、M、MP、N、P、S1、S2、SN、T、TC、W1、W2、X1、X2和Y(表2)。
浮游植物优势功能群及分布特征从全年来看(表2和图2), 各功能群出现频率范围为5.6%—100%; 根据优势度指数计算结果, 全年Y>0.02的功能群有6个, 按优势度指数高低依次为S1、TC、SN、S2、LO和J, 其年均丰度范围为2.12×106—6.28×107cells/L, 与优势度指数分布一致。
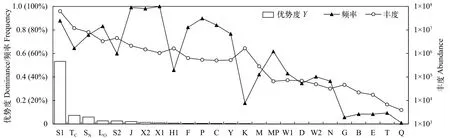
图2 全年浮游植物各功能群优势度、频率及丰度Fig. 2 Dominance index, frequency and abundance of phytoplankton functional groups in studied reservoirs

表2 四川丘陵水库浮游植物功能群划分Tab. 2 Functional classification of phytoplankton in studied reservoirs
从四季来看, 优势度指数与平均丰度之间均表现出良好的一致性, 其中夏季各功能群出现频率范围为3.4%—100%, 优势功能群依次为S1+TC+SN+LO+S2, 平均丰度7.64×106—1.84×108cells/L; 秋季各功能群出现频率为3.6%—100%, 依次为S1+S2+J+SN+X1+LO+X2, 平均丰度1.69×106—3.18×107cells/L, 夏季优势类群中的TC被J、X1和X2所替代; 冬季各功能群出现频率为3.8%—100%, 依次为S1+X2+C+X1+J+Y, 平均丰度6.12×105—1.28×107cells/L,秋季优势功能群中的S2、SN和LO被C和Y所替代;春季各功能群出现频率为4.2%—100%, 依次为S1+SN+H1+J+X1+X2, 平均丰度4.30×105—6.08×106cells/L, 冬季优势功能群中的C和Y被SN和H1所替代(图3)。S1功能群在4个季节中均占优势, 是绝对的优势类群; J、X1和X2在除夏季以外的3个季节占优势, SN在除冬季以外的3个季节中占优势, 为次优势类群。
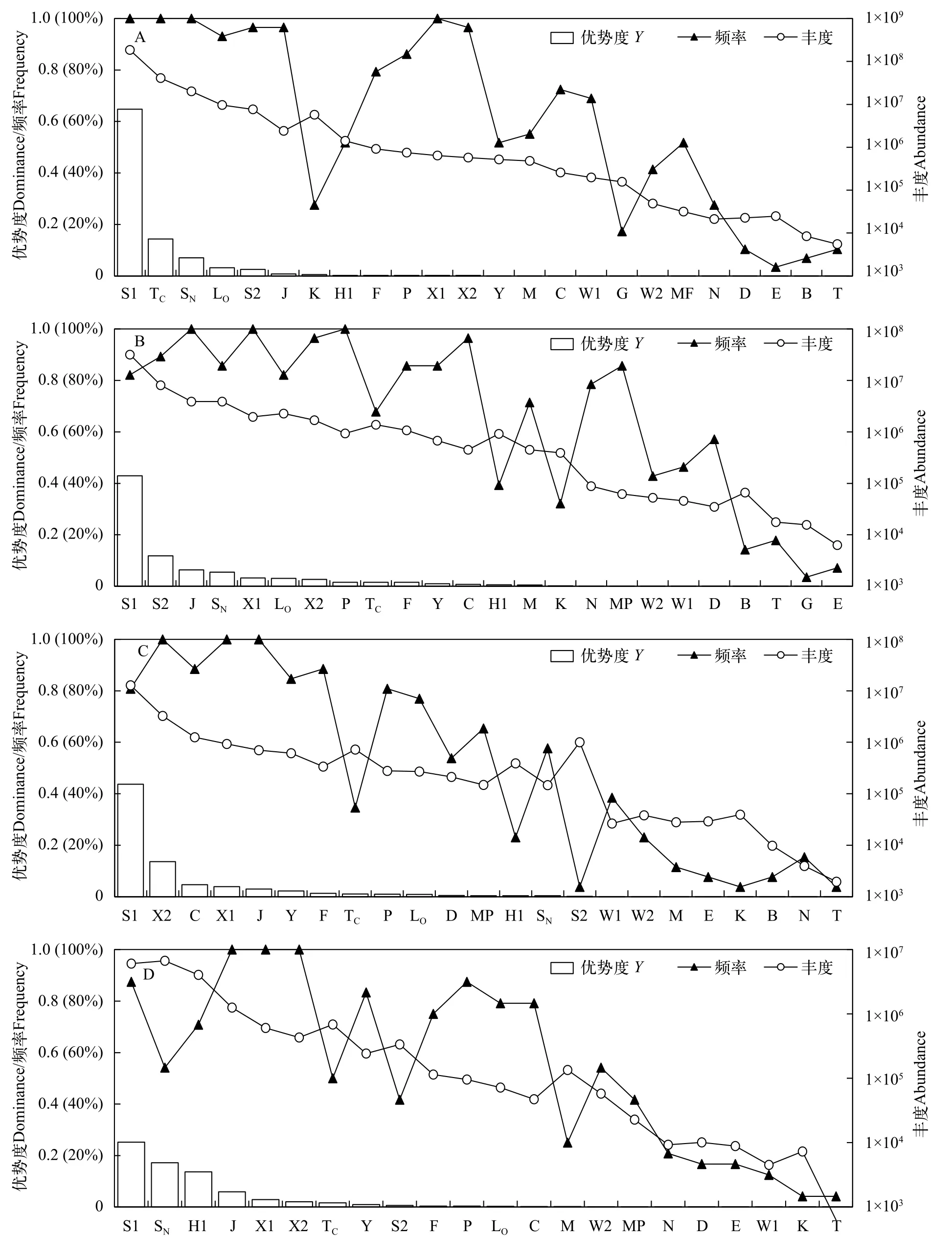
图3 四季浮游植物各功能群优势度、频率及丰度Fig. 3 Dominance index, frequency and abundance of phytoplankton functional groups for each season
从浮游植物组成比例的季节变化来看, 全年以S1功能群丰度占比最高, 达60.6%, 6个优势功能群总丰度为9.47×107cells/L, 占浮游植物总丰度的91.3%。夏、秋和冬季3个季节也均以S1功能群丰度占比最高, 分别占64.8%、52.1%和53.8%; 春季有所变化, 以SN功能群(31.7%)占比最高, 其次才是S1功能群(28.8%; 图4)。四季优势功能群总丰度分别为2.70×108、5.36×107、1.97×107和1.91×107cells/L, 占当季浮游植物总丰度的95.0%、87.8%、82.1%和90.5%。

图4 浮游植物群落组成与优势功能群总丰度Fig. 4 Relative abundance and total abundance of phytoplankton functional groups for each season
2.3 环境因子对浮游植物群落季节演替的影响
单因素方差分析(One-way ANOVA)结果显示,四季间浮游植物功能群组成差异显著(P=0.019,F=3.674,df=3)。各功能群季节变化较为明显: S1、TC、SN和LO等功能群大致呈现出从夏季到春季丰度减少的趋势, J、X1和S2在秋季取得最高值,H1和X2则在冬季最高。
物种组成的DCA分析结果显示, 线性模型RDA更适合本研究数据。根据RDA分析的结果, 全年环境因子第一轴解释了浮游植物群落变化的33.0%, 第二轴解释了3%(表3)。与轴1相关性较强的因子有NO3-N和NO2-N, 均为正相关; 与环境因子第二轴相关性较强的ORP、TP和DO等, 为正相关。物种箭头主要集中在第三象限和第四象限; 对于优势度最大的S1功能群来说, CODMn、Chl.a和DO与之正相关最显著, 无机离子则与之明显负关联。总的来说, 优势功能群主要与NO3-N、NO2-N和PO4-P等无机离子呈较显著的负相关关系, 与CODMn、Chl.a和DO等呈正相关; TP和ORP仅对J和S2功能群有较明显的作用, 呈负相关(图5)。从样点的分布来看, 夏季样点主要分布在第四象限, 秋季主要分布于二、三象限, 冬季和春季则主要分布在第一象限, 说明冬季和春季浮游植物对环境的需求较为接近, 与夏、秋季需求差异较大。
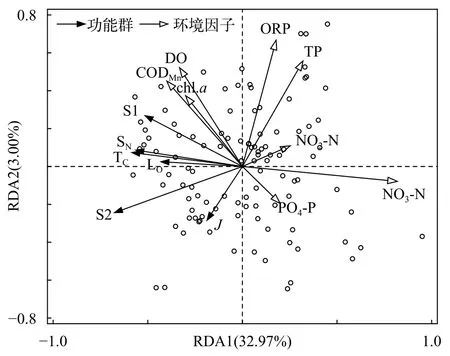
图5 研究水库全年浮游植物优势功能群与主要环境因子的RDA 分析Fig. 5 Redundancy analysis of functional groups of phytoplankton in studied reservoirs
从四季分析结果来看, 夏季5个优势功能群除LO外均分布在第四象限, 较为集中, 环境因子第一轴解释了29.1%的浮游植物群落变化, 环境因子第二轴解释了19.3%的变化(表3)。S1、TC、S2和SN功能群均与TP、CODMn和Chl.a正相关最为显著,与SD负相关最强。LO功能群则与TP、CODMn、Chl.a和SD关联很弱, 更多的受到TN、NO2-N和PO4-P等指标的正向作用; DO则与S1和LO的正向关联性最强(图6A)。秋季环境因子第一轴解释了72.4%的浮游植物群落变化, 环境因子第二轴解释了8.1%的变化(表3); 7个优势功能群均与SD和NO3-N显著负相关; 与夏季情况类似, 除LO和J以外,其余5类(S1、S2、X1、X2和SN)分布极为靠近, 与Chl.a、NH4-N、NO2-N和pH显著正相关, J和LO则更多的受到TN和CODMn的正向作用(图6B)。冬季环境因子第一轴解释了43.6%的浮游植物群落变化, 环境因子第二轴解释了14.9%的变化(表3);S1、X1、X2、J和Y均分布在第四象限, 较为集中,与SD负关联显著, 与WT、ORP、pH、Chl.a、TN、TP和CODMn等正相关, 与离子状态的营养盐和DO等关联性不大。C功能群独自分布在第四象限,仅与离子状态的营养盐和DO显著负相关(图6C)。春季环境因子第一轴解释了49.5%的浮游植物群落变化, 环境因子第二轴解释了21.0%的变化(表3);H1和S1位于第四象限, 与DO和CODMn正相关, 与氮磷指标显著负相关; SN和X2之间夹角很小, 集中在第三象限, 与WT正相关显著, 与氮磷营养指标负相关; J与X1之间夹角较小, 与Chl.a正相关显著, 与SD、pH和ORP呈现较为明显的负相关关系(图6D)。S1功能群在4个季节中均占优势, 但在不同季节中的主要影响因子有所不同: 夏季与磷(包括TP和PO4-P)正相关, 与SD负相关; 秋季与多数氮磷营养正相关, 与SD和NO3-N负相关; 冬季和春季均与WT正相关, 与离子态营养盐负相关(图6), 说明冬季和春季浮游植物对环境的需求较为接近, 这与全年样点分布情况结果一致。
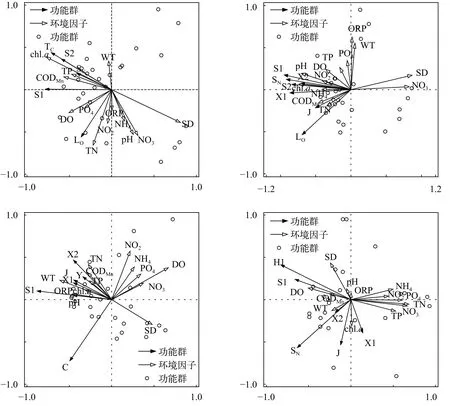
图6 研究水库不同季节浮游藻类优势功能群与主要环境因子的 RDA 分析Fig. 6 RDA analysis of phytoplankton functional groups in different seasons in studied reservoirs
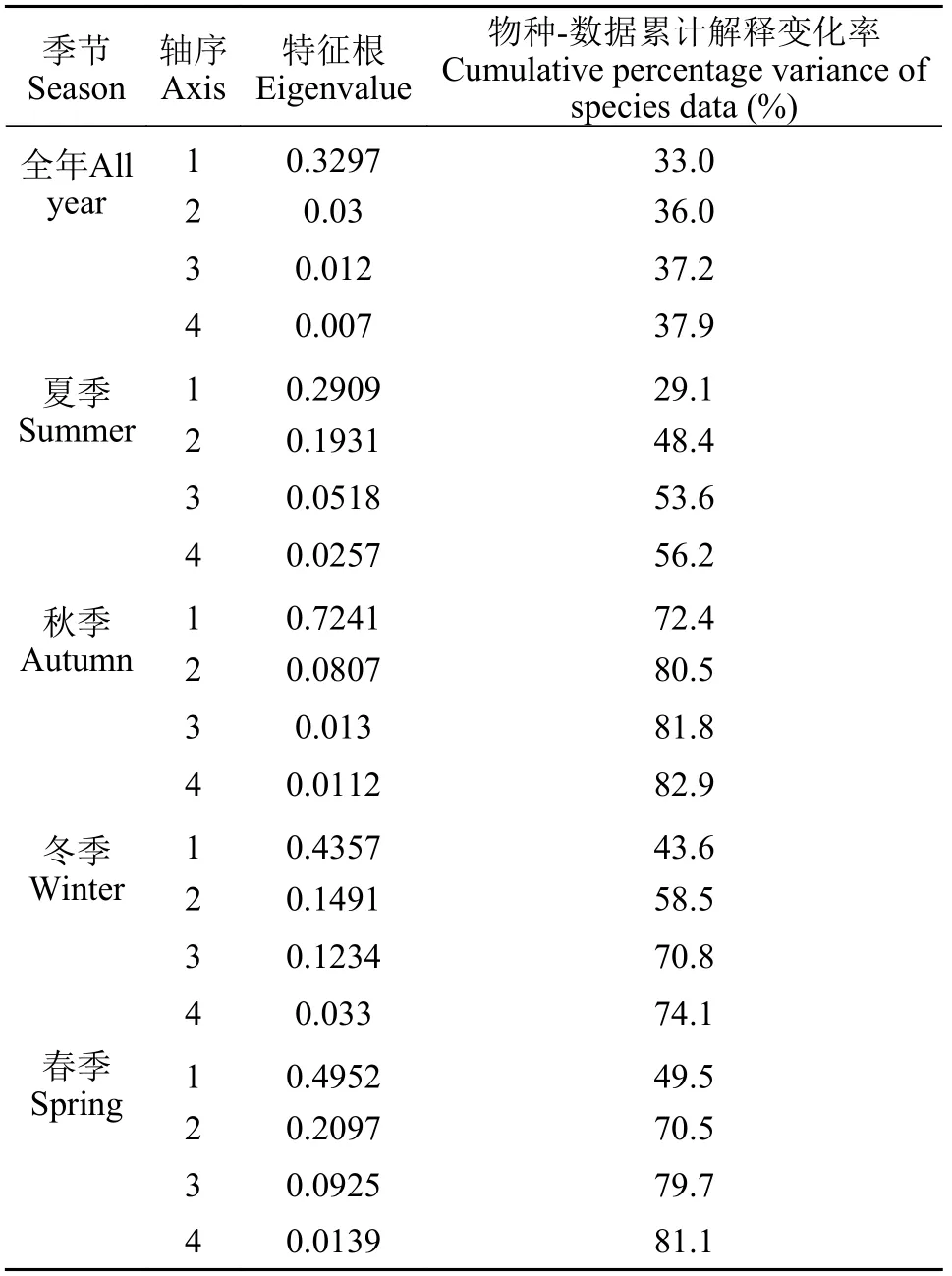
表3 浮游植物功能群与环境因子的冗余分析(RDA)统计特征Tab. 3 Statistical characteristics of redundant analysis (RDA) of phytoplankton functional groups and environmental factors
结合优势功能群的季节演替(图3), 从夏季到秋季出现了TC与J、X1和X2之间的演替, 其中夏季TC与TP、CODMn和Chl.a呈正相关, 与SD呈负相关;秋季X1和X2与Chl.a、NH4-N、NO2-N和pH显著正相关, J则受到TN和CODMn的正向作用。秋季到冬季出现了S2、SN和Lo被C和Y所替代的现象, 其中秋季S2和SN与Chl.a、NH4-N、NO2-N和pH显著正相关, LO则与TN和CODMn显著正相关; 冬季C仅与离子状态的营养盐和DO显著负相关, Y则与SD负相关, 与WT、ORP、pH、Chl.a、TN、TP和CODMn等正相关。从冬季到春季, C和Y被SN和H1所替代, H1与DO和CODMn正相关, SN则与WT正相关, 二者均与氮磷指标呈负相关。
3 讨论
3.1 四川丘陵水库浮游植物功能群的季节演替特征
尽管在不同类型的水体中浮游植物群落结构特征各不相同, 但通常均表现出较为明显的季节变化[28,29], 其演替是多种环境因子在时空上综合作用的结果[30]。
四川丘陵区中小型水库中全年优势功能群为S1、TC、SN、S2、LO和J。研究水域表现出高营养、较少分层和水体透明度不高等功能群生境特征, 该结果也得到了理化数据的支持(表1)。从全年来看, S1是4个季节的优势功能类群, 其次为SN(夏、秋、春)、J(秋、冬、春)、X1(秋、冬、春)和X2(秋、冬、春)在3个季节均占优势。研究发现S1和SN功能群代表种类主要为丝状蓝藻, 其喜好较高的营养, 对低光照耐受力强[8], 而四川丘陵地区水域夏季雨量丰富, 地表径流导致水体营养丰富,加上闷热弱光天气等因素[17,18], 促进了上述2个功能群的大量增殖。该结果与热带和亚热带地区分布的其他水库[13]和河流[31]中的情况类似。值得注意的是, 本研究6个全年优势功能群中, 优势度最大的前4个功能群代表物种全部为蓝藻(表2), 它们喜好高营养环境, 对不同的光照环境各有适应机制[8,18,32],占据着该地区水库的大部分生态空间。
秋季优势功能群组成为S1+S2+J+SN+X1+LO+X2,相对于夏季减少了TC, 增加了X1、X2和J。TC在本研究中的代表为颤藻和鞘丝藻, 为丝状蓝藻, 喜好高温和高营养的静止环境[9], 研究区域秋季水温和水文情势的变化(表1)破坏了其喜好的生境条件,可能导致其优势度降低。X1和X2的典型代表多为C生长策略(竞争型)的小型绿藻[5,16], 一旦营养与水温合适就会迅速繁殖占据生境[17,19], 但这类小型绿藻, 特别是X1对滤食敏感[26]。分析研究区域X1和X2夏季生物量相对较低的可能原因: 首先, 夏季浮游动物生物量显著增加限制了X1和X2生物量的发展; 其次调查水域鱼类以滤食性鲢Hypophthalmich-thys molitrix、鳙Hypophthalmichthys nobilis为优势类群, 夏季鲢和鳙生长速度快, 摄食强度大, 调控了X1和X2的生物量。J功能群为不能运动的无胶质的绿藻, 典型代表栅藻和四角藻等, 喜好光照较低的高营养水体[8], 容易在温度不太高、阳光较温和的季节, 如春秋和冬季占优势地位[19]。
冬季优势组成为S1+X2+C+X1+J+Y, 与秋季相比, 少了S2、SN和LO, 增加了C和Y。S2、SN和喜好较高水温[5,8], 冬季水温的降低(表1)打破了2个类群的优势地位; LO耐分层, 对混合敏感[5,18], 冬季水库水温层解除, 进入完全混合状态[33—35], 上下水层的混合导致环境不再适宜于LO, 而这样的混合和低光的环境恰好对以梅尼小环藻为代表的C功能群有利[8]。Y功能群以隐藻和真蓝裸甲藻等为代表, 喜好牧食强度低的所有静水水体[8], 冬季水温降低, 鱼类与浮游动物活动减弱, 摄食强度降低, 为Y的繁衍提供了良好的生物环境, 最终导致了C和Y对S2、SN和LO的替代。
春季优势组成为S1+SN+H1+J+X1+X2, SN和H1取代了冬季C和Y的优势地位。春季水温分层开始发育, 底质中营养物质向水柱中输送减少[33,36],再加上较冬季为多的降水稀释作用[22], 导致营养水平的降低; 同时随着水温增加浮游动物数量与活性增强, 环境对C和Y不再有利, 而更为适合喜好分层与低营养环境的SN和H1[8]。
从四季的演替可以看出, 夏季的优势功能群全部以蓝藻为代表, 秋季绿藻优势有所加大, 冬季硅藻、隐藻和甲藻数量增多, 到了春季又恢复到秋季蓝藻+绿藻的优势模式。丝状蓝藻(包括S1、S2、SN、TC和H1)在季节间有所更替, 但优势从未丢失。
3.2 环境因子对浮游植物群落季节演替的影响
从全年来看, 优势功能群主要与氮磷无机离子负相关。浮游植物光合作用不断吸收水中的可利用氮磷, 包括NO3-N、NO2-N和PO4-P等[37], 导致这些无机离子浓度随着优势功能群丰度的增加而不断降低。优势功能群均与CODMn、Chl.a和DO等呈显著正相关, 尤其是绝对优势功能群S1, 说明本研究中水体主要初级生产者为浮游植物, 特别是以S1功能群为代表的优势功能群, 是水域中有机物、叶绿素和溶氧的主要贡献者, 其他类似研究[19]也支持了该结论。
从夏季到秋季出现了TC与J、X1和X2之间的演替, 其中TC与WT等因子正相关; X1、X2与J则与TN等因子的正相关。随着秋季水温的降低, 滤食性动物活性也随之降低, 以喜好高温的丝状蓝藻为典型代表的TC逐渐失去其优势地位, X1与X2的优势逐渐显现, 同时秋季较低的光照条件对喜低光的J的扩繁也有利。研究水域夏季丰水期降雨较集中水量较大, 秋季平水期水位降低[22], TN浓度增大,更加适合X1、X2与J的生长繁殖。
秋季到冬季出现了S2、SN和LO被C和Y所替代的现象, 这5个功能群均对低光生境有较强的耐受性[8]。其中S2和SN与LO和NH4-N等因子正相关,Y与TP、TN和CODMn等正相关。一般NH4-N在溶氧充足的条件下, 会被好氧菌氧化[38], 冬季水温较低, 微生物耗氧较少, 溶氧相对充足, 再加之降水少水体交换缓慢, 对硝化作用有利[38], 从而导致冬季NH4-N浓度的降低。研究发现氮源中NH4-N比例的升高有利于增强蓝藻的竞争优势[39,40], 而NO3-N的升高会导致蓝藻被其他藻类替代[41]。本研究中的S2、SN和LO以棒胶藻、螺旋藻和平裂藻等非固氮蓝藻为典型代表, 随着秋季到冬季NH4-N浓度的降低与NO3-N的升高而逐渐失去优势地位。同时, 从秋季到冬季, 水库经历了从分层到循环的过程[33—35],底质向水柱中输送氮磷的量加大, 同时冬季枯水期水位进一步下降, 导致水体中营养物质浓度进一步加大, 如TN、TP、CODMn和NO3-N都呈现出不同程度的升高(表1), 促进了Y的增长。
从冬季到春季, C和Y被SN和H1所替代, 其中H1与SD等正相关, SN则与WT等正相关, 二者均与氮磷指标呈负相关。进入春季, 水体分层逐渐开始形成[33—35], 水温回升, 滤食性动物活动加强, 同时由于春季降水造成的稀释作用, 水体中营养水平降低,喜好高CODMn和高TN的Y功能群优势被削减, 而耐低营养, 尤其是耐低氮的H1和SN则更具有优势[8]。春季光照条件与水体透明度的提升(表1), 也加大了喜好较强光照的H1的优势度。
从不同季节影响丝状蓝藻分布的关键因子来看, 夏季S1、S2、TC和SN与TP正相关, LO与TN和PO4-P正相关; 秋季S1和S2与无机氮离子正相关,LO与TN和CODMn正相关; 冬季S1与WT、TN、TP和CODMn正相关; 春季S1、H1与CODMn正相关,SN则与WT正相关。尽管各季节优势丝状蓝藻种类有所区别, 各因子作用大小也有所不同, 但其现存量均表现出随营养水平和水温的升高而增加的趋势。目前该地区水库氮磷营养水平已经较高(表1),如不加强水质管理, 丝状蓝藻的数量可能会在高营养水平与全球气候变暖的双重促进下逐年增加, 以致于暴发水华, 严重威胁该地区生活与生产的安全[42]。
4 结论
(1)对四川丘陵地区10个中小型水库进行的周年调查显示, 该地区水库中共有24个功能群, 其中全年Y>0.02的功能群有6个, 按优势度指数高低依次为S1、TC、SN、S2、LO和J。不同季节优势功能群存在明显差异, S1在四季均占优势, 为绝对优势功能群。(2)根据功能群生境特征, 研究水域表现出高营养、较少分层和水体透明度较低等特点。季节间水库分层的形成与打破, 及水体光照条件、牧食强度和营养水平等的变化, 导致了该地区水库浮游植物功能群之间的此消彼长。(3)研究水域浮游植物功能群的季节演替受主要受到WT、TN、TP、NH4-N、NO3-N、CODMn和SD的影响。尽管各季节优势丝状蓝藻种类有所区别, 各因子作用大小也有所不同, 但其现存量均表现出随营养水平和水温的升高而增加的趋势。

