基于响应面优化大麦若叶粉中总黄酮超声波提取工艺研究
卢健新,袁学文,蔡文韬,冯丽娜
(广东第二师范学院生物与食品工程学院,广东广州510303)
0 引言
大麦是禾本科一年生草本植物,其幼苗富含多种营养物质,如维生素、类黄酮、抗氧化酶、蛋白质、叶绿素等[1]。大麦苗在其生长期可以吸收外源性的营养成分,如氨基葡萄糖、羟脯氨酸等[2]。国外的研究表明,大麦不仅是中东、非洲北部、亚洲和欧洲等地区主要的粮食作物,也是利用最频繁及抗性最强的禾谷类作物,在预防和医治人类部分慢性疾病方面有显著效果。大麦的这些功能一开始并未得到人们的关注,直到近50年,随着现代科技的更新发展,大麦若叶才逐步进入广大研究者及消费者的视线。
生物总黄酮也叫黄酮类化合物,是许多中草药的有效成分,而黄酮类化合物是大麦若叶的活性成分之一。提取植物体内总黄酮的方法较多,考虑到学校的实验室情况,以及超声波法操作较简单、提取物质结构不易被破坏的特点,试验采用超声波来协助提取大麦若叶粉中的总黄酮。
相关研究发现,大麦若叶的功效主要集中在5个方面:①清理体内毒素,降低血液中的甘油三脂和胆固醇含量;②减缓肥胖症状;③抗氧化、抗抑郁[3-4];④舒缓疲劳、强健体质、改善睡眠、提高免疫力并加快伤口愈合;⑤养护胃肠道功能,减弱酒精对胃黏膜的损伤[5-6]。大麦苗提取物的气味还能激活人体自主神经,从而影响副交感神经的活动[7]。大麦苗具备这些保健功效极有可能与其含有较多的抗氧 化 酶 类[8]、叶 绿 素[9]、γ-氨 基 丁 酸[10-13]、黄 酮 类O-葡萄糖异牡荆苷等物质有关[14-15]。
早在公元前4世纪,西方一个名为Hippocrates的医学家也曾经用大麦若叶汁来医治人们血液或肝脏疾病[16]。目前,大麦叶制品已经被日本卫生协会认定为健康食品。美国也正式批准了将麦绿素作为食品补充剂。而在我国,1994年生物化学博士徐新月从美国首次将麦绿素概念引入中国,自此我国开始真正对大麦苗产品展开研究。随着“大麦若叶热”的传播,我国不少企业通过不同加工方式制得多种大麦苗产品[17]。21世纪以来,国内越来越多研究者开始对大麦苗粉展开研究,研究人员陆续发现黄酮类化合物具有预防肝损伤、抗氧化、降血脂、降血糖及提高机体免疫力等多项生理功能。杨立红等人[18]在对小鼠进行试验后,得出大麦苗具有抗疲劳、增强耐力的结论。黄薇等人[19]发现用大麦若叶进行膳食指导能缓解痛风患者的疼痛和焦虑感。
研究旨在通过超声波提取法对市面上的一种大麦若叶粉的总黄酮进行提取和测定,并通过设计响应面试验来优化该种大麦若叶粉总黄酮的提取工艺条件,从而得到最佳提取工艺参数,可以进一步加深人们对近年来“大麦若叶热”的认识,同时对更深入地了解其功能有着重大作用。
1 材料与方法
1.1 材料与试剂
试验所用的大麦若叶粉是把新鲜的大麦若叶苗用水清洗、干燥、气流粉碎后制成的纯粉末,由浙江省绍兴市上虞万事达麦业有限公司生产。
芦丁标准品,中国食品药品检定研究所提供;75%乙醇;95%乙醇;亚硝酸钠、硝酸铝、氢氧化钠。所有试剂均为分析纯。
1.2 仪器与设备
台式超声波清洗器、科盟牌超声波清洗机;紫外-可见分光光度计,上海精科实业有限公司产品;低速台式离心机,上海安亭科学仪器厂产品;电子天平,常州市衡正电子仪器有限公司产品;10 mL,25 mL容量瓶,锥形瓶、试管、玻璃棒、胶头滴管、洗耳球、离心管、烧杯;称量纸、10 mL,2 mL,1 mL移液管等。
1.3 试验方法
1.3.1 芦丁标准曲线绘制
芦丁标准溶液制备及吸光值测定的具体操作参考文献[20]。
1.3.2 大麦若叶粉总黄酮提取率的测定公式
芦丁标准曲线回归方程为A=12.879C-0.141 3(R2=0.999),其中C为供试品总黄酮质量浓度(mg/mL),A为吸光值。将吸光值代入标准曲线可得总黄酮的质量浓度C,黄酮提取率计算公式见下式:
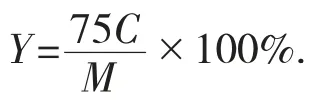
式中:Y——样品中总黄酮提取量,mg/g;
M——样品质量,g;
C——供试品总黄酮质量浓度,mg/mL。
1.3.3 超声波辅助提取大麦若叶粉黄酮类化合物的工艺流程
(1)样品提取液的制备。取1 g大麦若叶粉末,加入10 mL 75%乙醇浸泡2 h后,在45℃、40 kHz下超声处理40 min,冷却至室温,调节离心机以转速1 000 r/min离心10 min,取上清液,用体积分数75%的乙醇定容至15 mL。
(2)供试品溶液的制备。精确吸取步骤(1)中制备的样品溶液2.0 mL,置于10 mL容量瓶中加入适量体积分数75%乙醇溶液定容至10 mL,摇匀即得到供试品溶液。
(3)供试品含量测定。精确吸取步骤(2)中制备的供试品溶液5.0 mL,置于10 mL容量瓶中,采用亚硝酸钠-硝酸铝-氢氧化钠比色法,测得吸光度值,记录数据。
1.3.4 超声波辅助提取大麦若叶粉总黄酮单因素试验
考查提取温度(35,45,55,65,75℃)、提取时间(30,40,50,60,70 min)、乙醇浸泡时间(30,60,90,120,150 min)、乙 醇 体 积 分 数(55%,65%,75%,85%,95%)、料液比(1∶10,1∶15,1∶20,1∶25,1∶30)对大麦若叶粉总黄酮提取量的影响。
1.3.5 响应面试验设计
依据单因素试验结果,综合考虑现实条件及资源节约原则,选取超声波提取温度、超声波提取时间、乙醇浸泡时间为自变量,以总黄酮提取量为响应值,设计三因素三水平的响应面试验,利用Design Expert 10.0软件进行数据分析。
响应面设计试验因素与水平设计见表1。

表1 响应面设计试验因素与水平设计
1.3.6 试验分析
采用Excel软件、Design Expert10.0软件进行数据处理及分析。
2 结果与分析
2.1 芦丁标准曲线
根据测定结果,以芦丁质量浓度为横坐标,吸光度值为纵坐标,利用Excel软件绘制出的芦丁标准线。
芦丁标准曲线图见图1。
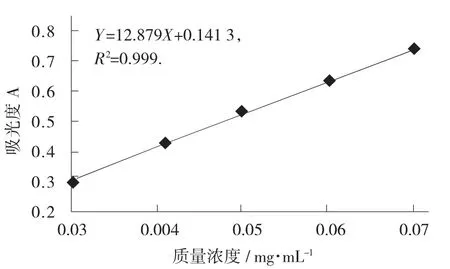
图1 芦丁标准曲线图
由图1可得回归直线方程Y=12.879X-0.141 3,其中R2=0.999,吸光值线性范围0.291A~0.727A,标准曲线质量浓度范围内线性良好。
2.2 大麦若叶粉总黄酮的提取单因素试验
2.2.1 提取温度对大麦若叶总黄酮提取量的影响
提取温度对大麦若叶总黄酮提取量的影响见图2。
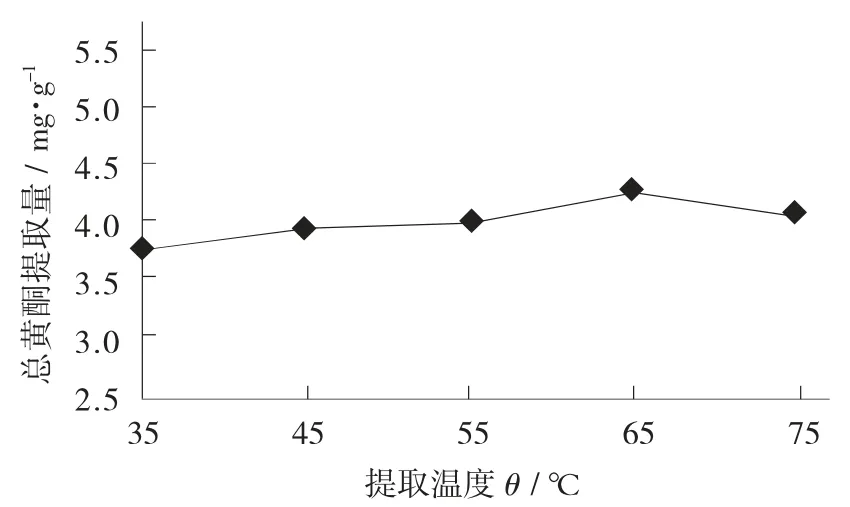
图2 提取温度对大麦若叶总黄酮提取量的影响
由图2可知,超声波提取温度在35℃时大麦若叶粉总黄酮提取量最小,为3.77 mg/g;提取温度为35~65℃,提取量逐渐上升;当提取温度达到65℃后,总黄酮提取量则降低。
这表明在一定范围内,增大超声波提取温度能够提高大麦若叶总黄酮提取量,因为将乙醇作为提取溶剂时,超声波温度的升高会加快了黄酮分子的热运动,增大可溶性溶质分子的溶解度及扩散系数,扩散速度加快使越来越多的黄酮分子溶解在乙醇中;但当温度超过65℃后,过高的温度破坏了部分不耐热黄酮类化合物的结构,使浸提液的品质发生劣变,导致总黄酮提取量降低。考虑总黄酮提取量和能源损耗等因素,选取提取温度为55,65,75℃的3个水平进行响应面试验。
2.2.2 提取时间对大麦若叶总黄酮提取量的影响
提取时间对大麦若叶总黄酮提取量的影响见图3。

图3 提取时间对大麦若叶总黄酮提取量的影响
由图3可知,当超声提取时间为30 min时,大麦若叶粉总黄酮提取量最低,之后大麦若叶粉总黄酮提取量与提取时间呈正比;当提取时间为40 min时,大麦若叶粉总黄酮提取量达到顶峰,此后大麦若叶粉总黄酮提取量与提取时间呈反比。
表明在一定范围内,提取时间的延长会使黄酮类化合物分子进行热运动的时间增加,导致更多的分子溶解到乙醇溶剂中,从而使提取量增加;当提取时间超过40 min时,由于超声波比较强的的剪切效应会促使部分黄酮类化合物损失,导致总黄酮的提取量的降低。因此,考虑总黄酮提取量和能源损耗等因素,选取超声波提取时间35,40,45 min作为响应面试验研究水平。
2.2.3 浸泡时间对大麦若叶总黄酮提取量的影响
乙醇浸泡时间对大麦若叶总黄酮提取量的影响见图4。
由图4可知,当乙醇浸泡时间为30 min时,大麦若叶粉总黄酮提取量最小,随着乙醇浸泡时间的延长,大麦若叶粉总黄酮提取量逐渐增大;当乙醇浸泡时间达到90 min时,继续延长浸泡时间,总黄酮提取量转而下降。
表明在一定条件下,增加乙醇浸泡时间,能够提高总黄酮的浸取量,即浸出量与浸取时间呈正比;当浸取时间延长到90 min时,大麦若叶粉总黄酮浸取量达到最大值,此后随着时间的延长,总黄酮提取量不升反降,出现此种现象的原因较为复杂,可能是固体形态的黄酮类化合物在向溶液扩散的时候,有一部分浸出的不太稳定的黄酮类化合物因时间过长已经氧化分解,因而使总黄酮提取量下降[20];此外,长时间的浸提通常会导致大量杂质的浸出,而一些有效成分如苷类易被同时存在的酶所水解[21];根据图4所示可得出当乙醇提取时间为90 min时,大麦若叶粉总黄酮提取量达到最大值。因此,选择超声波提取时间为60,90,120 min的3个水平作为响应面试验研究水平。

图4 乙醇浸泡时间对大麦若叶总黄酮提取量的影响
2.2.4 乙醇体积分数对大麦若叶总黄酮提取量的影响
乙醇体积分数对大麦若叶总黄酮提取量的影响见图5。
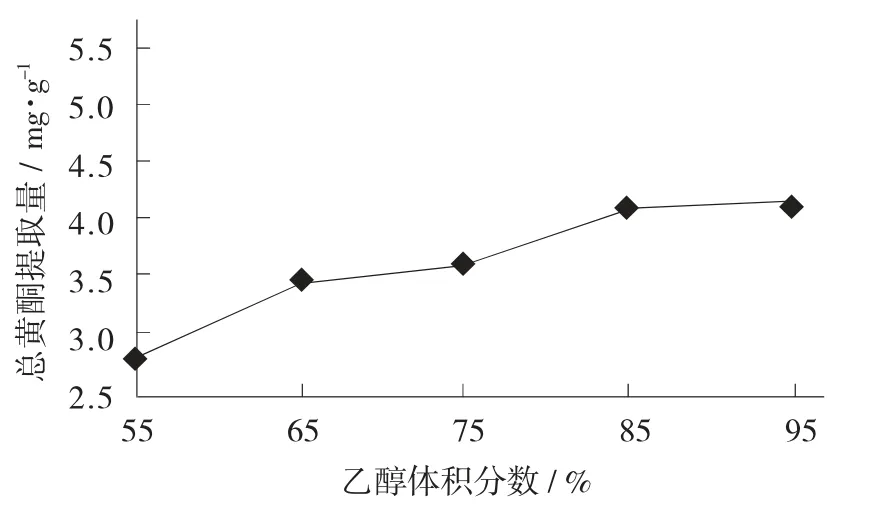
图5 乙醇体积分数对大麦若叶总黄酮提取量的影响
由图5可知,乙醇体积分数为55%~85%,大麦若叶总黄酮提取量是呈现上升趋势,当乙醇体积分数超过85%后,大麦若叶总黄酮提取量增加趋势不明显(p=0.852>0.05),基本趋于平稳。
表明在一定范围内,总黄酮提取量与乙醇体积分数呈正比,这是因为不同体积分数的乙醇溶液具有不同的极性,根据相似相溶的原理,乙醇溶液的极性与大麦若叶含有的总黄酮极性越接近,黄酮分子越容易溶解在溶剂中,总黄酮提取量便越大;但当乙醇体积分数超过85%,溶剂极性的偏低则会导致溶液中一些弱极性物质的溶出,从而影响到黄酮分子的提取。
2.2.5 料液比对大麦若叶总黄酮提取量的影响
料液比对大麦若叶总黄酮提取量的影响见图6。

图6 料液比对大麦若叶总黄酮提取量的影响
由图6可知,料液比从1∶10到1∶30,大麦若叶总黄酮提取量呈现不断上升趋势,表明料液比与大麦若叶粉总黄酮提取量呈反比,这是由于较高的料液比会阻碍黄酮分子的溶出,而乙醇溶液用量的增多则使黄酮质量浓度降低,增大了溶剂与黄酮分子的接触面积,使更多的黄酮分子能够充分溶解在乙醇溶液中,提高了总黄酮的提取量。
2.2.6 单因素试验方差分析
利用SPSS Statistics软件,对不同提取温度、提取时间、浸泡时间、乙醇体积分数、料液比下得到的大麦若叶总黄酮提取量进行方差分析。
5个单因素试验方差分析结果见表2。
由表2可知,5个影响因素的p值表明提取温度、提取时间、浸泡时间、乙醇体积分数、料液比对大麦若叶总黄酮的提取量均具有极显著的影响。
2.3 响应面优化大麦若叶总黄酮提取工艺的研究
根据单因素试验的结果,综合考虑实验室条件及节能回收,选取提取温度(55,65,75℃)、提取时间(30,40,50 min)、乙醇浸泡时间(60,90,120 min)3个因素3个水平进行响应面优化试验。应用响应面软件进行分析,考查提取温度、提取时间、浸泡时间的最佳提取工艺参数。
2.3.1 模型方程的建立与显著性检验
采用响应面法对大麦若叶总黄酮提取工艺进行优化,以超声波提取温度(A)、超声波提取时间(B)、乙醇浸泡时间(C)为自变量,大麦若叶粉总黄酮提取量(Y)为响应值。
响应面试验方案及结果见表3。
采用Design Expert 8.0.6软件对试验数据进行拟合和拟合系数的显著性分析。
回归模型方差分析见表4。
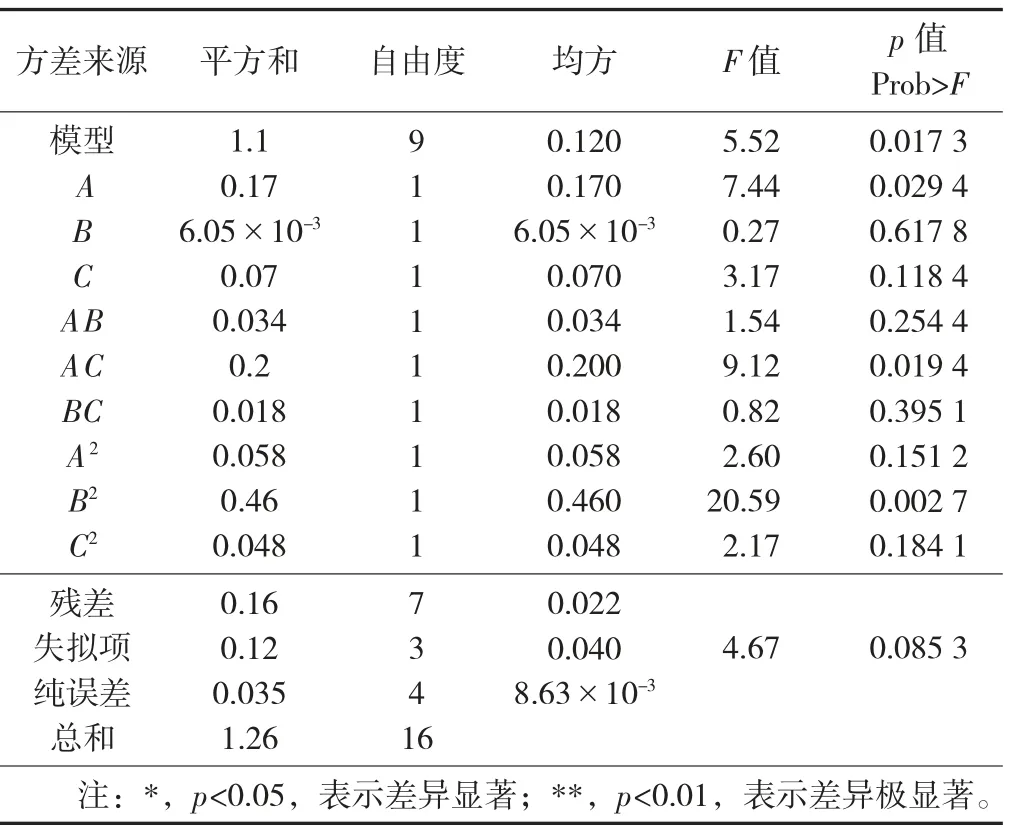
表4 回归模型方差分析
利用响应面软件中的Box-behnken选项对表3数据进行多元回归拟合,可得到大麦若叶粉总黄酮提取量Y对自变量提取温度(A)、提取时间(B)和浸泡时间(C)的二次多项回归方程:

表3 响应面试验方案及结果

由表4可知,对该模型进行F检验,模型p值为0.017 3,小于0.05,说明该模型具有显著性。此外,模型的失拟性检验是不显著的(Prob.>F>0.05),说明预测值和实际测量值之间具有相关性,所建立的回归模型拟合度良好,模型方程能反映真实的试验值,可用该模型分析和预测超声波法提取大麦若叶粉总黄酮提取量。
用F值判定回归方程中各因素对大麦若叶粉总黄酮提取率的影响,各因素对大麦若叶粉总黄酮提取量影响的大小顺序为A>C>B,表明超声波提取温度对大麦若叶粉总黄酮提取量的主效应明显;其中,B2影响极显著,A和AC影响显著,A、C、AB、BC、A2、C2影响不显著。回归方程相关系数R2为0.876 5,说明该模型满足了87.65%的样本空间。
2.3.2 响应曲交互作用分析
利用Design Expert 8.0.6软件得到相应的二次回归方程的响应面3D立体图和等高线图。根据模型所做的响应曲面及其等高线图可比较形象直观地展现出2个试验因素之间的相互关系,以及确定每个自变量的最优水平范围[22]。
提取温度与提取时间交互作用对大麦若叶粉总黄酮提取量影响的响应面(a)及等高线(b)见图7,浸泡时间与提取温度交互作用对对大麦若叶粉总黄酮提取量影响的响应面(a)及等高线(b)见图8,浸泡时间与提取时间交互作用对大麦若叶粉总黄酮提取量影响的响应面(a)及等高线(b)见图9。

图7 提取温度与提取时间交互作用对大麦若叶粉总黄酮提取量影响的响应面(a)及等高线(b)
由图7可知,3D图曲面变化陡峭,表明交互作用项提取温度与提取时间之间具有交互作用,等高线图呈现椭圆形,说明提取温度与提取时间之间交互作用显著。
由图8可知,3D图曲面变化陡峭,表明交互作用项提取温度与浸泡时间之间具有交互作用,等高线图呈现椭圆形,说明提取温度与浸泡时间之间交互作用显著。
由图9可知,3D图曲面变化陡峭,表明交互作用项提取时间与浸泡时间之间具有交互作用,等高线图呈现椭圆形,说明超声波提取时间与乙醇浸泡时间之间的交互效应较显著。
由图7~图9可知,3组交互作用项提取温度与提取时间、提取温度和浸泡时间、提取时间与浸泡时间的交互作用均显著;但是提取温度和浸泡时间的交互作用比提取温度和提取时间、提取时间与浸泡时间的交互作用显著,这点可从图8的响应面图颜色变化最为剧烈,且3D图坡度最陡得以验证。该结果与表8方差分析中回归模型显著性检验结果一致,从图7~图9响应面的3D图坡度和等高线形状可见,在所选的范围内存在极值[23-24]。
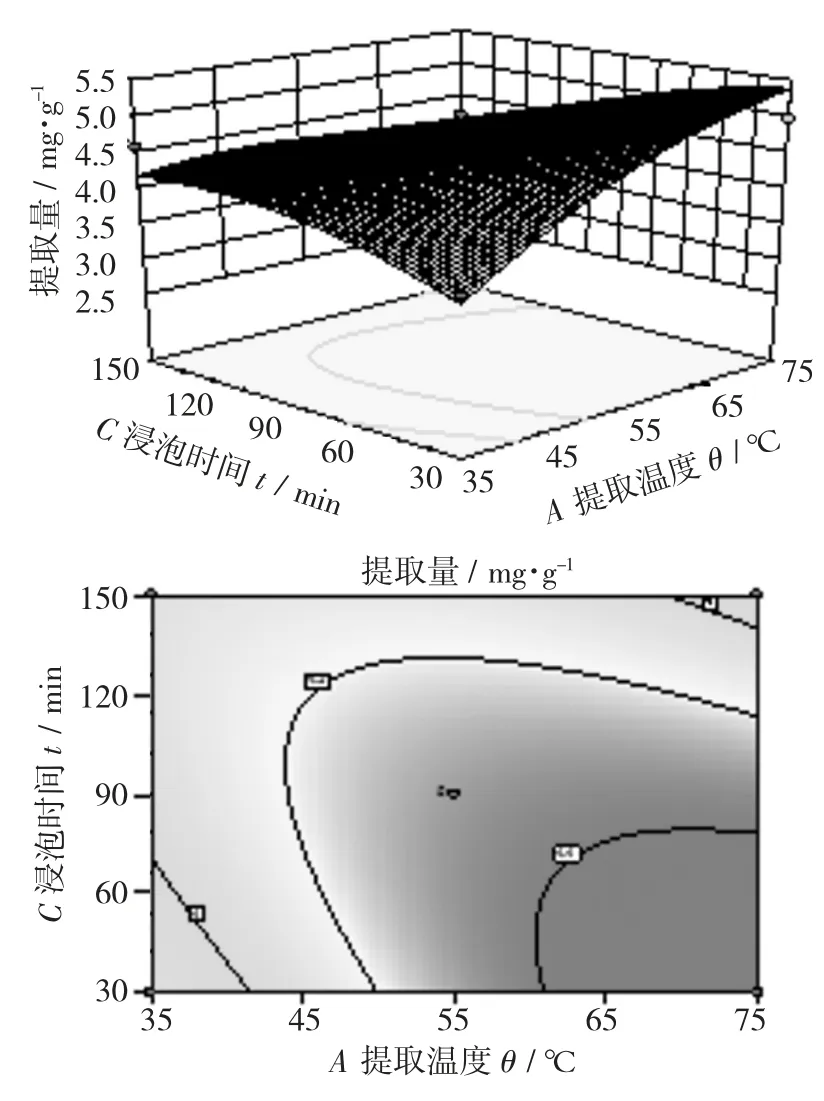
图8 浸泡时间与提取温度交互作用对对大麦若叶粉总黄酮提取量影响的响应面(a)及等高线(b)
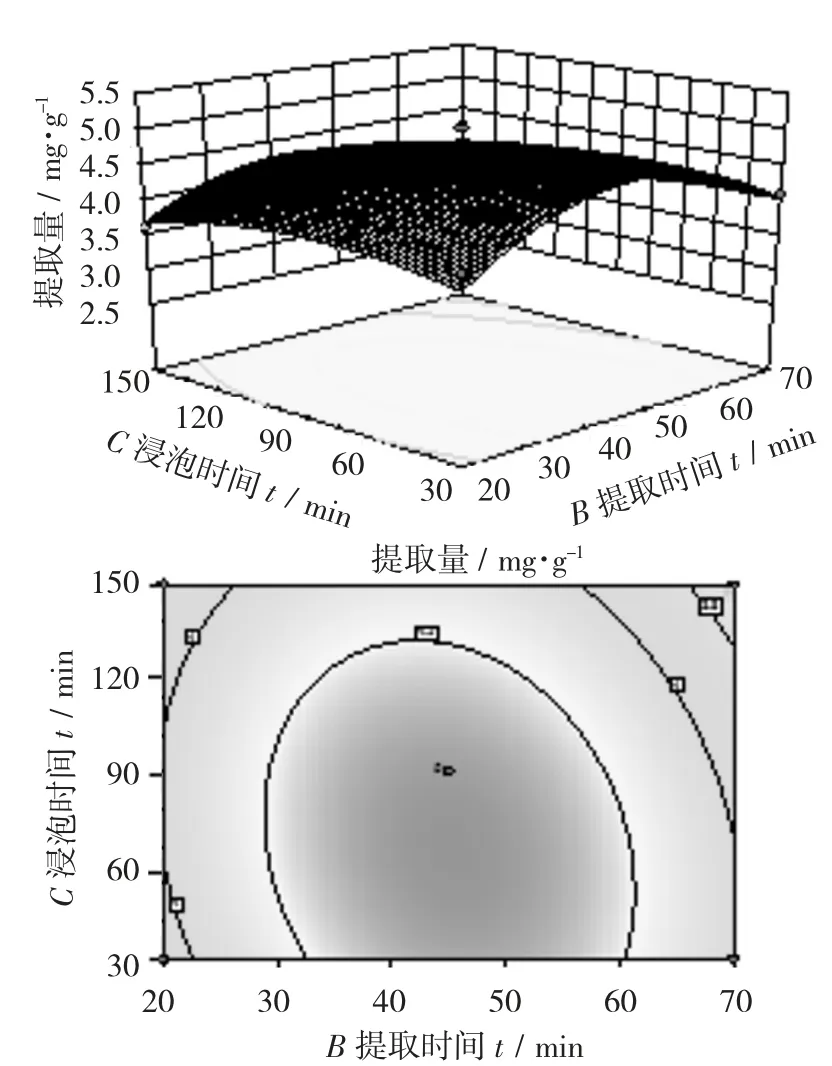
图9 浸泡时间与提取时间交互作用对大麦若叶粉总黄酮提取量影响的响应面(a)及等高线(b)
2.4 响应面优化大麦若叶总黄酮提取工艺的研究
2.4.1 残差分析结果
残差在统计学中特指理论值与实际测量值之间的差值。对模型进行残差分析可以判断响应面优化模型的准确性。假如建立的回归模型准确度较高,则表明可以将残差看作误差的观测值。
残差正态分布图见图10,预测值与残差见图11。
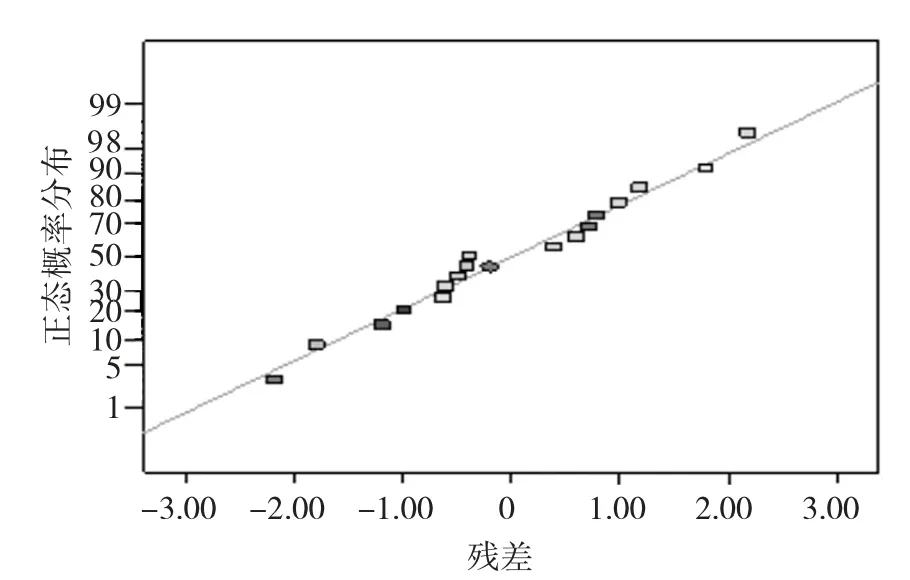
图10 残差正态分布图
图11 预测值与残差
由图10可知,该模型残差拟合曲面图中各散点分布符合线性态势且呈正态概率分布;由图11可知,经过响应面试验优化之后,预测值的内部优化残差呈现散点式的随机分布,说明残差的方差齐性符合要求。因此,试验拟合的数值模型是可行的[25]。
2.4.2 预测值与实测值拟合结果
预测值与实测值见图12。
图12 预测值与实测值
由图12可知,数据呈现散点分布且沿模型诊断呈现近似一条直线,表明模型预测值和实测值拟合良好,说明该试验误差不大。
2.5 工艺模型的优化和回归曲线的检验
经Design Expert 8.0.6软件分析,可得到超声波辅助提取大麦若叶粉总黄酮的最佳工艺条件为超声波提取温度75℃,超声波提取时间44.50 min,乙醇浸泡时间60.00 min,提取量4.404 98 mg/g。考虑到试验的可操作性,将优化条件修正为超声波提取温度75℃,超声波提取时间45 min,乙醇浸泡时间60 min。
基于响应面优化得到的最佳条件对大麦若叶粉进行3次超声波辅助提取的平行试验,得到大麦若叶粉总黄酮提取量分别为4.45,4.34,4.38 mg/g,求得平均值为4.39 mg/g,验证试验平均值与预测得到的总黄酮提取量4.40 mg/g仅相差0.01 mg/g。因此,试验模型具有准确性,表明采用响应面法优化得到的总黄酮提取条件准确、可靠,具有参考价值,即优选的工艺条件稳定可行。
3 结论
通过运用超声波提取法对市面上的一种大麦粉进行总黄酮的提取和测定,利用Design Expert 8.0.6软件对总黄酮提取率的二次回归模型进行设计分析,结果表明模型拟合度较高,试验误差较小。运用响应面法优化大麦若叶粉总黄酮的超声波辅助提取工艺,可得到最佳工艺条件为超声波提取温度75℃,超声波提取时间45 min,乙醇浸泡时间60 min,在最佳条件下,总黄酮提取量为4.39 mg/g,与理论值4.40 mg/g的相对误差为0.01 mg/g。方差分析结果显示,影响大麦若叶粉总黄酮提取量大小因素依次为提取温度>浸泡时间>提取时间[26]。
试验使用响应面法进行工艺优化设计,主要是由于响应面试验设计克服了正交试验设计只能处理离散的水平值,而无法找出整个区域上因素的最佳组合和响应值最优值的缺陷。此外,响应面设计还能减少试验次数,分析几种因素间的交互作用,从而达到较全面地反映各因素水平的的效果。因此,响应面法可以更好地对大麦若叶粉总黄酮的提取工艺进行回归分析和参数优化。

