哮喘-慢阻肺重叠、哮喘和慢性阻塞性肺疾病患者诱导痰VEGF、ICAM-1、IL-13、呼出气一氧化氮水平的变化及临床意义
付 群,郭 迪,赵文飞
(郑州大学第五附属医院 呼吸与危重症医学科, 河南 郑州 450052)
临床数据显示,慢性阻塞性肺疾病(COPD)在我国40岁以上人群中发病率高达8.2%,在我国疾病负担中居于第4位[1]。支气管哮喘(简称“哮喘”)在我国成人中发病率接近2.0%[2]。大约15%~20%的COPD患者合并哮喘,称为哮喘-COPD重叠(ACO)[3]。由于上述疾病均表现出呼吸困难、咳喘等典型临床症状,影像学特征也存在相似性,早期鉴别诊断存在一定困难[4],而其治疗方案却差别较大,因此,寻找敏感的辅助诊断指标,提高早期鉴别诊断的准确性具有重要意义。已有研究表明,痰液中炎症因子水平的变化在呼吸系统疾病的诊断与治疗中具有重要的参考意义,细胞间黏附分子-1(ICAM-1)、白介素-13(IL-13)、血管内皮生长因子(VEGF)是评估气道上皮炎症性损伤严重程度的敏感指标[5-6],呼出气一氧化痰(FeNO)水平可反映嗜酸粒细胞性气道炎症的严重程度[7]。为进一步明确ACO的炎症本质,为制订针对性治疗方案提供依据,本研究比较了ACO与哮喘、COPD患者的气道炎症因子水平,现总结如下。
1 资料与方法
1.1病例选择 选取2018年6月~2020年6月在我院治疗的哮喘患者77例(哮喘组)、COPD患者78例(COPD组),ACO患者80例(ACO组),纳入标准:(1)符合中华医学会制订的《支气管哮喘防治指南(2016年版)》[8]《慢性阻塞性肺疾病诊治指南(2013年修订版)》[9]关于哮喘、COPD、ACO的诊断标准;(2)经治疗后处于稳定期(1个月内未急性发作);(3)14天内未使用糖皮质激素等药物;(4)同意接受随访并自愿参与研究;排除标准:(1)其他肺疾病引起的肺通气功能障碍;(2)有肺部手术史;(3)合并严重心、肝、肾功能不全;(4)合并神经、免疫系统疾病;(5)合并恶性肿瘤;(5)妊娠期或哺乳期妇女。
1.2方法
1.2.1一般资料 调查各组性别、年龄、体质量指数(BMI)等一般资料;采用哮喘控制测试(ACT)测评哮喘组及ACO组病情;采用COPD症状评分(CAT)测评COPD组与ACO组患者病情。
1.2.2肺功能 (1)常规肺功能指标:采用德国Jaeger MS-PFT型肺功能检查仪测量第一秒用力呼气量(FEV1)、第一秒用力呼气率(FEV1/FVC)、第一秒用力呼气量占预计量的百分比(FEV1/pre%);(2)小气道功能指标:测量用力呼气流速50%(FEF50%)、用力呼气流速75%(FEF75%)及用力呼气中期流速(MMEF%),其中2个检测值低于正常值的65%表明存在小气道功能障碍;(3)肺顺应性:测量残气量占肺总量比值(RV/TLC)。
1.2.3气道炎症因子水平 所有符合纳入标准的患者,于入组当日采集诱导痰2 ml,采用罗氏全自动生化分析仪检测VEGF、ICAM-1、IL-13水平;采用纳库伦呼气分析仪检测患者呼出气FeNO浓度。

2 结 果
2.1一般资料 各组年龄、吸烟史、哮喘家族史差异有统计学意义(P<0.05);两两比较显示,COPD组年龄高于ACO组,ACO组年龄高于哮喘组(P<0.05);哮喘组有吸烟史比例患者高于ACO组,ACO组有吸烟史患者比例高于COPD组(P<0.05);ACO组、哮喘组有家族史患者比例高于COPD组(均P<0.05),ACO组与COPD组有家族史患者比例无明显差异(P>0.05)。各组其他指标差异无统计学意义(P>0.05),见表1。
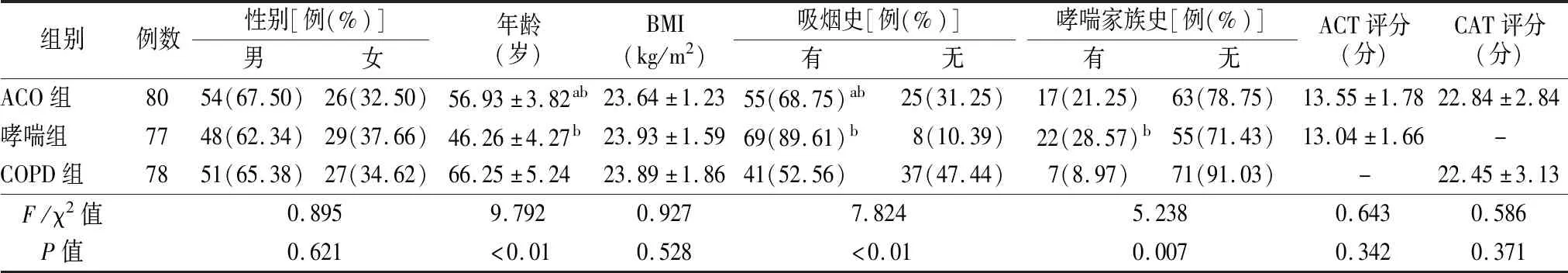
表1 各组一般资料比较
2.2肺功能指标 各组FEV1、FEV1/FVC、FEV1/pre%、小气道功能障碍发生率、RV/TLC差异均有统计学意义(P<0.05),两两比较显示,ACO组、COPD组FEV1、FEV1/FVC、FEV1/pre%低于哮喘组,而小气道功能障碍发生率、RV/TLC高于哮喘组(均P<0.05),ACO组与COPD组上述指标差异无统计学意义(均P>0.05),见表2。
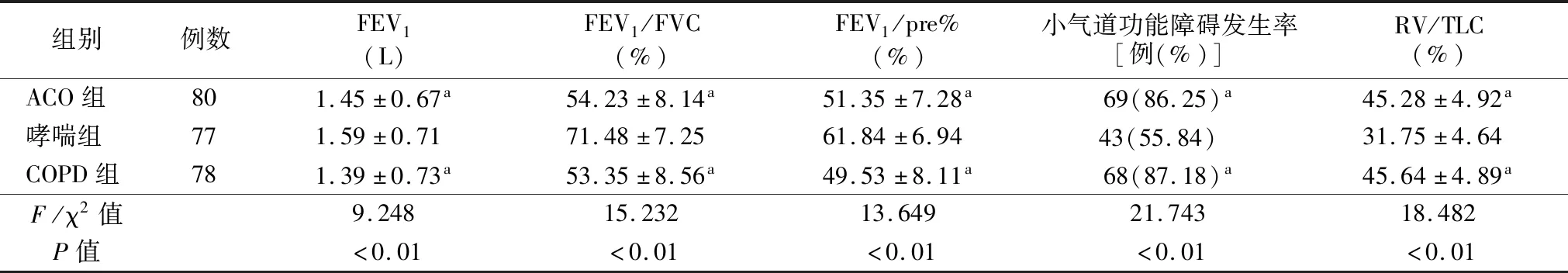
表2 各组常规肺功能指标比较
2.3各组诱导痰细胞因子与FeNO水平 各组VEGF、ICAM-1、IL-13、FeNO差异有统计学意义(P<0.05);两两比较显示,ACO组、哮喘组VEGF、ICAM-1高于COPD组,ACO组VEGF高于哮喘组(均P<0.05);哮喘组IL-13、FeNO高于ACO组、COPD组,ACO组FeNO高于COPD组(均P<0.05),见表3。
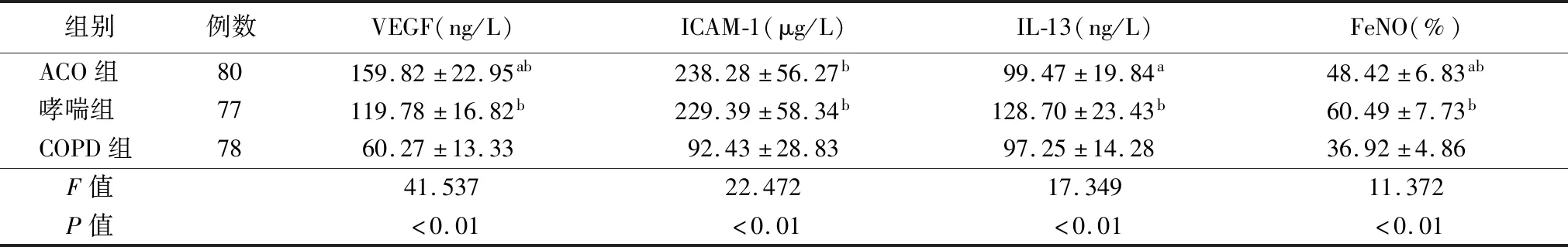
表3 各组诱导痰细胞因子与FeNO水平比较
3 讨 论
哮喘与COPD均是以气流受限为典型表现的慢性气道炎症性疾病,但两者发病机制与病理变化有着诸多不同。哮喘是主要由嗜酸性粒细胞诱发的气道慢性变态反应性炎症,以气道黏膜高反应性为典型特征;而COPD是主要由中性粒细胞浸润导致的慢性呼吸道炎症,可同时累及气道、肺实质及肺部血管,主要症状表现为气道持续不完全可逆性气流受限[10]。研究发现,在因慢性气道炎症就诊的患者中,大约20%~40%同时存在哮喘与COPD的主要特征,因此认为ACO的发病可能是由变态反应与慢性炎症反应共同介导[11]。与罹患COPD、哮喘单一疾病的患者比较,ACO患者肺功能受损更严重、急性发作及并发症更多,病死率更高[12]。因此,早期鉴别哮喘、COPO、ACO并给予针对性治疗尤为重要。
本研究中,对比患者一般资料发现,ACO、哮喘、COPD患者在年龄、吸烟史与家族史方面存在差异。COPD组年龄高于ACO组,ACO组年龄高于哮喘组。COPD在老年人群中发病率较高[1]。ACO的发病率也随着年龄增长明显升高,已有研究报道,90%的ACO患者年龄均在40岁以上[3]。哮喘患者年龄较轻,这可能是由于哮喘的发病主要与个体过敏体质有关,符合疾病发病规律[13]。多项研究证实,哮喘多发于吸烟、有家族史的人群[13-14],本研究中,哮喘组有吸烟史、家族史的患者比例最高,与上述研究结论一致。陈素婷等[15]报道,ACO患者吸烟史、家族史比例处于哮喘患者与COPD患者之间,本研究中ACO组有吸烟史患者比例显著低于哮喘组,有家族史患者比例略低于哮喘组,但差异无统计学意义;而ACO组有吸烟史、家族史患者比例均显著高于COPD组,与陈素婷等[15]研究结论基本一致,表明吸烟史、家族史等资料有助于ACO、哮喘与COPD的鉴别诊断。
对各组肺功能比较发现,ACO组、COPD组FEV1、FEV1/FVC、FEV1/pre%低于哮喘组,而小气道功能障碍发生率、RV/TLC高于哮喘组,提示ACO与COPD患者气流受限症状均比哮喘患者更加严重。已有研究指出,ACO患者出现的气流受限症状与COPD患者症状极为相似,FEV1/FVC降低是导致ACO发病的独立危险因素[16]。由于ACO同时具有哮喘与COPD的特征,ACO患者经历反复哮喘发作后,支气管逐渐从最初的痉挛状态发展为黏膜充血水肿,最终出现气道重塑;同时ACO还长期存在COPD的气道炎症反应,最终导致其小气道功能障碍比哮喘症状更严重[17]。本研究中ACO组与COPD组肺功能指标差异无统计学意义,与已有研究结论一致[18],提示临床中通过肺功能检查无法较好鉴别ACO与COPD。
本研究结果显示,ACO组、哮喘组VEGF、ICAM-1高于COPD组,ACO组VEGF高于哮喘组;哮喘组IL-13、FeNO高于ACO组及COPD组,ACO组FeNO高于COPD组。已有研究表明,VEGF、ICAM-1水平的异常升高,可诱导炎症因子IL-6、IL-10等的合成增多,促进单核细胞、巨噬细胞的聚集与活化,引起内皮细胞增生、通透性增强,导致水肿与炎症[5-6]。本研究中ACO、哮喘患者VEGF、ICAM-1水平明显高于单纯COPD患者,可能与哮喘气道黏膜高反应性的病理特征有关,由于气道黏膜上皮细胞受损及炎症因子的浸润,可诱发VEGF、ICAM-1的分泌增多,促进局部气道黏膜新生血管的形成[5-6]。ACO组VEGF高于哮喘组,可能与ACO患者炎症反应更加严重有关,具体还需更多研究进一步验证。已有研究表明,IL-13可通过介导募集嗜酸性粒细胞,加剧气道上皮黏膜的炎症损伤[19];张方琪等[20]研究指出,IL-13具有诱导B细胞增殖及合成IgE类抗体的重要功能,而哮喘是以B淋巴细胞合成的IgE类抗体为介导诱发的变态性反应,因此IL-13可能参与哮喘的发生与发展过程。本研究中哮喘组IL-13高于其他两组,与上述研究结论具有一致性。FeNO是典型的嗜酸性气道炎症标记物[7],本研究中哮喘组FeNO高于ACO组,ACO组FeNO高于COPD组,可能是由于哮喘的嗜酸性粒细胞气道炎症比ACO更加严重,而ACO同时存在嗜酸性粒细胞炎症与中性粒细胞炎症,COPD则是完全以中性粒细胞浸润为主的炎症,这表明FeNO对于ACO、哮喘、COPD的鉴别具有参考价值。
综上所述,ACO、哮喘、COPD患者VEGF、ICAM-1、IL-13、FeNO水平存在差异,对于临床诊治具有一定的参考价值。通过联合检测上述指标,结合临床症状、肺功能检查、年龄、吸烟史、家族史等资料,有助于尽早区分ACO、哮喘、COPD,制订针对性治疗方案。

