松油烯-4-醇抑制神经胶质瘤U87和U251细胞增殖、迁移与侵袭并促进其凋亡
詹 琪,曾智锐,任长城,凌园果,曾 茜,刘孟涛,徐卡娅,出良钊,刘 健,5
(贵州医科大学 1.临床医学院、2.基础医学院生理学教研室,3.贵州省常见慢性疾病发病机制及药物研究重点实验室,4.贵州医科大学附属医院神经外科,5.贵州省人民医院,贵州 贵阳 550004)
神经胶质瘤(glioma)是最常见的中枢神经系统原发性肿瘤[1],由多种因素相互作用导致,具有高度侵袭性、代谢异常和血管生成等恶性生物学特征[2],恶性胶质瘤病死率极高,其中位生存时间仅约15个月,有着较高的复发率,手术切除是主要的治疗手段,术后的辅助分级放疗结合化疗也占据很重要的地位。目前一线化疗药替莫唑胺疗效明显,但受限于耐药性[3-4],因此,研发新药物对治疗神经胶质瘤具有重大的临床意义。
蛋白质酪氨酸磷酸酶非受体型1和2(PTPN1、PTPN2)属于蛋白酪氨酸磷酸酶家族,一直被认为对胰岛素和瘦素受体信号传导有负调控作用[5]。近期报道,它在癌细胞中异常表达,并作为一种重要的癌基因发挥作用,PTPN1促进增殖、集落形成和迁移,而降低癌细胞系的凋亡[6]。PTPN2在胶质瘤中表达显著增高,在T98G细胞中沉默PTPN2基因明显抑制细胞集落形成和诱导细胞凋亡,能够抑制胶质瘤细胞的生长[7],故PTPN1/2有望成为抗胶质瘤药物作用的蛋白靶点。
从植物材料中提取的精油及其成分已被发现具有抗菌、抗氧化、抗炎、抗癌等作用,松油烯-4-醇(Terpinen-4-ol,化学式:C10H18O,T4O)是精油的主要有效成分之一。近期报道表明,T4O通过选择性诱导抗肿瘤作用,在黑色素瘤细胞系中引起细胞死亡和细胞周期阻滞[8]。但T4O在胶质瘤中存在何种作用与机制暂未知。本研究拟探讨T4O对神经胶质瘤U87与U251细胞恶性生物学行为的影响与潜在作用靶点,优化胶质瘤治疗方案。
1 材料与方法
1.1 材料
1.1.1细胞 神经胶质瘤细胞U87与U251购自中国科学院上海细胞库
1.1.2试剂 DMEM高糖培养液(货号:A4192101)、胎牛血清(货号:10099141C)和2.5 g·L-1胰蛋白酶(货号:25200-056)购自美国Gibco公司;二甲基亚砜(DMSO,货号:D2650)、细胞增殖与毒性检测试剂盒(CCK-8,货号:CA1210)、结晶紫染色液(货号:G1063)、蛋白裂解液RIPA(货号:R0020-100)、蛋白酶抑制剂PMSF(货号:P0100)和BCA蛋白定量试剂盒(货号:PC-0020-500)购自北京索莱宝生物工程有限公司;Transwell小室(货号:3422)购自北京明阳科华生物科技有限公司;SDS-PAGE制胶试剂盒(货号:P0690)与Annexin-FITC/碘化丙啶(PI)凋亡检测试剂盒(货号:C1062L)购自上海碧云天生物技术有限公司;辣根过氧化物酶标记的羊抗兔二抗(货号:PR30019)以及兔源性多克隆抗体PTPN1(货号:11334-1-AP)、PTPN2(货号:11214-1-AP)、Bcl-2(货号:12789-1-AP)、Bax(货号:50599-2-Ig)、caspase-3(货号:19677-4-AP)、MMP-2(货号:10373-2-AP)、MMP-9(货号:10375-2-AP)与鼠源性β-actin单克隆抗体(货号:66009-1-Ag)购自武汉三鹰生物技术有限公司;极超敏ECL化学即用型底物曝光液(货号:AR1190)购自武汉博士德生物公司;松油烯-4-醇(纯度>98%)(货号:329-52972)购自天津一方科技有限公司。
1.1.3仪器 超净工作台(型号:SW-CJ-2FB)购自上海沪静医疗器械有限公司;恒温培养箱(型号:DHP-9032(A))购自上海飞越实验仪器公司;多功能酶标仪(SpectraMax M3)购自美国Molecular Devices公司;倒置显微镜(型号:XDS-3)购自上海精密仪器仪表有限公司;摇摆摇床(型号:SHRK07AL1)购自深圳现代豪方仪器仪表科技有限公司;Novocyte型流式细胞仪(型号:D2060R)购自杭州艾森生物有限公司;Western blot凝胶成像系统(型号:FluorChemM)购自北京创博环球生物科技有限公司。
1.2 方法
1.2.1细胞培养 神经胶质瘤细胞U87和U251添加含10% FBS 的DMEM高糖培养基,放置于37 ℃、含5% CO2的精密恒温培养箱中培养。常规隔日更换新鲜培养基。汇合度达0.8以上,则进行消化传代以及冻存操作。
1.2.2用CCK-8法检测T4O对细胞增殖的影响 将神经胶质瘤细胞株U87和U251(均2×103个/孔)种于96孔板上。分别用浓度为0(即DMSO处理的对照组)、1、2和4 μmol·L-1的T4O处理细胞,每组设置6个复孔。24 h后,取CCK-8液与含10% FBS的DMEM培养基以1 ∶9的比例混匀;96孔板弃去原培养液,每孔加入100 μL的混合液,放置恒温培养箱,时长为2 h。将多功能酶标仪中波长调至450 nm并读取吸光度(OD值)。各组相对增殖率/%=(观察组OD值-空白组OD值)/(对照组OD值-空白组OD值)×100%。
1.2.3克隆平板法检测T4O对细胞克隆形成能力的影响 神经胶质瘤细胞U87和U251(均1×103个/皿)接种于细胞培养皿(直径=6 cm)上。细胞贴壁后,分别用浓度为0(即DMSO处理的对照组)、1、2和4 μmol·L-1的T4O处理细胞。15 d后,弃培养液,4 %多聚甲醛溶液固定20 min,随后0.5%结晶紫常温染色20 min。置于烘箱烤干后拍照记录。计算各组细胞克隆形成数。
1.2.4流式细胞术检测T4O对胶质瘤细胞凋亡的影响 用胰蛋白酶消化U87与U251细胞后,按照1×104个/孔的密度接种于6孔板中。以浓度为0(即DMSO处理的对照组)、1、2和4 μmol·L-1的T4O处理24 h后,弃培养液,用1×PBS洗2次,每孔加入1 mL不含EDTA的胰酶消化后,4 ℃离心5 min收集细胞,用预冷的PBS洗涤细胞2次,4 ℃离心5 min,收集1 × 105细胞,吸弃PBS,加1×Binding Buffer 100 μL重悬细胞,添加5 μL Annexin V-FITC和10 μL PI,混匀后避光反应20 min,加入400 μL 1×Binding Buffer,混匀后置于冰上,于流式细胞仪检测。其中,Q1象限区域是机械损伤所导致死亡细胞百分比,Q2象限区域是晚期凋亡细胞百分比,Q3象限区域是早期凋亡细胞百分比,Q4象限区域是存活细胞百分比。
1.2.5划痕愈合实验检测T4O对神经胶质瘤细胞迁移能力的影响 神经胶质瘤细胞株U87和U251(均2 × 105个/孔)接种于6孔板上。待细胞汇合度达90%时,以无血清培养液饥饿细胞24 h。以200 μL移液器枪头在细胞单层上划一直线。PBS 洗3次以清除漂浮的细胞,倒置显微镜下记录 0 h划痕的情况。分别用浓度为0(即DMSO处理的对照组)、1、2和4 μmol·L-1的T4O处理细胞。恒温培养箱中培养细胞24 h后再次记录划痕情况。ImageJ软件测量划痕0 h和24 h的面积,24 h内划痕的愈合面积为同一处理组0 与24 h划痕的面积之差。相对迁移率/%=各药物处理组24 h内愈合面积/对照组24 h内愈合面积×100%。
1.2.6Transwell小室法检测T4O对神经胶质瘤细胞侵袭能力的影响 共300 μL的神经胶质瘤细胞U87和U251的细胞悬液(含2×105个细胞)加入到预先铺好Matrigel的Transwell上室里,然后分别用浓度为0(即DMSO处理的对照组)、1、2和4 μmol·L-1的T4O处理细胞。Transwell下室中加入700 μL的完全培养液(含10%FBS)作为诱导物。在恒温培养箱中放置24 h后,弃去旧培养液,用4 %多聚甲醛溶液常温固定细胞20 min和0.5%浓度的结晶紫常温染色20 min。PBS洗掉残留结晶紫后,在烤箱烘干残留水分。每孔随选4个视野(× 100),于显微镜下拍照记录并计数侵袭细胞数。
1.2.7生物信息学预测与分析T4O作用靶点 根据T4O的药效团,利用Swissprediction软件,预测T4O作用的蛋白靶点,获取靶点后应用 Cytoscape 软件可视化T4O调控的靶点。随后利用公共数据库GEPIA分析靶点的表达量与神经胶质瘤患者总生存率的关系。P<0.05则认为靶点的表达量与患者的总体生存率相关。与患者总体生存率相关的靶点则认为是T4O在神经胶质瘤中重要的作用靶点。
1.2.8蛋白质印迹法检测PTPN1、PTPN2以及其下游与增殖、转移相关蛋白的表达 神经胶质瘤U87和U251细胞用浓度为0(即DMSO处理的对照组)、1、2和4 μmol·L-1的T4O处理24 h后,用含 1% PMSF的RIPA裂解液裂解细胞,收集蛋白液后以BCA法定量。蛋白(20 μg)加入到10%的 SDS-PAGE胶中,120 V恒压电泳1.5 h,300 mA恒流转膜2 h至PVDF膜上;5%脱脂奶粉常温封闭2 h后,分别加入稀释度为1 ∶1 000的兔源性PTPN1多克隆抗体、兔源性PTPN2多克隆抗体、兔源性Bcl-2多克隆抗体、兔源性Bax多克隆抗体、兔源性pro-caspase-3多克隆抗体、兔源性cleaved caspase-3多克隆抗体、兔源性MMP-2多克隆抗体、兔源性MMP-9多克隆抗体以及鼠源性β-actin单克隆抗体,在4 ℃条件下放置摇床过夜。用TBST洗涤3次,15 min/次,以1 ∶1 500的体积稀释比稀释辣根过氧化物酶标记的山羊抗兔或鼠 IgG后加入,进行室温孵育2 h,后用TBST洗涤3次,15 min/次。曝光后检测各蛋白条带的灰度值,重复3次。
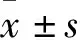
2 结果
2.1 T4O抑制神经胶质瘤U87和U251细胞的增殖CCK-8检测结果(Fig 1)显示,0(即DMSO对照)、1、2 和4 μmol·L-1的T4O处理 24 h后,U87细胞的相对增殖率分别为(99.25±2.60)%、(87.47±2.63)%、(76.24±1.78)% 和(64.72±3.03)%;U251细胞的相对增殖率分别为(100.03±1.88)%、(85.70±3.79)%、(73.52±6.60)% 和(57.41±5.71)%。对比对照组,各浓度T4O处理组细胞的增殖率均出现明显减少,差异具有统计学意义(P均<0.05)。提示,T4O明显抑制神经胶质瘤U87和U251细胞的增殖。
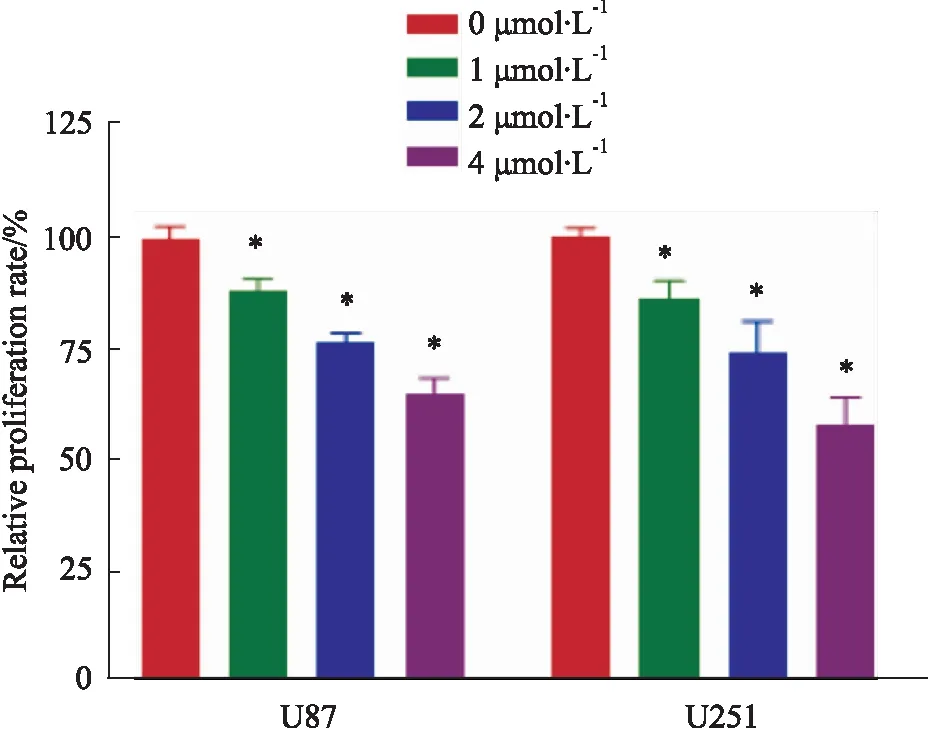
Fig 1 Effects of different concentrations of T4O on 24 h proliferation of glioma U87 and U251 cells detected by CCK-8
2.2 T4O明显抑制神经胶质瘤U87和U251细胞的克隆形成能力克隆平板实验结果(Fig 2)显示,0(即DMSO对照)、1、2 和 4 μmol·L-1的T4O处理组中,U87细胞克隆形成数依次为(886±14)个、(782±10)个、(417±11)个和(102±3)个;U251细胞克隆形成数依次为(894±14)个、(743±15)个、(121±20)个和(46±8)个。对比对照组,各浓度T4O处理组细胞的克隆形成数均出现明显减少,差异具有统计学意义(P均<0.05)。提示,T4O明显抑制神经胶质瘤U87和U251细胞的克隆形成能力。
2.3 T4O明显促进神经胶质瘤U87和U251细胞的凋亡流式细胞凋亡实验结果(Fig 3)显示,0(即DMSO对照)和 1、2、4 μmol·L-1的T4O处理24 h后, U87细胞凋亡率分别为(1.34±0.03)%、(4.10±0.06)%、(7.93±0.10)% 和(11.56±0.53)%;U251细胞凋亡率分别为(2.09±0.07)%、(3.55±0.12)%、(6.38±0.13)%和(6.71±0.07)%。对比对照组,各浓度T4O处理组细胞的凋亡率均出现明显增加,差异具有统计学意义(P均<0.05)。提示,T4O明显促进神经胶质瘤U87和U251细胞的凋亡。
2.4 T4O明显抑制神经胶质瘤U87和U251细胞的迁移划痕愈合实验结果(Fig 4)显示,0(即DMSO对照)和 1、2、4 μmol·L-1的T4O处理 24 h 后,U87细胞的相对迁移率分别为(99.99±1.33)%、(71.47±1.87)%、(42.07±1.55)%和(32.51±1.57)%;U251细胞的相对迁移率分别为(100.10±1.56)%、(73.84±5.18)%、(50.48±4.38)%和(25.19±2.23)%。与对应细胞系的对照组相比,各浓度松T4O处理组细胞的相对迁移率均出现明显减少,差异具有统计学意义(P均<0.05)。提示,T4O明显抑制神经胶质瘤U87和U251细胞的迁移能力。
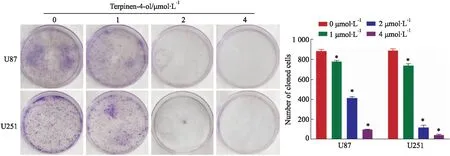
Fig 2 Effects of T4O on colony formation of glioma U87 and U251 cells detected by colony formation assay n=3)

Fig 3 Effects of T4O on U87 and U251 cell apoptosis detected by flow cytometry n=3)
2.5 T4O明显抑制神经胶质瘤U87和U251细胞的侵袭Transwell小室实验结果(Fig 5)显示,0(即DMSO对照)和1、2、4 μmol·L-1的T4O处理24 h, U87细胞每视野下侵袭过膜的细胞数为(389±11)个、(282±9)个、(184±7)个 和(45±5)个;U251细胞侵袭过膜的细胞数为(325±8)个、(174±10)个、(107±4)个和(17±4)个。对比对照组,各浓度T4O处理组细胞的每视野下侵袭过膜细胞数均出现明显减少,差异具有统计学意义(P均<0.05)。提示T4O明显抑制神经胶质瘤U87和U251细胞的侵袭能力。

Fig 4 Effects of T4O on glioma U87 and U251 cell migration determined by Scratch healing test (×40) n=3)

Fig 5 Effects of T4O on invasion of glioma U87 and 251 cells determined by Transwell experiments (×100) n=3)
2.6 T4O的作用靶点预测与分析根据T4O的药效团,我们利用Swissprediction软件,预测其作用靶点。发现T4O有37个作用靶点(Fig 6A)。进一步,我们利用公共数据库GEPIA分析靶点与神经胶质瘤进展的关系。发现:靶点PTPN1和PTPN2高表达的神经胶质瘤患者总体生存率较低(Fig 6B)。提示PTPN1和PTPN2可能是T4O在神经胶质瘤中的重要作用靶点。
2.7 T4O对PTPN1、PTPN2、Bcl-2、Bax、cleaved caspase-3、MMP-2与MMP-9表达的影响用不同浓度(0、1、2、4 μmol· L-1)的T4O处理神经胶质瘤U87和U251细胞后,免疫印迹法检测结果(Fig 7)显示,与各细胞系的对照组(即0 μmol·L-1的T4O组)相比,各浓度处理组PTPN1、PTPN2、MMP-2、MMP-9与Bcl-2的相对表达量均见明显减少,cleaved caspase-3与Bax蛋白的相对表达量均见明显增加,差异均具有统计学意义(P<0.05)。提示T4O显著抑制其在神经胶质瘤中的关键靶点蛋白PTPN1和PTPN2的表达以及下游相关增殖迁移和侵袭相关指标。

Fig 6 Prediction of protein target of T4O action(A)and relationship between target protein and glioma progression(B)
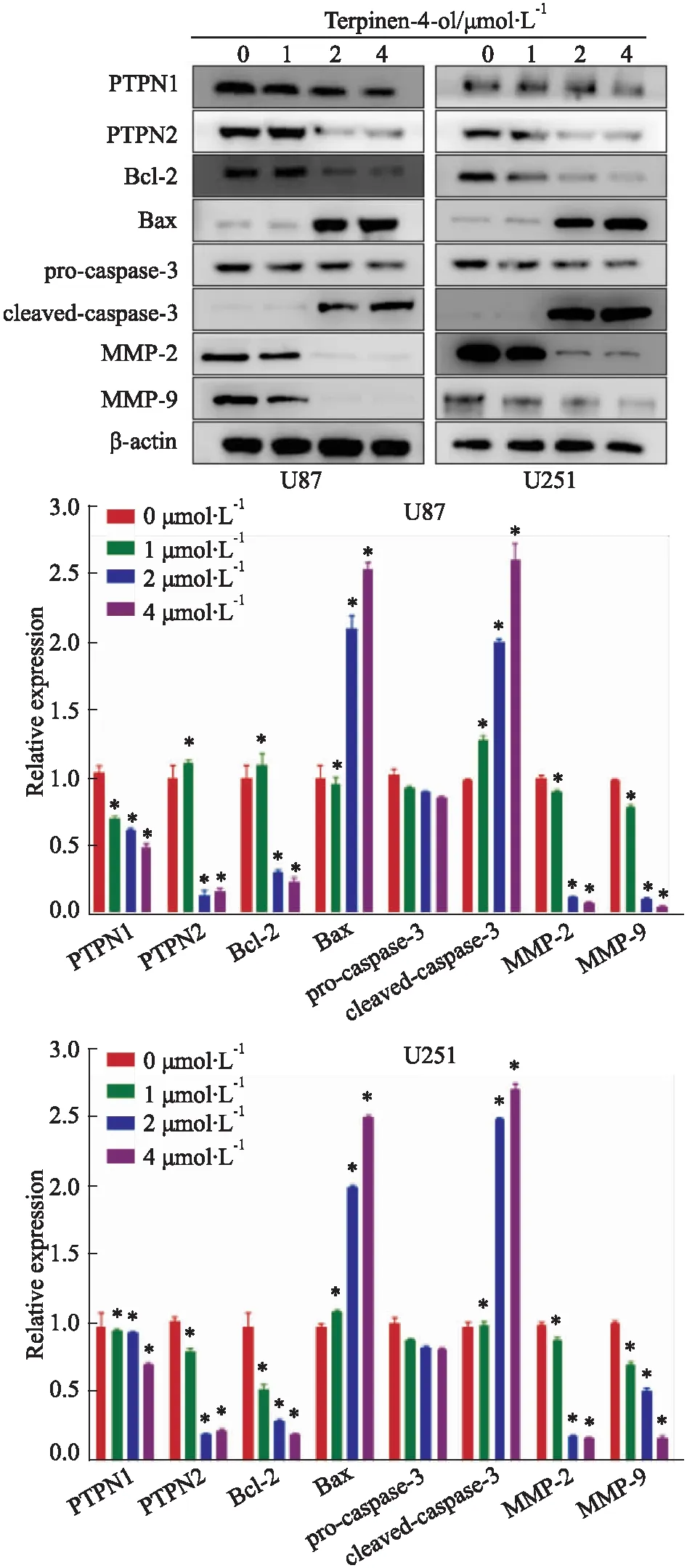
Fig 7 Effects of T4O on expression of PTPN1, PTPN2, Bcl-2, Bax, pro-caspase-3, cleaved caspase-3, MMP-2 and MMP-9 protein in U87 and U251 cells detected by Western blot n=3)
3 讨论
脑部最常见肿瘤类型为神经胶质瘤,恶性胶质瘤危害极高,最主要生物特性为侵袭性,患者5年生存率处于较低水平,表明胶质瘤的临床治疗面临巨大挑战。临床上用于治疗胶质瘤的药物有很多,如替莫唑胺,其在低级别胶质瘤中展示出了较好的疗效,但面对级别较高的胶质母细胞瘤,易产生耐药与复发,因此寻找新的、安全的并且有效的抗不同级别胶质瘤药物是基础和临床研究的一项关键任务[9]。
T4O是从中药姜黄中提炼出的一种丰度较高的松油烯类有效成分[10]。T4O目前在临床上主要作为治疗皮肤真菌病及寄生虫感染药物,可内服或外敷,安全性高,毒副作用少[11]。临床上,多种松油烯类物质已成功地用作抗癌化疗药物,如长春新碱和紫杉醇等。潜在表明,骨架结构为松油烯类的化合物如T4O等可能也具有抗肿瘤作用。近些年研究也证实这一推测。如T4O能够抑制人黑色素瘤细胞的生长,并对其耐药变异体更有效,它们在质膜中表达高水平的P-糖蛋白,克服了P-糖蛋白阳性肿瘤细胞对caspase依赖性凋亡的抗性[12]。再如T4O诱导细胞色素C从线粒体释放和Bid蛋白在caspase-8刺激后被切割,从而诱导人白血病HL-60细胞自噬与凋亡[13]。本研究以神经胶质瘤U87(起源于高级别的神经胶质瘤)和U251细胞(起源于低级别的神经胶质瘤)为细胞模型,发现T4O均明显抑制神经胶质瘤U87和U251细胞的增殖、侵袭与迁移,并诱导了其凋亡,表明T4O在低级别胶质瘤与高级别胶质瘤中均具有明显疗效。提示T4O是一种良好的抗神经胶质瘤药物。
蛋白质酪氨酸磷酸酶类(PTPs)是负责催化酪氨酸去磷酸化这一过程,PTPN1与PTPN2是PTPs的众多类型中很常见的两种类型,他们的催化结构域具有>74%的一致性[14]。近期大量研究表明PTPN1、PTPN2在胶质瘤中的表达异常增高且与患者不良预后相关[15]。Tao等[16]发现PTPN1在胶质瘤组织中过度表达,并且通过MAPK/ERK和PI3K/AKT通路促进胶质瘤的进展;Wang等[17]研究表明,PTPN2在胶质母细胞瘤中的表达水平升高,与IDH野生型和间充质亚型胶质瘤有关,并与胶质瘤的免疫应答和炎症反应密切相关。本研究中,基于药效团模型,运用生物信息学手段发现PTPN1与PTPN2为T4O的作用靶点,且PTPN1和PTPN2高表达的神经胶质瘤患者总体生存率较低。提示:PTPN1和PTPN2是T4O在神经胶质瘤中的重要作用蛋白,其发挥生物学功能可能是通过抑制PTPN1和PTPN2介导的。进一步通过Western blot发现,T4O能够明显抑制PTPN1与PTPN2的表达,并且其下游侵袭相关蛋白MMP-2、MMP-9与抗凋亡因子 Bcl-2的表达量均见减少,同时增加了促凋亡因子Bax的表达量。
综上所述,T4O可能通过靶向PTPN1与PTPN2来抑制胶质瘤的增殖、侵袭与迁移,并促进其凋亡。T4O展现了其抗胶质瘤的潜在价值,有望成为治疗高低级别胶质瘤的有效药物。

