新冠肺炎疫情对医院药物临床试验的影响及对策研究
□ 傅志英 FU Zhi-ying 刘晓红 LIU Xiao-hong 赵淑华 ZHAO Shu-hua 袁延楠 YUAN Yan-nan 江旻 JIANG Min
新型冠状病毒肺炎(COVID-19)疫情期间实施隔离措施和出行限制,对药物临床试验造成较大影响[1]。药物信息协会(Drug Information Association,DIA)2020年2月发起的一项关于疫情影响的问卷调查结果显示:疫情期间,受试者无法或延期随访占比71.59%,无法入组占比67.05%,无法及时供药占比39.77%[2]。刘小宝等2020年2月初对中国境内临床试验机构调查显示,疫情期共有 335 家机构(占调查总数 92.29%)暂停承接、启动新的临床试验项目,暂停已启动项目的受试者入组[3]。Medidata网站数据显示,全球范围内2020年4月试验新入组受试者较2019年10月下降70%[4]。艾昆纬(IQVIA)数据显示2020年4月暂停的肿瘤临床试验数量为3月的2倍[5]。
我院地处北京,属国内外知名肿瘤临床研究中心。抗肿瘤药物临床试验具有试验周期相对较长、随访次数多、受试者病程复杂等特点[6-7],受试者和临床试验工作人员在疫情期间进行临床试验面临的风险和挑战更大。因此,分析与评估疫情下我院临床试验管理策略及效果对国内外其他临床研究中心具有借鉴意义。
资料与方法
本研究分析疫情对我院临床试验的影响,总结疫情期间我院临床试验项目和受试者管理方面的应对策略,评价疫情期间的管理效果。
1.研究资料。通过医院信息系统(Hospital Information System,HIS)和医院临床试验管理系统(Clinical Trial Management System,CTMS)收集疫情期间(2020年2月1日至7月31日)及非疫情期间(2019年2月1日至7月31日)临床试验数据。
2.评价指标。受试者管理以方案依从率和受试者出组率为评价指标。
3.统计方法。通过卡方检验比较疫情早期(2020年2月1日至14日)与疫情中后期(2020年2月15日至7月31日)的方案依从率差异;通过卡方检验比较2020年2月至7月与2019年2月至7月的方案依从率、受试者出组率差异,以评价疫情期间管理效果。
结果
1.疫情对我院药物临床试验的影响。疫情期间,北京市采取了一系列防控措施使我院临床试验受试者返院随访和用药发生困难,临床试验方案依从率降低,各项目试验进度受阻。疫情早期,我院有202个药物临床试验项目受到疫情影响,其中国际项目39项,国内项目163项,占总在研药物试验项目31.36%,受影响的项目类别包括注册类药物临床试验(Investigation New Drug,IND)184项(占总在研IND的36.94%)和研究者发起临床试验(Investigator Initiated Trial,IIT)18项(占在研IIT12.33%),详见图1。分期方面,I期-IV期受疫情影响项目数分别为65项、55项、79项、3项,其中I期临床试验受疫情影响程度最高,达在研总I期项目数的41.67%,详见图2。疫情早期未按方案访视例次与未按方案给药例次分别为297次和639次,较去年同期增涨2倍、28倍(详见图3)。疫情早期受试者完成门诊及住院访视642例次,方案依从率为40.68%。
2.我院采取的针对性措施
2.1 受试者管理。机构与临床研究团队在精细化、差异化管理的基础上,对在研项目受试者进行梳理与妥善安排,采取的措施以保护受试者权益为宗旨。
(1)预约制返院访视用药。与受试者充分沟通,鼓励有条件者来院访视,并对其进行细致防护指导。安排受试者进行门诊预约随访、门诊预约取药;对需住院治疗的受试者进行核酸检测、胸部CT排查,住院期间合理安排病床间隔。
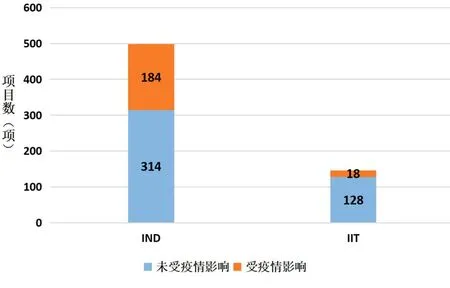
图1 疫情对项目影响
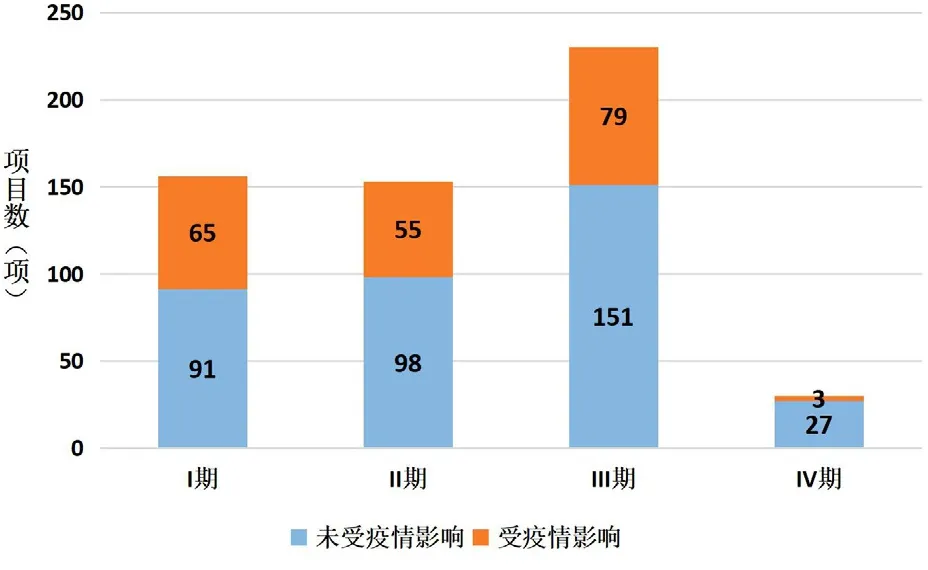
图2 处于不同试验周期项目受影响情况
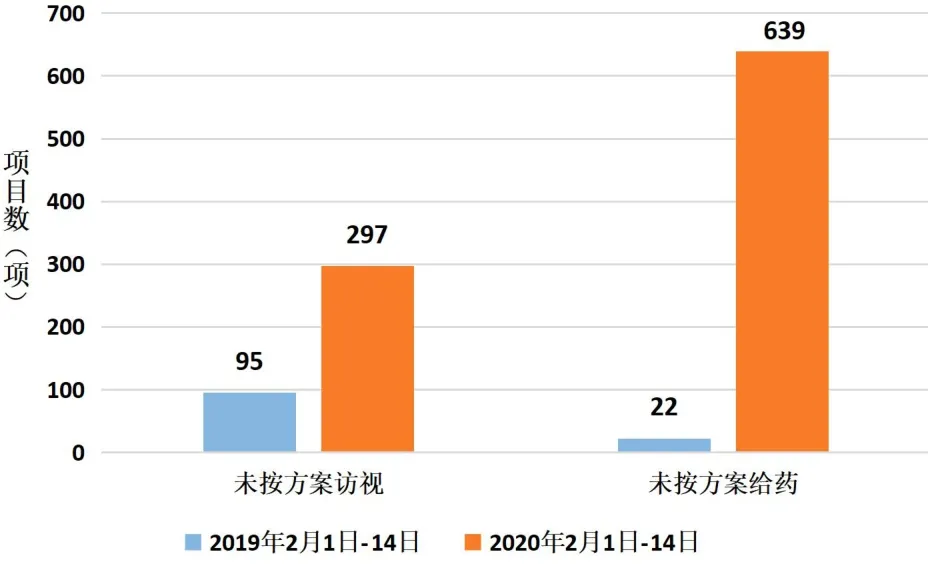
图3 疫情对试验方案执行的影响
(2)远程访视。针对无法来院的受试者,妥善安排其在当地医院进行访视检查。当地医院的选择采取就近原则,优先考虑该项目的其他参研中心,其次为有临床试验资质的医院,再次为其他医院。研究医生通过社交媒体(电子邮件、微信或者传真)等方式远程审阅检查结果并做好病历记录。
(3)远程给药。邮寄药品(Drug Delivery to Patients,DDP),对于无法来院的口服试验用药受试者,研究者通过电话、网络查阅受试者检查、检验结果确认可继续用药后,研究者按照机构颁布的《应对重大突发公共卫生事件的试验药物邮寄发放标准化操作流程》将试验药品寄出给受试者并保留各步骤记录,受试者寄回所有相关资料。
(4)更改给药方式。通过协商并快速进行方案修订、伦理审查备案,将静脉给药改为同一性质药物的口服方式(如依托泊苷),减少受试者在院时间,降低感染风险同时保障受试者的治疗。
(5)转移受试者。遵守相关流程,我院研究者与受试者所在地研究中心进行密切联系与沟通,将受试者既往治疗资料传输给当地研究中心,安排无法来院的受试者在当地研究中心进行试验药物的静脉输注。
(6)互联网诊疗。医院于2020年6月底借助“云病历”系统,开展在线复诊业务。医生在线查阅临床试验受试者病历、视频问诊,开具处方,预约检查检验项目。
受试者访视和治疗安排详见图4。
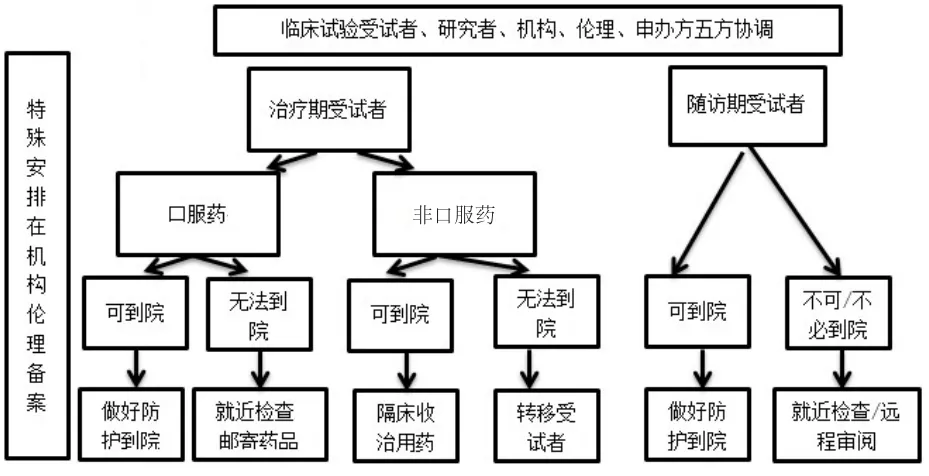
图4 疫情期间受试者访视和治疗安排
2.2 项目管理
(1)远程立项。我院及时改变工作模式,利用打通内外网的CTMS将日常工作由线下转为线上。申办方或合同研究组织(Contract Research Organization,CRO)可远程在线进行项目的立项审核申请。
(2)远程启动。疫情期间机构与主要研究者根据项目的紧急程度及风险,酌情采取远程方式启动新项目。
3.针对性措施的应用效果。2020年2—7月,我院通过远程方式进行118项临床试验立项,远程启动新项目74项,入组148人,疫情期间立项数、启动数、入组数与2019年2月至7月相比分别下降0.85%、0.97%和602%。截至7月31日全院在研IND和IIT项目数合计718项,在研受试者3718人。
HIS数据显示,受疫情影响我院2020年2月临床试验患者门诊及住院人次均明显下降,在采取针对性措施后,门诊及住院人次逐月上升(详见图5)。医院通过沟通协调、远程访视、远程给药、更改给药途径、转移试验患者等方式保证了3105例次临床试验患者访视或给药,使临床试验方案依从性达到85.24%(表1)。采取针对性措施后疫情中后期我院临床试验方案依从率提高,与疫情早期相比差异有统计学意义(p<0.01),显示疫情期间的针对性措施有一定效果。
2020年2—7月我院临床试验患者因结束试验、疾病进展、副作用较大、延迟给药超过方案规定期限、失访、受试者意愿等原因而出组的总数为1000人,出组率为26.89%。卡方检验显示虽然2020年疫情期间方案依从率低于2019年同期(p<0.01),但疫情期间出组率与2019年同期相比,差异无统计学意义(p=0.964),提示疫情对临床试验方案依从造成影响,但疫情期间及时采取的措施使疫情未对方案整体实施造成较大影响。
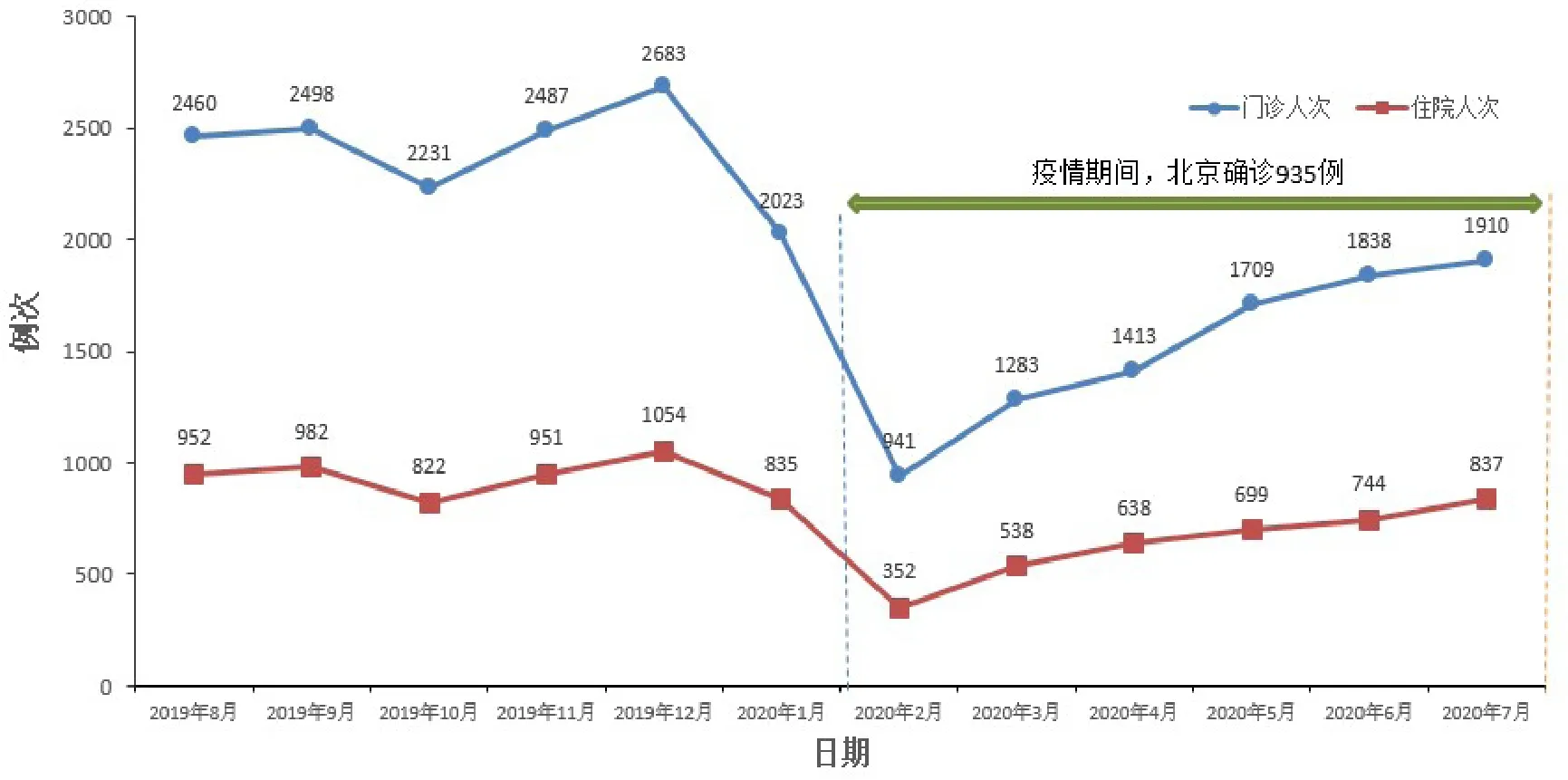
图5 疫情前与疫情期间临床试验患者门诊和住院情况
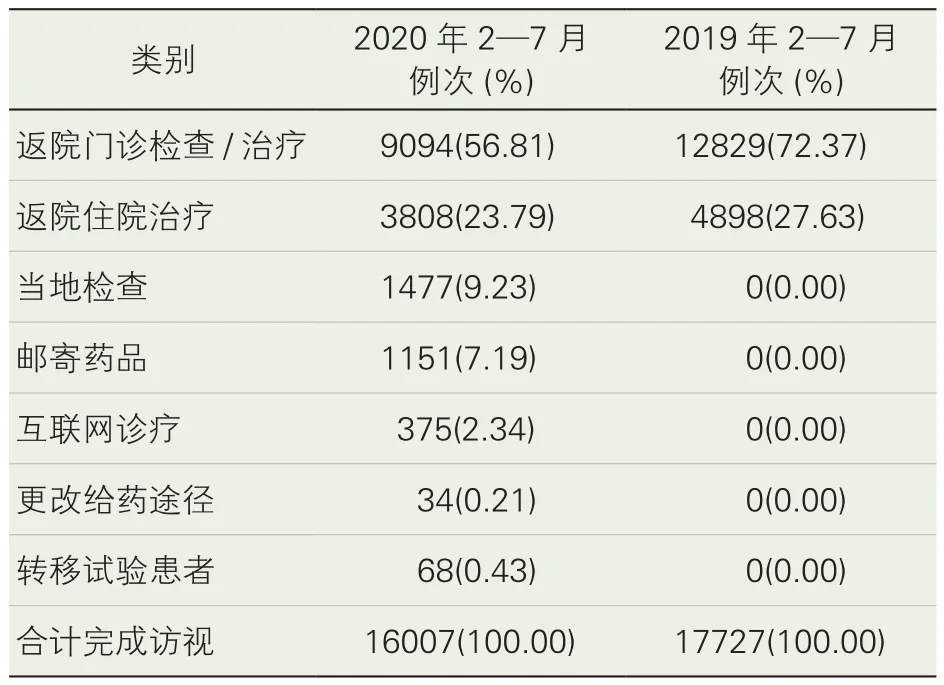
表1 试验受试者访视情况
讨论
新冠肺炎疫情对临床试验造成较大冲击。本研究结果显示,疫情早期14天内,我院受影响的项目达30%,以IND项目和I—III期临床试验为主,其中I期临床试验项目受影响最大,主要因为这类临床试验需要的现场干预措施较多,用药和访视较为密集。抗肿瘤药物临床试验通常需要每1—2周给药1次,因此疫情早期未按方案给药的情况较去年同期上升明显。无法按试验方案访视和给药导致受试者治疗效果受到影响,也影响到试验数据的真实性和完整性,进而影响试验结果。
美国FDA[8]、欧盟[9]和ACRO(CRO行业协会)[10]和我国国家药品监督管理局药品审评中心[11]均发布了疫情期间临床试验的指导原则,但医院仍然存在落地执行问题。疫情期间临床试验如何动态化、弹性化管理均考验临床试验机构的能力、水平与成熟度。
我院采取远程立项、远程启动等方式,使疫情期间立项数与启动项目数与去年同期基本一致,高于国内外其他研究[3]。方案依从率与受试者出组率是评估临床试验执行情况的重要指标。疫情期间,我院采取了针对性紧急措施使我院疫情中后期受试者试验方案依从率(89.33%)显著高于疫情早期(40.68%),访视及用药比例高于国内平均水平[2],但不及去年同期水平,其中远程访视和远程给药解决约20%受试者访视与用药问题。受试者在疫情期间可能会因为交通、隔离等因素限制,超过试验方案规定的访视和用药期限,或出现失访、受试者害怕感染等原因而出组,导致出组率增高。疫情期间机构与研究者应保持沟通,及时了解和解决受试者面临的影响访视与用药的困难,降低受试者出组率。本研究通过这些方面的努力,使相应的指标与2019年同期相比未出现统计学意义上的差异,显示我院采取的应对措施有效果。
疫情期间,我院陆续启用并实现了临床试验的远程立项、远程启动、远程访视和远程给药。限于技术原因,疫情期间我院未启用远程知情模式,使疫情期间新受试者入组人数比2019年2—7月入组人数下降了6倍,需要进一步改进。
结论
突发公共卫生事件对医疗机构开展临床试验造成不利影响,利用信息技术与受试者保持沟通,通过分层管理、统筹协调等积极应对措施,鼓励受试者在保障自身安全的情况下返院访视治疗。通过远程立项、远程启动、远程访视、远程给药等方式建立远程临床试验管理模式,尽量保障受试者治疗、安全,使医院临床试验项目正常运行,可为日后突发公共卫生事件临床试验管理提供参考和借鉴。此外,疫情期间使用的应急远程临床试验管理模式也可转化为常态管理方式,在合规性和智能化方面加以改进,方便受试者参与临床试验的同时,减轻受试者参与试验的间接费用负担。

