富营养化湖泊蓝藻-芦苇碎屑堆积分解过程及其潜在的共代谢效应*
石瑞洁,马 杰,吕成旭,许晓光,党馨逸,蒋燕妮,叶 子,吴懿婷, 王国祥
(1:南京师范大学环境学院,南京 210023)(2:江苏省地理信息资源开发与利用协同创新中心,江苏省环境演变与生态建设实验室,江苏省水土环境生态修复工程实验室,南京 210023)
近年来,湖泊富营养化已成为全球突出的水环境问题之一[1].据统计,截止2019年,我国已超70%的湖泊出现不同程度的富营养化现象[2].与一般湖泊相比,富营养化湖泊中藻华暴发或水草疯长会导致大量藻草生物碎屑在水-沉积物表面堆积分解,显著改变湖泊生源要素的循环强度[3].以太湖为例,在风力和湖流的共同作用下,大量藻类残体在湖湾、湖滨带、侵蚀漕以及挺水植物群丛等区域与水生植物、外源有机物等混合堆积腐解,并向水体释放大量营养盐及各类有机物质,在局部区域甚至会引起“湖泛”或“黑水团”等水环境问题[4-6].因此,需要特别关注富营养化湖泊藻草堆积区有机碎屑的分解过程.
随着浅水湖泊富营养化问题的日益加剧,大量研究关注水生植物残体或藻类碎屑分解对水质的影响[7-9].已有结果表明,不同水生植物在各个季节腐烂分解对水质的影响差异较大,且春季矿化速率要明显高于冬季[10].挺水植物茭草和芦苇残体衰亡后会快速释放大量营养盐,同时上覆水中溶解性有机物(DOM)的化学结构特征也会随时间的推移而发生变化[11].在藻型富营养化湖泊中,DOM主要来源于藻类[12],且藻源性颗粒有机物降解会快速释放氮磷营养盐和溶解性有机碳(DOC)[4].湖泊生物残体分解释放养分和有机质的过程受多种因素制约[13],如植物种类和化学组成、pH大小、微生物群落结构、水文情势等[10].初始成分中氮、磷含量越高的植物残体往往分解速率越快,而初始纤维素、半纤维素、C/N和C/P越高的植物分解速率越慢[8].一般而言,藻类碎屑的分解速率比水生植物更快,这与藻类碎屑的理化性质密切相关,主要是由于藻类具有更大的比表面积和更高的N/P[14-15].然而,这些研究大多针对单一水生植物或藻类分解对水质的影响,对水生态系统多来源生物碎屑的混合分解过程尚缺乏深入了解.
有研究报道水环境中可能存在类似陆生生态系统的“共代谢效应”,即向系统中输入易分解物质(包括粪便、凋落物以及根系分泌物等)能激活系统微生物活性,加速整体有机质代谢速率[16-17].在以往的调查中,课题组发现芦苇和蓝藻混合分解会导致上覆水pH和溶解氧(DO)迅速降低,且对水质的影响呈现一定阶段性[18].Kuzyakov等研究表明在混合体系中,如存在多种有机碎屑,微生物可能会优先分解可利用率较高的物质,同时促进微生物大量繁殖[19].当易分解物质不再满足微生物需求时,这些微生物不得不利用相对难分解的物质,从而加快整体的代谢速率[20].在富营养化湖泊中,藻类碎屑结构简单,更容易被微生物利用,而芦苇碎屑组成相对复杂,藻-草碎屑在水-沉积物表面大量混合堆积能否通过共代谢效应向水体释放更多的污染物质尚不清楚.
本研究构建微宇宙系统,模拟蓝藻和芦苇碎屑单独分解及混合分解过程,分析比较各处理组上覆水营养盐浓度、有机质含量及结构的变化规律,阐明富营养化湖泊藻草残体混合分解过程中碳、氮、磷的释放特征,探讨藻草混合分解过程是否存在共代谢效应,旨在为深入研究富营养化湖泊近岸带不同有机物混合分解对水环境质量以及物质循环过程的影响提供科学依据.
1 材料与方法
1.1 实验样品采集
芦苇、蓝藻和沉积物均采自太湖西岸沙塘港附近(31°25′25.38″N, 120°1′54.32″E).新鲜蓝藻用清水冲洗过滤后冷冻干燥,自封袋密封低温保存;芦苇洗净杀青后研磨备用;沉积物过150 μm筛混匀,避光备用,沉积物在常温下预培养3个月,使不稳定的有机物质尽量矿化,同时也使沉积物中营养盐释放,尽量减少沉积物对后续培养实验的影响.
1.2 实验设计
本研究采用透明PET聚酯塑料瓶(D=10 cm, H=20 cm),向其均匀填充100 g沉积物(溶解性总碳(TOC)、总氮(TN)、总磷(TP)含量依次为15.1、0.91、0.72 mg/g),以玻璃棒引流缓慢加入湖水500 mL(湖水经76 μm筛网过筛处理),静置1周,保持上覆水和沉积物中碳、氮、磷含量处于动态平衡.实验共设置4个处理组(内含1个对照组),且每个处理组设置3个重复,为了保持各处理组初始有机碳总量一致,添加的蓝藻和芦苇初始干重分别根据其有机碳含量进了换算;同时,为了尽量降低沉积物中有机碳作为背景浓度的影响,添加了相对较高碳含量的蓝藻和芦苇.(A)对照组:100 g沉积物;(B)蓝藻组:100 g沉积物+ 6 g蓝藻(干重);(C)芦苇组:100 g沉积物+ 5.8 g芦苇(干重);(D)混合组:100 g沉积物+ 3 g蓝藻(干重)+ 2.9 g芦苇(干重)(初始芦苇中TOC、TN、TP浓度分别为(394.07±5.23)、(15.01±1.11)、(2.70±0.01)mg/g,初始蓝藻中TOC、TN、TP浓度分别为(380.93±3.45)、(62.92±1.55)、(8.18±0.86)mg/g.采用水浴加热,温度控制在(30±2)℃,于避光条件下连续培养14天.采样时间分别为第12、24、36、48、60、72、84、96、108、120、132、156、180、204、228、324小时,每次取出12个瓶子(共计192个),破坏性采样16次.用注射器取出全部上覆水,并按规范要求保存(《水质采样样品的保存和管理技术规定》HJ 493-2009),24 h内完成测试.沉积物样品经冷冻干燥后用于测定脂肪酸含量.
1.3 测定指标与方法
采样时,缓慢从各组中取出聚酯塑料瓶,尽量不扰动上覆水和表层沉积物,采用便携式水质分析仪(YSI,美国)在水深1/2处测定水体溶解氧(DO)浓度和pH值.用注射器抽取上覆水100 mL,并经0.45 μm玻璃纤维膜抽滤.TN浓度用碱性过硫酸钾氧化-紫外分光光度法测定(GB 11894-1989),TP浓度采用钼酸铵分光光度法(GB 11893-1989)测定,总碳(TC)和TOC浓度采用multi N/C 3100型总有机碳分析仪测定(德国Jena公司)(水样预先通过0.45 μm玻璃纤维膜,再根据实际情况进行稀释处理).取不同处理组上覆水样品置于四面石英比色皿中进行三维荧光光谱扫描,采用Hitachi F 7000型荧光光度计(日本日立公司)测定,光谱仪扫描范围为激发波长/发射波长(Ex/Em)=200~450 nm/250~600 nm,激发波长及发射波长的带通分别为5和2 nm,待扫描结束后使用绘图软件将Ex/Em所对应的荧光强度进行处理,绘制等高图.
采用一步法提取并酯化所有的脂质生成脂肪酸甲酯(FAMEs)[21].使用气相色谱-质谱联用仪(GC-MS,Thermo Trace 1310,美国)对样品进行定量分析,该气相色谱仪配备一个安捷伦DB-5MS石英毛细管柱(60 m×0.32 mm×0.25 μm).升温程序如下: 初始温度为80℃,保持1 min,以25℃/min升温至189℃,再以5℃/min升温至310℃,保持30 min,进样口温度为310℃.通过比较样品中脂肪酸的峰面积,计算每克干样中的脂肪酸含量(μg/g);通过比较各脂肪酸的峰面积与样品中所有脂肪酸的总峰面积,定性地(以百分比计)计算出各脂肪酸的组成.利用∑17脂肪酸含量表征细菌丰度[22].
1.4 数据计算分析
采用一阶动力学方程描述各处理组TC浓度的动态变化[23],假设释放过程分为快速释放和缓慢释放两个阶段.其中,缓慢释放阶段的速率较慢,为简化计算,本研究假设缓慢释放阶段的反应速率近似为0,则方程可以写成以下形式:
Ct=(C1)0exp(k·t)+(C2)0
(1)
式中,k为快速分解阶段TC的分解速率,Ct为t时刻的TC浓度,(C1)0和(C2)0分别是2个阶段初始的TC浓度.
定义PE为t时刻混合组的浓度与理论值之差:
PE=Ct(混合组)-Ct(理论值)
(2)
Ct(理论值)=1/2(Ct(蓝藻)+Ct(芦苇))
(3)
式中,Ct(蓝藻)和Ct(芦苇)分别表示单一的蓝藻和芦苇处理组在t时刻释放的TC浓度.本研究中,主要通过PE的大小评估两种有机碎屑混合过程是否加快整体溶解性碳的分解速率.此外,TN、TP也依照上述处理方法,并计算PE大小,分别记为PETN和PETP.
使用Excel软件进行数据整理,运用Origin 2018 软件绘制图形.
2 结果与分析
2.1 藻草混合分解过程中上覆水DO浓度及pH变化
藻草混合分解过程中上覆水DO动态变化如图1a所示,各处理组中DO浓度均呈先快速降低再逐渐稳定的趋势.实验进行到60 h时,蓝藻组、芦苇组和混合组DO浓度分别下降了93.5%、86.0%和88.9%.各处理组中上覆水pH在12~24 h有所降低,而后上升直至稳定(图1b).培养过程中,蓝藻组、芦苇组和混合组上覆水pH分别在6.42~7.9、6.71~7.41和6.54~7.91之间变化.当培养结束时,各处理组均呈现弱碱性,其中对照组上覆水pH最高,芦苇组pH最低.
2.2 藻草混合分解过程中上覆水水溶性碳浓度变化
各处理组上覆水中TC浓度变化如图2所示.对照组中TC浓度变化较小,平均浓度分别为(28.56±6.63)mg/L,而实验组均呈先上升后趋于平缓的趋势.蓝藻组TC浓度在第228小时达最大值(372.4±4.55)mg/L.芦苇组和混合组的TC浓度均在36 h达最大值,依次为(117.4±3.99)和(221.85±2.98)mg/L.结果表明PETC值仅在第2~88小时为正(混合组的释放速率大于理论值).其中,在第25小时,PETC最大为27.47 mg/L,即TC释放量较理论值提高了21.69%,因此,研究认为草藻混合分解促进了碳的排放.
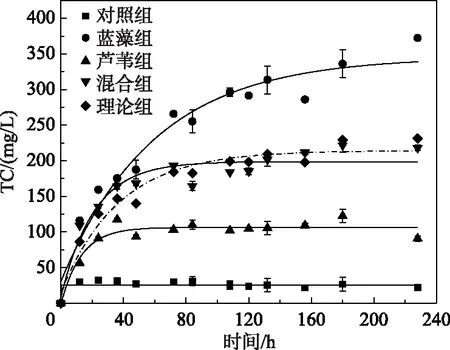
图2 藻草混合分解过程中上覆水TC浓度动态变化
各处理组中上覆水TIC和TOC浓度变化如图3所示.对照组中TIC和TOC浓度变化较小,平均浓度分别为(24.44±7.06)、(3.53±1.50)mg/L,而实验组均呈先上升后下降的趋势.蓝藻组TIC浓度在第228 h达最大值(179.00±4.55)mg/L.芦苇组和混合组的TIC浓度均在第228小时达最大值,依次为(85.8±3.31)和(144.4±2.18)mg/L.蓝藻组TOC浓度在第156小时达最大值(244.2±2.38)mg/L,混合组在第180小时达最大值(118.65±1.87)mg/L.
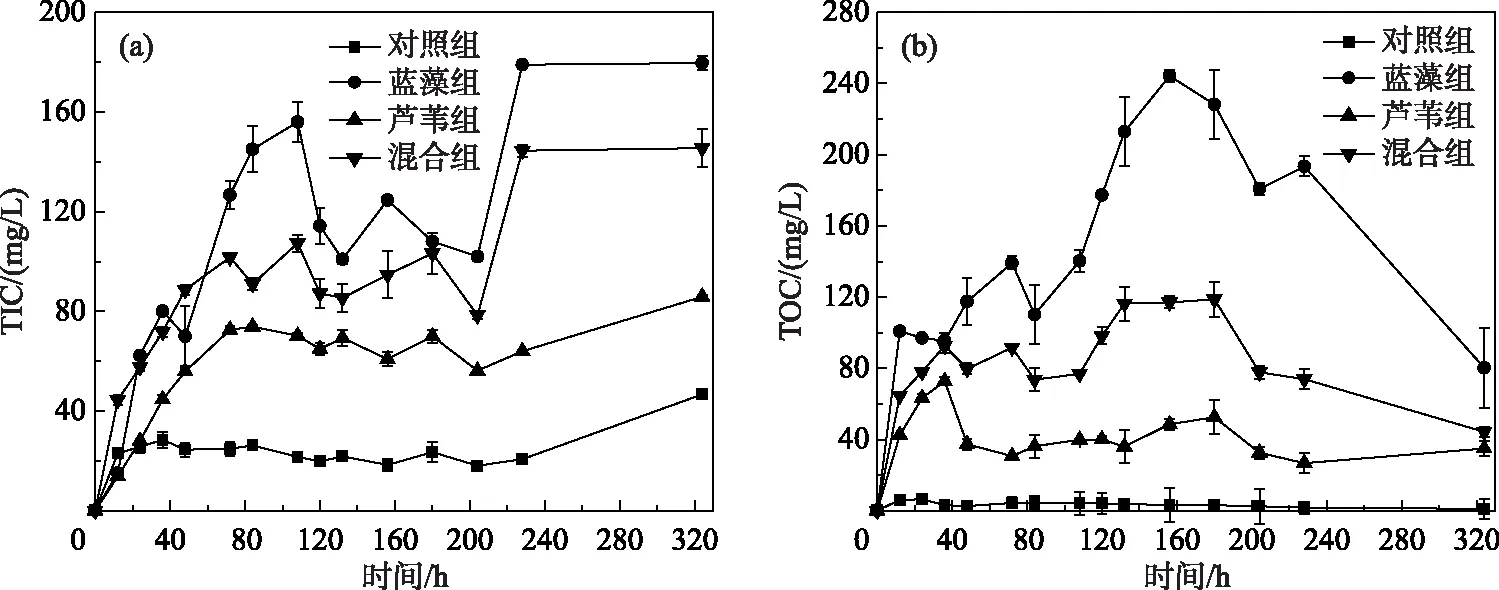
图3 藻草混合分解过程中上覆水TIC(a)和TOC(b)浓度动态变化
2.3 藻草混合分解过程中上覆水水溶性氮、磷浓度变化
藻草混合分解过程中,各处理组上覆水TN浓度变化趋势基本一致,均呈先上升,后逐渐平稳的趋势(图4a).TN浓度由高到低依次为蓝藻组、混合组和芦苇组.其中,蓝藻组和混合组均在第156小时达到最大值,依次为(140.3±3.33)和(77.5±2.97)mg/L,而芦苇组在第120小时达到最大值, 为(23.0±2.23)mg/L.TP浓度总体呈先上升后逐渐平稳的趋势(图4b).相较TN,实验组TP浓度波动较大,且最大值出现的时间差异明显,蓝藻组和混合组分别在第324和228小时达到最大值,依次分别为(7.95±2.09)和(3.94±0.10)mg/L,而芦苇组TP浓度在第180小时达最大值,为(1.74±0.97)mg/L.
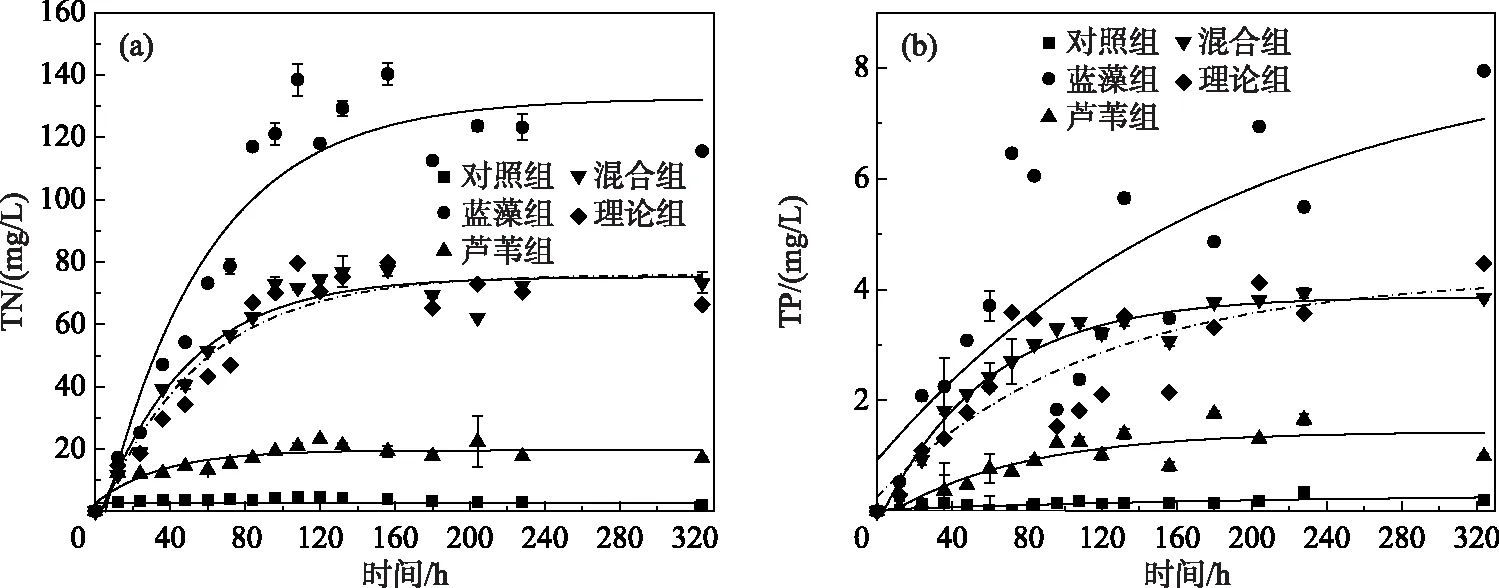
图4 藻草混合分解过程中上覆水TN(a)和TP(b)浓度动态变化
比较PETN随时间的变化特征,注意到PETN在第2~201小时为正值,即表明在这期间混合处理组TN的释放量高于两种碎屑单一处理组的均值.其中,在第28小时,PETN取得最大值3.48 mg/L,相较理论值提高了13.49%.类似地,计算得到PETP值在第17~260小时为正值,其中第82小时,PETP值最大,为0.62 mg/L,相较理论值提高了26.84%.
2.4 藻草混合分解过程中上覆水DOM的结构变化
通过三维荧光光谱分析不同时期(第108、204、324小时)各处理组上覆水DOM的结构组成特征(图5).结果表明,分解过程中各处理组三维荧光光谱的荧光峰强度(FI)、荧光峰中心位置和荧光指数具有一定差异性.各处理组上覆水DOM荧光峰类型主要包括类蛋白A峰、类蛋白C峰和类富里酸D峰.其中,蓝藻组上覆水DOM主要以类蛋白质为主,芦苇组上覆水DOM主要以类蛋白质、类富里酸为主,混合组上覆水DOM主要以蛋白质、类富里酸为主.随着分解过程进行,所有处理组中类蛋白质的FI值均逐渐下降,类蛋白荧光峰A和C的FI值由大到小依次是:蓝藻组>混合组>芦苇组.蓝藻组初期和末期FI值分别为303.8和50.4,芦苇组初期和末期FI值分别为88.6和21.4,混合组初期和末期FI值分别为166.4和25.0,而类富里酸的FI值有所增加(表1).进一步比较相同时间内芦苇组和混合组中类富里酸FI的变化情况,芦苇组和混合组中类富里酸FI的变化速率分别为1.27和1.42 d-1.
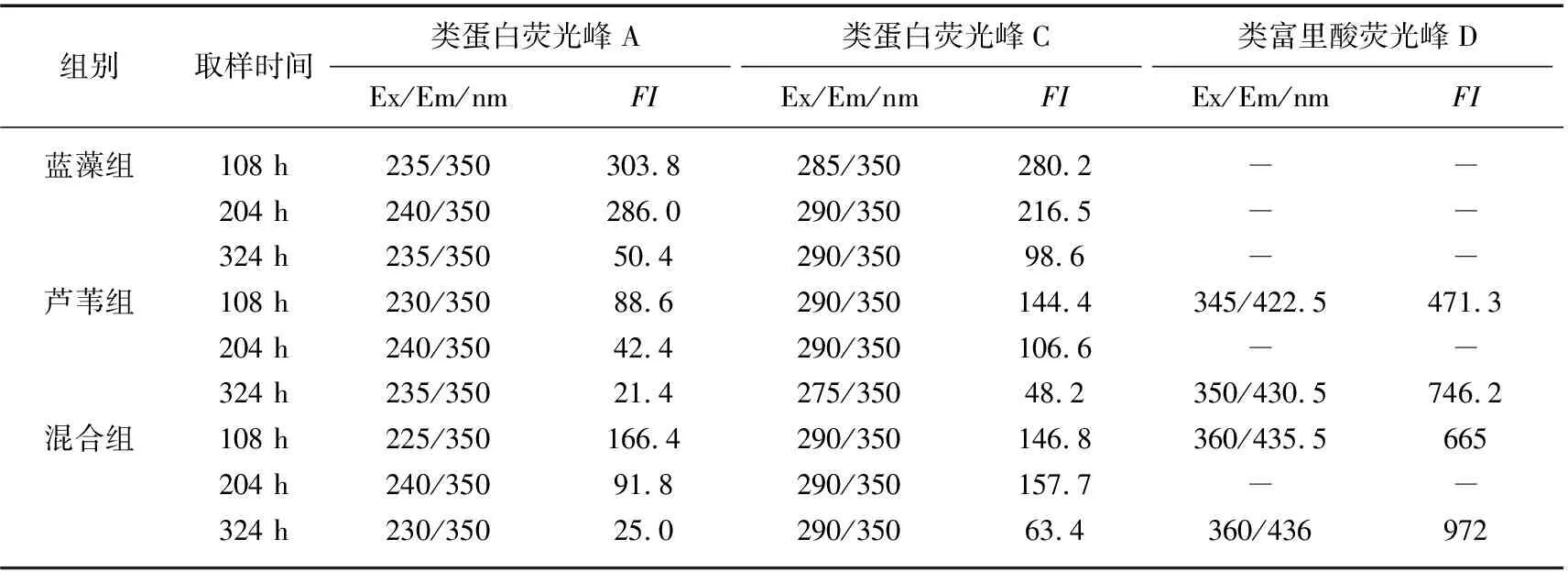
表1 上覆水中DOM荧光特性变化规律
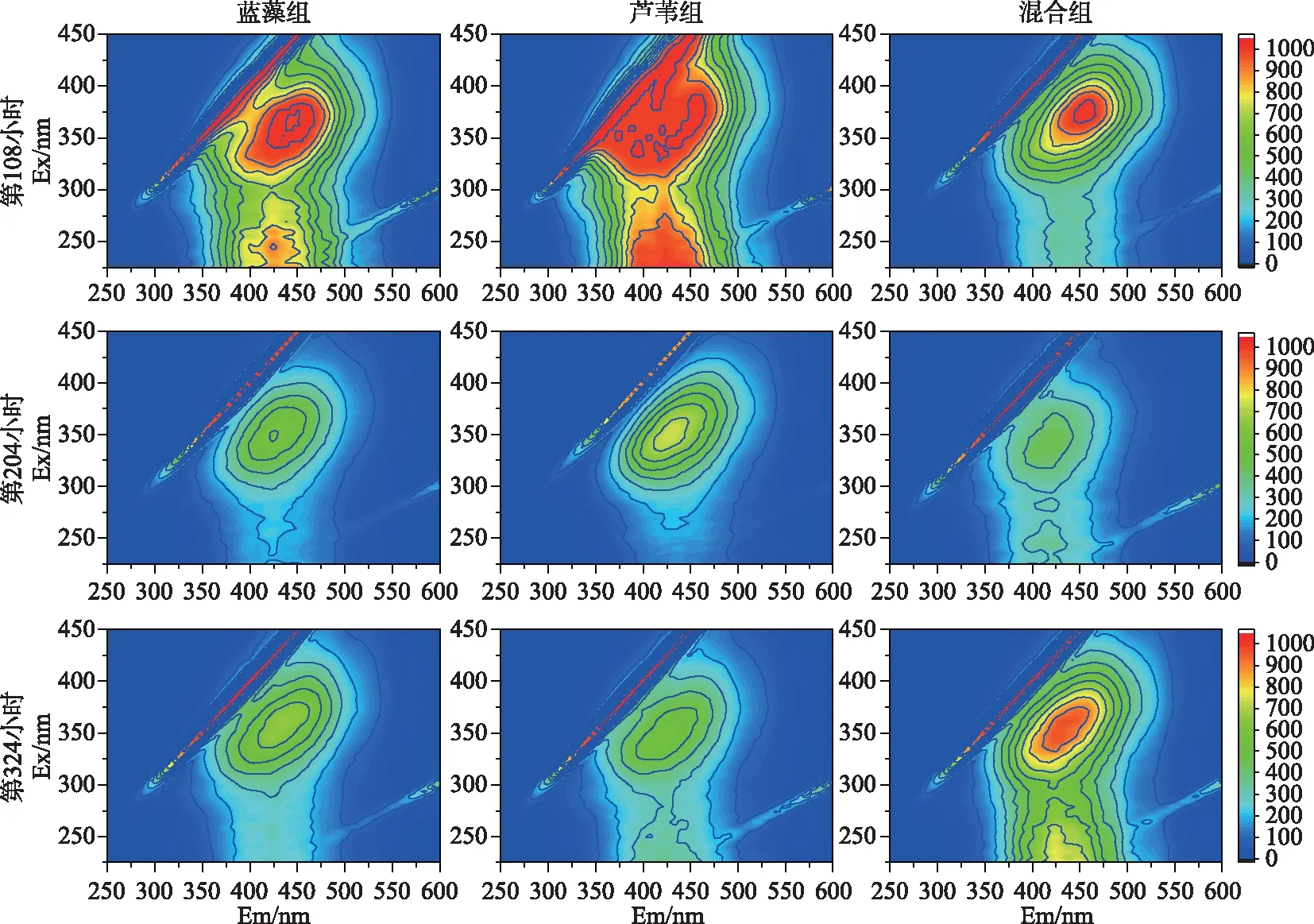
图5 藻草混合分解不同时期上覆水DOM三维荧光光谱
2.5 细菌特异性脂肪酸含量的变化
∑17脂肪酸是一种典型的细菌特异性脂肪酸,通常用来阐明细菌对不同有机碎屑的利用情况[22].本研究测定了各处理组在培养前期、中期、后期沉积物中的细菌特异性脂肪酸含量.结果表明,除芦苇组外,其他各组中细菌丰度在培养初期后立即增加.在单一芦苇处理中,细菌丰度在324 h后达到峰值(图6).总体而言,蓝藻组的细菌特异性脂肪酸含量明显高于芦苇组和混合组.
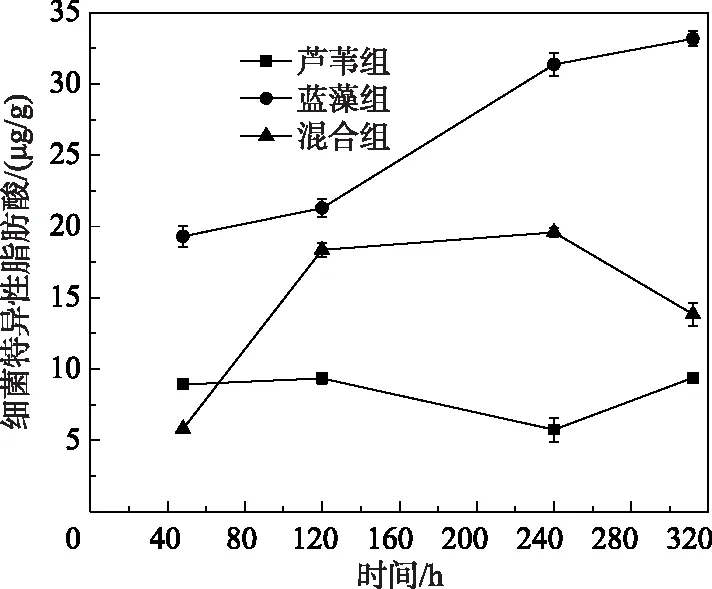
图6 培养过程中细菌特异性脂肪酸含量的变化
3 讨论
浅水湖泊中有机物来源十分复杂,包括外源和内源有机碳.其中,外源有机碳主要来源于土壤侵蚀和入湖河流携带的陆源有机碎屑等;内源有机碳主要来源于湖泊水生植物和浮游藻类残体及其分解产物[24-25].在以藻类为主的富营养化湖泊中,内源是有机碳形成的主要原因,尤其在水华暴发期间,大量藻类碎屑在湖滨带、湖湾以及挺水植物群丛中聚集、沉降和分解,显著改变湖泊碳循环强度[26-27].本研究通过模拟富营养化湖泊中蓝藻和芦苇碎屑单独分解及混合分解过程,揭示了湖泊藻草残体混合分解过程中碳、氮、磷的释放特征.
本研究中,在添加相同含量有机碳条件下,我们计算得到培养的前88 h内PETC为正值,表明实验初期蓝藻和芦苇混合分解过程存在共代谢效应,并通过共代谢效应促进了整体有机碎屑分解,向水体中释放更多溶解性碳.一般而言,在有机物厌氧分解过程中,会同时存在沉积物中的污染物因浓度梯度向水体中扩散的过程与微生物的分解作用释放污染物的过程;本实验中,由于沉积物经过长期的预培养,且实验中添加的蓝藻和芦苇的碳含量远远超过了沉积物的背景值,此外,实验添加湖水后还进行了预培养,保持了碳、氮、磷释放的动态平衡,因此基本可以排除沉积物释放的影响,主要为微生物作用过程.激发效应的概念最早由土壤学家提出来,指输入相对“不稳定碳”能够改变土壤有机碳矿化过程的一种机制[28].激发效应主要包括微生物分解、动物利用等作用,而其中的关键微生物过程我们称之为“共代谢效应”.与环境工程中共代谢作用不同的是,它不是一种在初级能源物质存在时才能进行的某一种或者某一类平时不能够利用的有机化合物的生物降解过程,而是讨论一种容易分解的有机物质对另一种难降解物质的促进作用.已有研究表明施用粪肥、植物残体凋落及释放根系分泌物等过程均会刺激土壤有机质激发强烈的共代谢效应[29-30].尽管共代谢效应已在陆生生态系统中广泛报道,但直到2010年共代谢效应的概念才被引入水环境中,因此相关研究仍比较匮乏[31-32].相较于芦苇碎屑,蓝藻颗粒小,表面积大,且N/P更符合微生物的生长需求,因而蓝藻碎屑的周转速率更快[14-15],两者物质组成的差异也为共代谢效应的发生提供了条件.通常有两种机制来解释共代谢效应的发生过程,一是“不稳定碳”的输入激发了微生物的生长和胞外酶的活性,进而促进了有机碳的分解过程[28];二是“不稳定碳”的输入增加了系统中土著微生物的生物量,提高了整体有机碳的分解速率[33].
通常情况,微生物在一些不利于生长的环境中往往处于“饥饿”状态,当加入易分解碳源能快速激发微生物活性,促进有机质分解[34].在培养初期,混合处理组共代谢效应的增加可能归因于添加蓝藻碎屑激活了系统微生物,进而加速了芦苇碎屑的分解.有研究指出,系统中如果存在多种有机质,微生物可能会优先分解利用率较高的有机质,这可能是引起分解进行48 h后共代谢强度下降的可能原因[34].随着蓝藻碎屑被微生物快速利用,在156 h后蓝藻处理组和混合处理组TC和TOC释放速率逐渐下降.此外,水体一部分有机质在厌氧条件下会产生甲烷和二氧化碳等气体逸出,这也可能会降低TC和TOC释放速率[35].相较芦苇组,混合处理组中FI变化速率更大,说明混合处理组中类富里酸形成速率相对更快,即表明混合组中芦苇的分解速率更快.有研究表明由于有机物分解过程中微生物种类繁多,并不能简单通过微生物种群变化来表征共代谢效应的强弱,而是通过微生物丰度来间接表征有机物的分解快慢,本研究中,所有处理组细菌特异性脂肪酸(∑17脂肪酸)含量在第一周内迅速增加,说明添加新鲜有机物质可能刺激了细菌生长.而在前156 h,混合处理中∑17脂肪酸含量的快速变化过程也证明混合体系中存在共代谢效应.后续研究还需要进一步分析酶的活性等来验证该过程.值得注意的是,自然生态系统中,外源碳的输入过程往往存在一定频率,例如农田中的粪肥和秸秆等,森林和草地土壤中的根系分泌有机物和植物凋落物等等.类似的,在富营养化湖泊中,浮游藻类源源不断的堆积分解,可能会持续不断引起共代谢效应,促进湖泊生态系统中的碳排放,因而,进一步阐明富营养化湖泊中由藻类引起的共代谢效应过程对湖泊碳循环具有重要意义.
藻草混合分解除释放碳素外,还会向上覆水释放大量营养盐,引起水质恶化等生态问题.研究对比了混合组中TN、TP的释放量与理论值的大小,混合处理组TN在第2~201小时的释放量以及TP在第17~260小时的释放量均明显大于理论值,说明实验初期蓝藻和芦苇混合分解过程还促进了营养物质的释放,进一步加剧了水体的富营养化程度.以往关于共代谢的研究主要关注体系中碳素变化,较少关注营养物质的变化.所有处理组在实验初期TN、TP浓度均有所上升, 可能是有机碎屑体内蛋白质、叶绿素等有机氮分解释放氮素,与植物体C/N密切相关[9,12,36].实验初期微生物代谢消耗大量氧气,DO浓度快速下降(图1a),水体快速处于厌氧环境.自156 h后,各实验组TN浓度均逐渐下降,可能归因于植物在厌氧环境下发生反硝化过程,并促使向大气中释放N2、N2O[3].至第228小时,TN浓度基本趋于稳定.培养结束时,TN、TP浓度从高到低依次为蓝藻组>混合组>芦苇组.在富营养化湖泊中,气候变暖一方面会刺激微生物繁殖,增加有机碳矿化;另一方面也会增加湖泊生产力,引起更多碳沉积.以太湖为例,由于气候变暖等因素造成蓝藻物候条件显著改变,甚至全年可观测蓝藻水华[37].其衰亡沉降后,延长了与植物碎屑的接触共存时间,为共代谢提供了条件[38].随着藻类暴发频次进一步增加,很可能持续激发出正向共代谢效应,并向水体中释放更多营养盐,加剧湖泊富营养化以及对全球气候变暖产生正反馈.
本研究证明了在以藻类为主的富营养化湖泊中存在共代谢效应,能够促使藻草分解向水体中释放更多的营养盐和有机物.考虑在全球气候变暖和湖泊富营养化的双重胁迫下,藻类水华暴发频次和规模均有明显上升趋势[39],共代谢效应对富营养化湖泊的影响可能更大.本研究利用三维荧光强度评估了相对难分解物质的形成速率,进一步从有机物质的化学结构变化来深入分析共代谢效应,但由于采样间隔时间较长,并未捕捉到共代谢强度最大的时刻,后续研究需要加大采样频率.基于富营养化湖泊生态系统来源十分复杂,且易受到干扰,评估藻类有机碎屑代谢过程引起的共代谢效应的变化特征对于阐明富营养化湖泊碳库的动态变化以及调控和改善水体水质等问题都具有非常重要的意义.
4 结论
1)富营养化湖泊蓝藻芦苇混合分解初期存在明显的共代谢效应,并且提高了混合碎屑的分解速率.此外,草藻混合分解过程也通过共代谢效应加速了水体氮、磷营养盐的释放.
2)富营养化湖泊中的蓝藻芦苇混合分解过程明显降低了水体DO浓度,使得水体长期处于厌氧状态,极有可能进一步引起各种水质问题.在全球气候变暖的背景下,随着富营养化湖泊藻类暴发频次增加,共代谢效应可能还会进一步加强,对富营养化湖泊水质将会持续产生影响.

