隔药饼灸对动脉粥样硬化兔血脂及胸主动脉G蛋白偶联胆汁酸受体5的影响
欧阳里知 王晶 刘惠娟 黄河 张彬彬 刘红华 邓加勤 常小荣

〔摘要〕 目的 觀察隔药饼灸对动脉粥样硬化(atherosclerosis, AS)兔血脂及胸主动脉G蛋白偶联胆汁酸受体5(takeda G-protein-coupled receptor 5, TGR5)含量的影响。方法 将40只新西兰雄性兔随机分为空白组、模型组、抗生素组、隔药饼灸组与阿托伐他汀组,每组8只。空白组用普通饲料喂养,采用高胆固醇饲料与丙基硫氧嘧啶[10 mg/(kg·d)]配合的方式制备AS模型。隔药饼灸组(取穴分为“巨阙”“天枢”“丰隆”和“心俞”“肝俞”“脾俞”两组,隔日交替施灸)每穴施灸30 min,每日1次。各组均连续干预12周,检测各组兔血清胆固醇(TC)、甘油三酯(TG)与高密度脂蛋白(HDL-C)、低密度脂蛋白(LDL-C)水平;100倍光学显微镜下观察兔胸主动脉血管壁结构;采用免疫组化法测定胸主动脉TGR5表达量。结果 干预后,与空白组比较,模型组兔血清TC、TG、HDL-C、LDL-C水平均升高(P<0.01),胸主动脉TGR5表达量下降(P<0.01);与模型组相比,隔药饼灸组、抗生素组与阿托伐他汀组血清TC、TG、HDL-C、LDL-C水平均下降(P<0.01或P<0.05),胸主动脉TGR5表达量上升(P<0.01);与空白组比较,模型组血管内壁形态结构明显损伤,隔药饼灸组与阿托伐他汀组血管内壁损伤较模型组轻微。结论 抗生素组、隔药饼灸组和阿托伐他汀组对AS模型兔血脂水平有良性调节作用;隔药饼灸组与阿托伐他汀组有效激活了TGR5的表达,对血管内壁损伤有修复作用。
〔关键词〕 动脉粥样硬化;隔药饼灸;抗生素;阿托伐他汀;G蛋白偶联胆汁酸受体5;血脂水平
〔中图分类号〕R245.8 〔文献标志码〕A 〔文章编号〕doi:10.3969/j.issn.1674-070X.2021.04.008
〔Abstract〕 Objective To observe the effects of herbal cake-separated moxibustion on lipid content of blood and G protein coupled bile acid receptor 5 (TGR5) in thoracic aorta of rabbits with atherosclerosis (AS). Methods 40 New Zealand male rabbits were randomly divided into blank group, model group, antibiotic group, herbal cake-separated moxibustion group and atorvastatin group, with 8 rabbits in each group. The blank group was fed with normal diet, and the AS model was prepared by the combination of high cholesterol diet and propylthiouracil [10 mg/(kg·d)]. In herbal cake-separated moxibustion group [acupoints were divided into "Juque" (RN14), "Tianshu" (ST25), "Fenglong" (ST40) and "Xinshu" (BL15), "Ganshu" (BL18), "Pishu" (BL20), alternated moxibustion on alternate days], moxibustion was adopted on each point for 30 minutes, once a day. Serum cholesterol (TC), triglyceride (TG), high density lipoprotein (HDL-C) and low density lipoprotein (LDL-C) levels were detected in rabbits in each group after 12 weeks of intervention. The vascular wall structure of thoracic aorta was observed under 100 times light microscope. The expression of TGR5 in thoracic aorta was determined by immunohistochemistry. Results After intervention, compared with blank group, the levels of TC, TG, HDL-C and LDL-C in serum of model group were increased (P<0.01), and the expression of TGR5 in thoracic aorta was decreased (P<0.01). Compared with model group, the serum TC, TG, HDL-C and LDL-C levels of herbal cake-separated moxibustion group, antibiotic group and atorvastatin group were decreased (P<0.01 or P<0.05), and the expression of TGR5 in thoracic aorta was increased (P<0.01). Compared with the blank group, the morphology and structure of vascular inner wall of the model group was obviously damaged, and the vascular inner wall injury of the herbal cake-separated moxibustion group and the atorvastatin group was less than that of the model group. Conclusion The herbal cake-separated moxibustion group, antibiotic group and atorvastatin group had a benign regulation effect on the blood lipid level of AS model rabbits. The expression of TGR5 was effectively activated in the herbal cake-separated moxibustion group and the atorvastatin group, which had a repairing effect on the vascular inner wall injury.
〔Keywords〕 atherosclerosis; herbal cake-separated moxibustion; antibiotics; atorvastatin; G protein conjugated bile acid receptor 5; blood lipid level
动脉粥样硬化(atherosclerosis, AS)是一种由多因素引起的慢性疾病,是诱发心血管疾病(cardiovascular, CVD)的主要原因,而CVD是造成人类死亡的重要因素,AS主要病理特点是动脉血管壁上出现异常脂质堆积及炎性反应[1-2]。其发病机制至今未完全明确,但许多研究者发现炎症反应参与AS的发生发展过程,尤其对粥样斑块的稳定性起到至关重要的作用[3-5]。胆汁酸是一种体内的信号分子,其发挥相应生物学效应是在胆汁酸受体介导下进行的[6],G蛋白偶联胆汁酸受体5(takeda G-protein-coupled receptor 5, TGR5),又称M-BAR、BG37等[7]。其表达于单核细胞及多种巨噬细胞中,单核-吞噬细胞能分泌多种炎性介质,在调控炎症反应中具有重要作用[8-9]。已知的TGR5天然激动剂有胆汁酸[10]、齐墩果酸[11]、诺米林[12]等,药物激动剂包括环丙沙星[13]、2-硫代-5-硫甲基[14]以及哌啶甲酰胺5[15]等,均不同程度地激动了TGR5的表达,故本文重在探讨隔药饼灸是否能够有效激动AS兔胸主动脉TGR5的表达,成为激动TGR5手段的一种,为临床预防及治疗AS提供实验依据,现将实验方法及结果报道如下。
1 材料与方法
1.1 实验动物
选用3月龄的健康雄性新西兰纯种兔(清洁级)共40只,体质量1.5~2.5 kg,由湖南太平生物有限公司提供,许可证号:SCXK(湘)2015-0004,每只分笼圈养于动物中心实验室。饲养温度20~25 ℃,湿度50%~70%。
1.2 主要仪器、药物与试剂
1.2.1 主要仪器 台式高速冷冻离心机(H1650R,长沙湘仪离心机仪器有限公司);多功能酶标分析仪(MB-530,深圳市汇松科技发展有限公司);全自动生化分析仪(AU2700,日本Olympus公司);自动平衡离心机(L530,长沙湘仪离心机仪器有限公司);恒温水浴锅(SB-1100,厦门精艺兴业科技有限公司)。
1.2.2 主要药物与试剂 丹参、山楂、郁金、大黄、泽泻(湖南中医药大学第一附属医院中药房,规格:10 g/包);细支艾炷(湖南高圣生物有限公司,规格:5.3 mm×85 mm);甲硝唑片(华中药业股份有限公司,规格:0.2 g×100片);氨苄西林胶囊(圣大药业有限公司,规格:0.25 g×24粒);盐酸万古霉素(中国台湾政德制药股份有限公司,规格:0.5 g×10瓶);硫酸新霉素(批号:N584,salorbio公司);阿托伐他汀钙片(国药准字H20093819,北京嘉林药业股份有限公司);丙基硫氧嘧啶片(国药准字H32020795,精华制药集团股份有限公司,规格:50 mg×100片);TGR5(批号:ab72603,上海艾博抗贸易有限公司);二抗(批号:SA00001,中国Proteintech公司)。
1.3 分组及模型制备
所有新西兰兔适应性喂养1周后,随机分为空白组、模型组、抗生素组(模型+抗生素)、隔药饼灸组(模型+隔药饼灸)、阿托伐他汀组(模型+阿托伐他汀),每组8只。
模型制备的高胆固醇饲料具体配方:胆固醇1%、蛋黄粉10%、猪油5%、正常粗颗粒饲料84%、丙基硫氧嘧啶[10 mg/(kg·d)],每只兔每日总食量约120 g,单笼饲养,饮水不限,连续12周。
1.4 穴位定位
参照全国“十二五”规划教材《实验针灸学》(中国中医药出版社)及拟人比照法制定[16]。
1.4.1 Ⅰ组穴位 巨阙:胸剑联合下2寸;天枢:耻骨联合上缘上5寸,前正中线旁开2寸处;丰隆:小腿的外侧面正中,膝关节至踝关节的中点。
1.4.2 Ⅱ组穴位 心俞:以手指摸到枕项部的第一个椎体棘突为第2颈椎棘突起,依次数到第5胸椎棘突下旁开1.5 cm处;肝俞:第9胸椎棘突旁开1.5 cm处;脾俞:第11胸椎棘突旁开1.5 cm处。
1.5 干预方法
空白组喂食普通饲料;模型组喂食高胆固醇饲料;抗生素组喂食高胆固醇饲料及广谱抗生素水(配方:0.5 g/L的万古霉素、0.5 g/L的硫酸新霉素、1 g/L的甲硝唑、1 g/L的氨苄青霉素加入兔的饮水中,2 d换1次水,连续12周);阿托伐他汀组喂食拌有阿托伐他汀[1 mg/(kg·d)]的高胆固醇饲料;隔药饼灸组喂食高胆固醇饲料,同时每天再施以隔药饼灸干预,施灸方法:取穴定位后剪毛,将兔子稳定在兔台上,再将药饼置于施灸穴位上,选用湖南高圣生物有限公司生产的细艾炷(规格:5.3 mm×85 mm),将细支艾条剪成約2 cm艾炷,置于药饼上施灸,燃尽后再换艾炷,每穴连续灸4壮,时长约30 min,Ⅰ、Ⅱ组穴位隔日交替施灸,每日1次,连续12周。
1.6 指标检测及方法
1.6.1 血脂检测 于腹主动脉抽取血液4~6 mL,采用Olympus AU2700型全自动生化分析仪,按试剂盒说明书分别检测血清中TC、TG、HDL-C、LDL-C的含量。
1.6.2 HE染色观察胸主动脉组织形态 将放置于4%多聚甲醛溶液中的胸主动脉取出,将用PBS缓冲液进行冲洗,乙醇脱水,二甲苯透明,浸蜡包埋后制成石蜡切片后,依次进行脱蜡、水化、苏木素染色、伊红染色、脱水封片,显微镜下拍照观察。
1.6.3 免疫组化法检测胸主动脉中TGR5的表达 将放置于4%多聚甲醛溶液中的胸主动脉取出进行石蜡包埋后制成石蜡切片,依次进行脱蜡、抗原修复与封闭、抗孵育、二抗孵育、DAB显色、苏木素复染、脱水、封片与拍照、图像分析。
1.7 统计学分析
所有数据采用SPSS 19.0软件进行处理,各检测指标统计数据均以“x±s”表示,组间两两比较,若方差齐时选择LSD法,方差不齐时选择Tamhane法进行方差分析。均以P<0.05为差异有统计学意义。
2 结果
2.1 一般情况
实验过程中,空白组兔饮水饮食良好,精神状态可,毛色润泽,反应敏捷;模型制备各组部分兔有不同程度的食欲不振、喜卧少动、腹泻等现象,其中,阿托伐他汀组和隔药饼灸组干预后食欲不振、喜卧少动、腹泻等现象有所改善。
模型组与抗生素组中因腹泻各死亡1只。
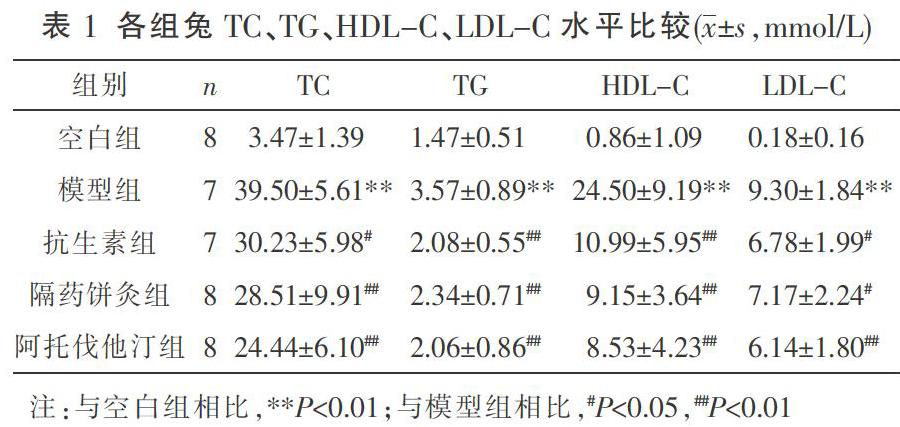
2.2 各组兔TC、TG、HDL-C、LDL-C水平比较
干预后,与空白组比较,模型组兔血清TC、TG、HDL-C、LDL-C水平均升高(P<0.01);与模型组相比,隔药饼灸组、抗生素组与阿托伐他汀组血清TC、TG、HDL-C、LDL-C水平均下降(P<0.01或P<0.05)。见表1。
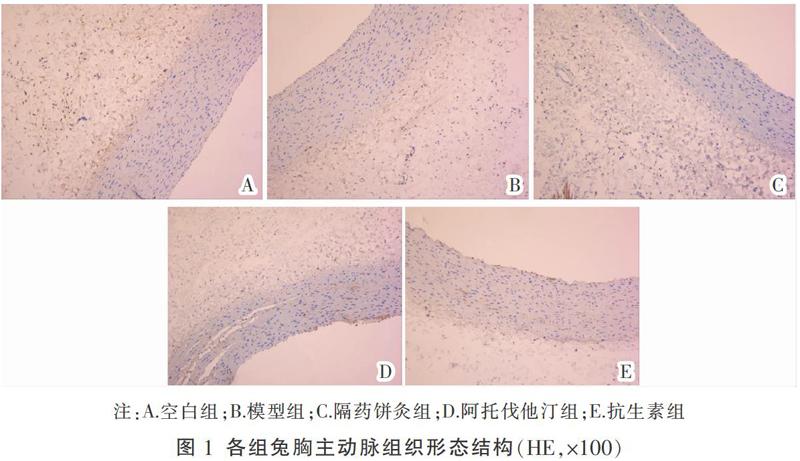
2.3 各組兔胸主动脉组织形态结构比较
空白组:胸主动脉壁结构各层清晰可见,管腔内膜光滑、完整、连续,厚薄均匀,无脂质浸及,分布整齐、有序,无明显脂质斑点;模型组:胸主动脉内膜明显增厚,向管腔内突出,管壁内可见明显斑块和脂质沉积,有大量泡沫细胞出现;隔药饼灸组:内膜略微增厚,各层仍清晰可见,管壁内皮有连续性,平滑肌细胞厚度均匀、排列整齐,少见泡沫细胞;阿托伐他汀组:内膜稍许增厚,各层结构仍清晰可见,管壁内皮细胞较连续,平滑肌细胞与隔药饼灸组一样呈整齐排列规则,些许泡沫细胞形成;抗生素组:胸主动脉内膜明显较厚,向管腔内突出,管壁内可见斑块和脂质沉积,有泡沫细胞存在。见图1。
HE染色观察结果提示:隔药饼灸与阿托伐他汀均能有效减少泡沫细胞形成,并抑制血管平滑肌细胞的增殖。
2.4 各组兔胸主动脉TGR5表达量的比较
与空白组相比,模型组TGR5表达量下降,差异有统计学意义(P<0.01);与模型组比较,隔药饼灸组和阿托伐他汀组TGR5表达量均上升(P<0.01),都有效激活了TGR5的表达;与抗生素组相比,隔药饼灸组和阿托伐他汀组TGR5表达量上升(P<0.01)。见表2。
3 讨论
本研究采用中药穴位贴敷疗法与艾灸疗法相结合的方式,综合了所选中药及贴敷穴位的特性和功效,通过艾灸的温热效应,使得药物的活性成分更容易透皮吸收,再通过刺激腧穴,发挥腧穴-经络-脏腑的调节作用,达到降脂的目的[17-18]。课题组前期研究[19-20]证实了隔药饼灸对AS病变具有显著疗效,根据“久病入络,络病治血”的理论,对于AS患者从治血着手,选用丹参、山楂、泽泻、大黄、郁金这5味药物组成药饼,选取天枢、巨阙、丰隆和脾俞、肝俞、心俞等穴位[21-22],根据AS的病理变化基础及腧穴的特性,将以上两组穴位交替使用,共奏祛痰逐瘀、疏肝健脾之效,在一定程度上起到抑制和延缓AS发生、发展的作用。
TGR5被证实为首个胆汁酸膜G蛋白偶联受体[23],胆汁酸通过激活TGR5信号通路,在能量代谢及调控糖脂、炎性反应、细胞增殖与凋亡中具有重要作用[24-25]。本研究通过观察各组兔血脂水平及胸主动脉TGR5水平,进一步证实隔药饼灸对AS兔的降脂作用及激动TGR5的作用。
抗生素与阿托伐他汀的主要作用是提高血清中HDL-C的水平,降低血浆中TC、TG、LDL-C的水平,以此达到降脂的目的。但在本实验中,连续进食12周的模型组兔与空白组兔比较,模型组兔血清TC、TG、HDL-C、LDL-C水平均升高(P<0.01);与模型组相比,隔药饼灸组、抗生素组与阿托伐他汀组血清TC、TG、HDL-C、LDL-C水平均下降(P<0.01或P<0.05),可能因长期高脂饮食致兔耐受性增加与兔对环境的适应性提高有关,不影响AS斑块的形成与AS病变的发展[26]。抗生素组、阿托伐他汀组与隔药饼灸组血清TC、TG、HDL-C、LDL-C含量比较,差异无统计学意义(P>0.05),说明隔药饼灸与口服抗生素、阿托伐他汀降脂疗效相当。
本实验研究结果显示,与模型组相比,抗生素组未能有效激活TGR5表达(P>0.05),隔药饼灸组与阿托伐他汀组有效激活了TGR5的表达(P<0.05)。有实验研究证实[27-28],使用TGR5激活剂激活了以高脂饮食喂养的小鼠模型TGR5后,减少了小鼠AS斑块的形成,表明TGR5与AS斑块形成的负相关作用,与众多研究结果一致。本研究观测了隔药饼灸干预后的AS模型兔的血脂水平及TGR5含量,考虑隔药饼灸对AS模型兔的血脂调节作用与TGR5激活相关,具体调节机制尚未明确,可能通过参与NF-κB信号通路发挥其降脂作用[29],TGR5的表达上升可减少脂多糖诱导的促炎细胞因子的产生,进而减少粥样斑块的形成,下一步研究可增加对TGR5激活后相关促炎细胞因子表达的检测。
综上所述,隔药饼灸组、抗生素组和阿托伐他汀组对AS模型兔血脂水平有良性调节作用,隔药饼灸组和阿托伐他汀组能够有效激活TGR5的表达,考虑调节血脂水平的作用可能与TGR5的激活相关。
参考文献
[1] 哈 略,赵百孝.艾灸对动脉粥样硬化小鼠炎性反应因子及MMP-9的实验研究[J].世界中医药,2016,11(8):1389-1394.
[2] ZHOU M G, WANG H D, ZHU J, et al. Cause-specific mortality for 240 causes in China during 1990-2013: A systematic subnational analysis for the Global Burden of Disease Study 2013[J]. The Lancet, 2016, 387(10015): 251-272.
[3] 陽晶晶,赵 钊,石 佳,等.隔药饼灸对高脂血症合并动脉粥样硬化兔血清TNF-α、INF-γ含量的影响[J].湖南中医药大学学报,2018, 38(11):1258-1261.
[4] 廖宗力,孙 璐,朱重政,等.不同促透剂运用于隔药饼灸对高脂血症合并动脉粥样硬化兔主动脉形态及血清IL-6、IL-10的影响[J]. 湖南中医药大学学报,2019,39(11):1368-1372.
[5] ZHANG X B, RAMíREZ C M, ARYAL B, et al. Cav-1 (caveolin-1) deficiency increases autophagy in the endothelium and attenuates vascular inflammation and atherosclerosis[J]. Arteriosclerosis, Thrombosis, and Vascular Biology, 2020, 40(6): 1510-1522.
[6] 温 芳,姚映芷,张晓东.从胆汁酸肝肠循环角度探讨中药降血脂的机理[J].时珍国医国药,2018,29(11):2718-2720.
[7] MARUYAMA T, MIYAMOTO Y, NAKAMURA T, et al. Identification of membrane-type receptor for bile acids (M-BAR)[J]. Biochemical and Biophysical Research Communications, 2002, 298(5): 714-719.
[8] POLS T W, NOMURA M, HARACH T, et al. TGR5 activation inhibits atherosclerosis by reducing macrophage inflammation and lipid loading[J]. Cell Metabolism, 2011, 14(6): 747-757.
[9] DUBOC H, TACHé Y, HOFMANN A F. The bile acid TGR5 membrane receptor: From basic research to clinical application[J]. Digestive and Liver Disease, 2014, 46(4): 302-312.
[10] SATO H, MACCHIARULO A, THOMAS C, et al. Novel potent and selective bile acid derivatives as TGR5 agonists: Biological screening, structure-activity relationships, and molecular modeling studies[J]. Journal of Medicinal Chemistry, 2008, 51(6): 1831-1841.
[11] SATO H, GENET C, STREHLE A, et al. Anti-hyperglycemic activity of a TGR5 agonist isolated from Olea europaea[J]. Biochemical and Biophysical Research Communications, 2007, 362(4): 793-798.
[12] ONO E, INOUE J, HASHIDUME T, et al. Anti-obesity and anti-hyperglycemic effects of the dietary Citrus limonoid nomilin in mice fed a high-fat diet[J]. Biochemical and Biophysical Research Communications, 2011, 410(3): 677-681.
[13] CIPRIANI S, MENCARELLI A, CHINI M G, et al. The bile acid receptor GPBAR-1 (TGR5) modulates integrity of intestinal barrier and immune response to experimental colitis[J]. PLoS One, 2011, 6(10): e25637.
[14] ZHANG X Q, SUI Z H, KAUFFMAN J, et al. Evaluation of anti-diabetic effect and gall bladder function with 2-thio-5-thiomethyl substituted imidazoles as TGR5 receptor agonists[J]. Bioorganic & Medicinal Chemistry Letters, 2017, 27(8): 1760-1764.
[15] PHILLIPS D P, GAO W Q, YANG Y, et al. Discovery of trifluoromethyl(pyrimidin-2-yl)azetidine-2-carboxamides as potent, orally bioavailable TGR5 (GPBAR1) agonists: Structure-activity relationships, lead optimization, and chronic in vivo efficacy[J]. Journal of Medicinal Chemistry, 2014, 57(8): 3263-3282.
[16] 李忠仁.实验针灸学[M].北京:中国中医药出版社,2003:314-319.
[17] 阳仁达,郑秋菊,谭 静,等.隔药饼灸对慢性支气管炎模型大鼠血清IgG、IgA水平的影响[J].湖南中医药大学学报,2013,33(5):37-40.
[18] 單增天,田岳凤,李雷勇,等.不同灸法对免疫抑制兔脾脏指数及细胞因子的影响[J].湖南中医药大学学报,2016,36(11):83-86.
[19] 赵 钊.隔药饼灸对高脂血症合并AS兔胆固醇逆转运SR-B1介导途径及炎症反应的影响[D].长沙:湖南中医药大学,2016.
[20] 沈 菁,刘 涛,刘 霞,等.隔药饼灸对动脉粥样硬化兔血管内皮修复与基质细胞衍生因子1的影响[J].中国针灸,2019,39(2):173-179,184.
[21] 常小荣,符 凌,张 亮,等.隔药饼灸对兔动脉粥样硬化斑块中基质金属蛋白酶-2, 9 mRNA表达的影响[J].中国康复理论与实践,2010,16(10):934-936,1001.
[22] 岳增辉,何新群,常小荣,等.隔药饼灸对动脉粥样硬化兔血清载脂蛋白A及载脂蛋白B水平的影响[J].中国中医药信息杂志,2011,18(9):33-34.
[23] YASUDA H, HIRATA S, INOUE K, et al. Involvement of membrane-type bile acid receptor M-BAR/TGR5 in bile acid-induced activation of epidermal growth factor receptor and mitogen-activated protein kinases in gastric carcinoma cells[J]. Biochemical and Biophysical Research Communications, 2007, 354(1): 154-159.
[24] STEPANOV V, STANKOV K, MIKOV M. The bile acid membrane receptor TGR5: A novel pharmacological target in metabolic, inflammatory and neoplastic disorders[J]. Journal of Receptor and Signal Transduction Research, 2013, 33(4): 213-223.
[25] 张 静,秦 方,付 莉.G-蛋白偶联胆汁酸受体对高糖诱导大鼠冠状动脉内皮细胞功能的影响[J].中国煤炭工业医学杂志,2019,22(1):79-85.
[26] 杨 梅.兔饵食性高脂血症及动脉粥样硬化模型的研究[D].石家庄:河北医科大学,2009.
[27] POLS T W, NOMURA M, HARACH T, et al. TGR5 activation inhibits atherosclerosis by reducing macrophage inflammation and lipid loading[J]. Cell Metabolism, 2011, 14(6): 747-757.
[28] KIDA T, TSUBOSAKA Y, HORI M, et al. Bile acid receptor TGR5 agonism induces NO production and reduces monocyte adhesion in vascular endothelial cells[J]. Arteriosclerosis, Thrombosis, and Vascular Biology, 2013, 33(7): 1663-1669.
[29] POLS T W, NOMURA M, HARACH T, et al. TGR5 activation inhibits atherosclerosis by reducing macrophage inflammation and lipid loading[J]. Cell Metabolism, 2011, 14(6): 747-757.
(本文编辑 匡静之)

