lncRNA PWRN2在胶质瘤组织中的表达及对胶质瘤细胞增殖和迁移能力的影响
马迎辉 胡胜 胡骁 吴勇 金杰
鄂东医院集团黄石市中心医院湖北理工学院附属医院神经外科 435000
胶质瘤是成年人最常见的中枢神经系统恶性肿瘤,手术切除、放疗和化疗是胶质瘤主要的治疗方法,但其整体预后较差[1]。胶质瘤细胞增殖和转移是影响其疗效和预后的主要因素,探究胶质瘤发生、发展的分子机制有助于寻找新的治疗靶点和提供胶质瘤的诊治水平[2]。长链非编码RNA(long-chain non-coding RNA,lncRNA)是一类非编码RNA,长度超过200个核苷酸,在细胞的生理和病理过程中发挥重要作用[3]。越来越多的研究证实,lncRNA参与调控肿瘤细胞的生长和转移过程,与肿瘤患者的生存期密切相关[4]。lncRNA已成为近年来胶质瘤研究的热点。PWRN2属于lncRNA家族成员,其在胶质瘤中的表达及生物学功能并不清楚。本研究通过检测胶质瘤组织和细胞株中PWRN2的表达,观察PWRN2对胶质瘤细胞增殖和迁移过程的调控作用,探究PWRN2可能的作用机制,为胶质瘤的分子诊断和基因靶向治疗提供一定的理论基础。
1 资料与方法
1.1 临床标本、细胞系和主要试剂 选取2018年1月至2019年12月本院神经外科行手术切除并经病理证实为胶质瘤的肿瘤组织和对应癌旁组织,组织标本于液氮中保存。所有胶质瘤患者术前均未行化疗或放疗。HEB、U-87 MG、LN382、C6、SNB-19、U251细胞株购自中国科学院上海生命科学研究院细胞资源中心;阴性对照病毒(LV-NC)、PWRN2重组慢病毒(LV-PWRN2)、PCR引物购自上海吉玛生物科技有限公司;胎牛血清(FBS)、DMEM/F12培养基、RPMI-1640培养基购自美国Hyclone公司;荧光实时定量聚合酶链式反应(qPCR)检测试剂盒购自日本TaKaRa公司;二甲基亚砜和噻唑蓝(MTT)试剂盒购自上海生工生物科技有 限 公 司;一 抗Klotho、TGF-β1/2、TGF-β、SALL4、p-Smad2、β-actin购自美国CST公司。
1.2 细胞培养和慢病毒感染 HEB、U-87 MG、C6、U251细胞株采用含10%FBS、100 U/ml青-链霉素双抗的DMEM/F12培养基培养,LN382、SNB-19细胞株采用含10%FBS、100 U/ml青-链霉素双抗的RPMI 1640培养基培养,在37℃、5%CO2条件下培养。U-87 MG细胞接种于6孔板,接种量以过夜培养后汇合度达60%为准。感染复数设定为30,以LV-NC感染U-87 MG细胞作为对照组(4个细胞),以携带PWRN2序列的LV-PWRN2感染的U-87 MG细胞作为试验组(4个细胞),根据慢病毒说明书进行感染操作。12 h后更换为含10%FBS、100 U/ml青-链霉素双抗的DMEM/F12培养基。
1.3 qPCR检测 运用Trizol法分别提取组织和细胞中总RNA,紫外分光光度检测纯度和浓度,以500 ng总RNA为模板反转录为cDNA。按照qPCR检测试剂盒说明书扩增。以GAPDH为内参检测PWRN2和Klotho mRNA的表达水平。qPCR数据采用2-△△CT法进行统计。qPCR引物序列:Klotho正向引物5’-GTGCGTCCATCTGGGATACG-3’,反向引物5’-TGTCGCGGAAGACGTTGTT-3’;GAPDH正向引物5’-ACAACTTTGGTATCGTGGAAGG-3’,反 向 引 物5’-GCCATCACGCCACAGTTTC-3’;PWRN2正 向 引 物5’-TGAGAGGAGATTTCAGGACGTT-3’,反 向 引 物5’-CAGTTTGCTTCAAGGTTACATCC-3’。
1.4 四甲基偶氮盐微量酶反应比色(MTT)法检测U-87 MG细胞增殖能力 收集两组U-87 MG细胞,采用DMEM/F12培养基制备单细胞悬液。分别以1 000个/孔接种于96孔板。分别于接种后第1、2、3、4、5天进行MTT检测,以10μl/孔加入MTT试剂,继续培养4 h,弃上清后每孔加入120μl二甲基亚砜,保证结晶溶解,20 min内采用酶标仪检测在490 nm波长处每孔的吸光度(A)值,绘制U-87 MG细胞生长曲线。
1.5 细胞划痕实验检测U-87 MG细胞迁移能力 收集两组U-87 MG细胞,采用DMEM/F12培养基制备单细胞悬液并接种于6孔板。采用200μl在6孔板底部进行划痕,采用含100 U/ml青-链霉素双抗的DMEM/F12培养基洗3次。此时记为0 h,在100×显微镜下拍照,Image Pro Plus软件测量划痕距离A1。连续培养24 h,在100×显微镜下拍照,测量划痕距离A2。计算细胞迁移率=(A1-A2)/A1×100%,代表U-87 MG细胞迁移能力。
1.6 蛋白质印记法检测蛋白表达 收集两组U-87MG细胞,采用RIPA细胞裂解液裂解细胞,测定总蛋白浓度后,每孔上样40μg蛋白,以SDS-PAGE垂直凝胶电泳分离蛋白,半干转膜法转膜至硝酸纤维素膜,封闭液中进行封闭。采用封闭液按1∶1 000稀释所有一抗,在4℃下进行孵育过夜。采用封闭液按1∶10 000稀释所有二抗,在室温下进行孵育,采用增强化学发光法曝光、显色。
1.7 统计学方法 数据分析采用SPSS21.0统计学软件,符合正态分布的计量数据以均数±标准差()表示,组间比较采用独立样本t检验,以P<0.05为差异有统计学意义。
2 结 果
2.1 PWRN2在胶质瘤及癌旁组织组织中的表达qPCR检测显示,胶质瘤组织和癌旁组织中PWRN2表达量分别为(1.25±0.52)和(6.28±0.66),PWRN2在胶质瘤组织中低表达(P<0.01)。
2.2 PWRN2在胶质瘤细胞株及正常脑胶质细胞中的表达 qPCR检测显示,5种胶质瘤细胞株(U-87 MG、LN382、C6、SNB-19、U251)和正常脑胶质细胞株HEB中PWRN2的表达量分别为(0.13±0.02)、(0.55±0.06)、(0.73±0.07)、(0.34±0.04)、(0.47±0.03)和(1.00±0.04)。与HEB相比,PWRN2在胶质瘤细胞株中低表达(P<0.05),在U-87 MG细胞株中表达最低(P<0.01),故选择U-87 MG细胞进行后续试验。
2.3 两组细胞中PWRN2的表达 qPCR检测显示,试验组和对照组U-87 MG细胞中PWRN2的表达分别为(10.28±0.84)和(1.02±0.12),试 验 组U-87 MG细 胞 中PWRN2的表达较对照组明显升高(P<0.01)。
2.4 过表达PWRN2对U-87 MG细胞增殖能力的影响 MTT法检测两组U-87 MG细胞的增殖能力,在第2天开始,试验组U-87 MG细胞的吸光度较对照组明显降低,见图1,结果表明过表达PWRN2可抑制U-87 MG细胞的增殖能力。

图1 四甲基偶氮盐微量酶反应比色法检测两组U-87 MG细胞的增殖能力
2.6 过表达PWRN2对U-87 MG细胞迁移能力的影响 试验组和对照组U-87 MG细胞迁移率分别为(68.41±7.62)%和(27.96±4.87)%,差异有统计学意义(P<0.01),结果表明过表达PWRN2可降低U-87 MG细胞的迁移能力。
2.7 两组细胞中Klotho mRNA的表达 qPCR定量检测显示,试验组和对照组U-87 MG细胞中Klotho mRNA的表达量分别为(4.33±0.53)和(1.01±0.09),试验组U-87 MG细胞中Klotho mRNA的表达较对照组明显增加,差异有统计学意义(P<0.01)。试验结果表明上调PWRN2能够促进Klotho mRNA的表达。
2.8 两组细胞中Klotho及转化生长因子-β(TGF-β)信号通路蛋白的表达 与对照组相比,试验组U-87 MG细胞中Klotho蛋白表达增加,TGF-β信号通路蛋白如TGF-β、SALL4、p-Smad2、p-Smad3表达降低,见图2。试验结果表明上调PWRN2可导致Klotho蛋白表达增加,TGF-β信号通路的转导被抑制。
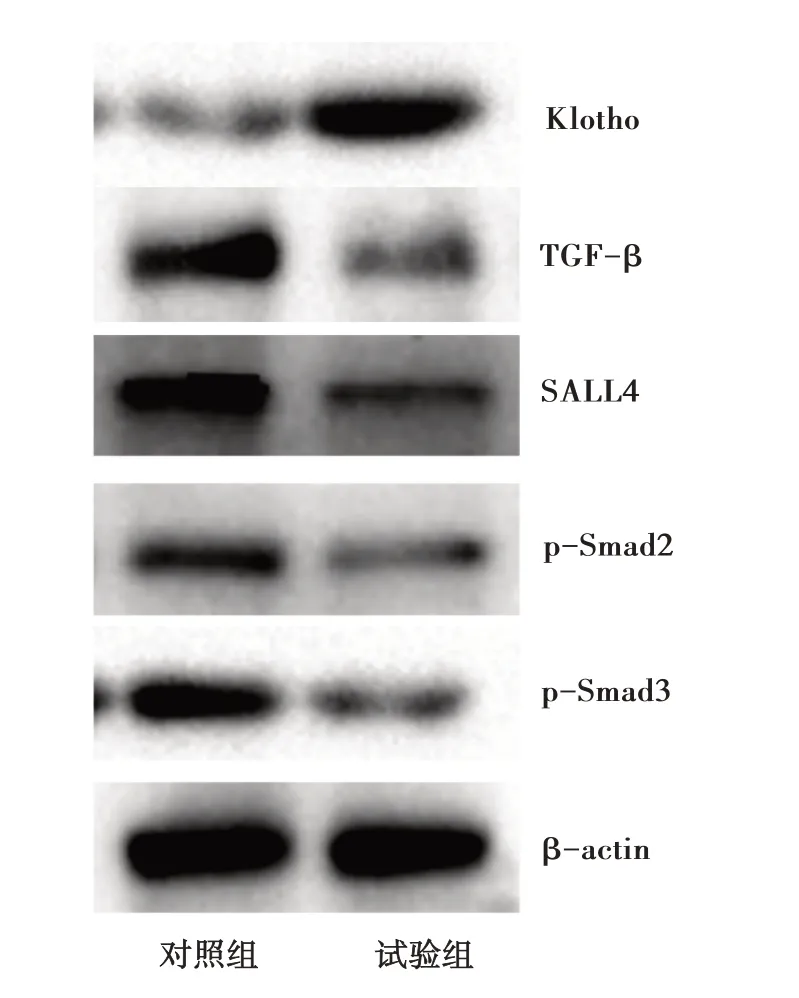
图2 蛋白质印记法检测两组U-87 MG细胞Klotho及TGF-β信号通路蛋白的表达
3 讨 论
胶质瘤长期占据颅内恶性肿瘤发病率的首位,其高转移性和高复发性导致患者的预后较差[5]。随着分子生物学技术的发展,基因靶向治疗已成为胶质瘤重要的辅助治疗方式。lncRNA可在转录水平、转录后水平调控特定基因的表达,在各种细胞分子通路中发挥重要作用,影响疾病的发生、发展[6]。越来越多的研究表明,多个lncRNA如FOXD2-AS1[7]、GATA6-AS[8]、FoxD2-AS1[9]等的 异 常 表达参与调控胶质瘤细胞的增殖、耐药、放疗敏感性、迁移等恶性生物学行为,且与胶质瘤患者的疗效、复发及预后相关。PWRN2在胶质瘤中的临床意义和生物学功能未见报道。
本研究通过检测临床组织标本和细胞株中PWRN2的表达,证实PWRN2高表达于胶质瘤组织和细胞株,表明PWRN2可能在胶质瘤的发生、发展中发挥重要作用。为进一步探究PWRN2的生物学功能,本研究选择表达量最低的U-87 MG细胞,通过LV-PWRN2促进细胞中PWRN2的表达。本研究通过MTT法和细胞划痕试验证实,上调PWRN2表达均可明显抑制胶质瘤U-87 MG细胞的增殖和迁移。Klotho基因位于染色体13q12,最初被认为是一种抗衰老基因[10]。Klotho蛋白属于膜结合蛋白,在人体多个正常组织中均可表达,具有调控钙磷代谢、氧化应激、炎性反应等作用[11]。近年研究显示,Klotho蛋白在胃癌、结直肠癌、肺癌、肝癌等多种恶性肿瘤中低表达,Klotho表达下调导致肿瘤细胞的增殖和转移,与肿瘤患者的生存期相关,证明Klotho基因是一种抑癌基因[12]。研究表明,胶质瘤组织中Klotho基因启动子的甲基化程度明显增加,Klotho蛋白的表达明显降低,Klotho表达水平越高,胶质瘤患者的生存在越长,Klotho可能参与胶质瘤的发生和进展[13]。本研究显示,特异性增加U-87 MG细胞中PWRN2的表达,Klotho基因的表达明显上调,PWRN2可促进Klotho基因的表达。TGF-β信号通路是介导胶质瘤生长和转移的重要通路之一[14]。本研究通过Western blotting检测发现,Klotho基因表达上调后,TGF-β信号通路蛋白如TGF-β、SALL4、p-Smad2、p-Smad3表达明显降低,表明TGF-β信号通路转导被抑制。PWRN2调控Klotho基因表达的具体分子机制尚不清楚,是下一步研究的方向。
综上所述,PWRN2在胶质瘤组织和细胞株中表达降低,上调PWRN2可抑制胶质瘤细胞U-87 MG的增殖和迁移能力,其分子机制可能是PWRN2通过促进Klotho的表达,抑制TGF-β信号通路的转导。PWRN2可能在胶质瘤的分子诊断和基因靶向治疗研究中具有重要价值。
利益冲突:作者已申明文章无相关利益冲突。

