拟无枝酸菌属羽毛降解菌株BJA-103的诱变育种
严 冬,李姜函,陈 欢,赵康康,颜 华,贾良辉
(西北农林科技大学 生命科学学院,陕西 杨凌 712100)
在牲畜生产和肉类加工中会产生大量有机废物和副产物,包括骨头、皮肤及富含角蛋白的爪蹄、羽毛等[1]。每年在畜牧业中产生的鸡羽毛副产物就达50亿kg[2]。研究表明,羽毛成分与动物纤维相似,其最主要的结构蛋白是角蛋白[3],可用作塑料、制药等领域的珍贵原料[4-5]。在角蛋白的结构中,包含大量α-螺旋及β-折叠。丰富的二硫键含量使得角蛋白具有极强的水不溶性与耐受性[6]。因此,目前对羽毛的主要处理方法是焚烧法,而这会使得有机副产物在焚烧过程中产生多种污染物,包括固体颗粒、酸性气体、氮氧化物,对环境造成极大危害[7]。此外,部分羽毛会采用工业方法进行降解处理,但由于降解处理时常使用大量强酸、强碱及强氧化剂,这不仅会破坏羽毛降解得到的产物,还会对环境造成二次污染[8-9],同时也会消耗大量的淡水资源,加剧水资源缺乏[10]。因此,环境友好型生物降解羽毛逐渐走进了人们的视野[11]。
目前,已分离出多种能发酵生产角蛋白酶的微生物,包括细菌[12]、放线菌[13-14]、真菌[15]等,并且已有角蛋白酶异源表达的报道[16]。然而,研究表明在角蛋白降解过程中至少有3种不同的酶参与,分别发挥内切、外切及寡肽水解作用[17];角蛋白酶在降解羽毛过程中表现低效[18]。因此,在单个基因水平上操作,以期获得高效降解羽毛的菌株往往会受到阻碍[19]。基因诱变是一种基因组水平上的操作,DNA在诱变剂作用下被损伤,而在DNA修复过程中,细微的偏差会改变细胞的代谢[20-21]。应用基因诱变方法可以忽视并克服单个基因水平操作时受到的阻碍,从而选育出羽毛降解速率快、最终降解率高的理想表现型菌株。为此,本研究通过对具有羽毛降解能力的BJA-103菌株进行基因诱变,筛选获得羽毛降解速率更快、降解程度更高的突变株,并对突变株产生的角蛋白酶进行初步酶学探究,为其进一步扩大发酵及生产应用提供理论依据。
1 材料与方法
1.1 材料与培养基
拟无枝酸菌属羽毛降解菌株BJA-103来自西北农林科技大学放线菌分子生物学实验室。前期研究已获得该菌株的全基因组信息[22]。羽毛来自本地市场的鸡毛废料,用去污粉清洗后多次用蒸馏水涮洗,自然风干至恒质量。角蛋白来自陕西宝禾生物科技有限公司(生产批次BBSW200414-1,直径≤180 μm)。
高氏一号培养基(1 000 mL):淀粉20.0 g,KNO31.0 g,K2HPO40.5 g,NaCl 0.5 g,FeSO40.001 g,琼脂18.0 g,pH 7.2。
TSB培养基(1 000 mL):胰蛋白胨17.0 g,葡萄糖2.5 g,大豆蛋白胨3.0 g,NaCl 5.0 g,K2HPO42.5 g,pH 7.2。
解除氮代谢分解调节筛选培养基:在高氏一号培养基中加入色氨酸,使其质量浓度达到1.5 mg/mL。
羽毛降解培养基(1 000 mL):羽毛粉10.0 g,NaCl 0.5 g,KH2PO40.4 g,K2HPO41.0 g,胰蛋白胨1.7 g,葡萄糖0.25 g,大豆蛋白胨0.3 g,pH 7.2。
牛奶培养基(200 mL):称取4.0 g琼脂加入100 mL H2O,121 ℃灭菌25 min;称取1.0 g脱脂奶粉加入100 mL H2O,115 ℃灭菌20 min。混合使用。
1.2 硫酸二乙酯(DES)诱变
1.2.1 菌株活化与菌悬液制备 将BJA-103菌株涂布在高氏一号培养基上活化。每次取固定面积菌落,接种到TSB摇瓶培养基中,28 ℃、180 r/min振荡培养28 h至有明显菌丝体产生,即进入对数生长期。加入已灭菌玻璃珠20粒,28 ℃、180 r/min振荡破碎菌丝体1 h。振荡结束后,使用已灭菌玻璃注射器(含脱脂棉)过滤,除去未完全破碎菌丝体,得到菌液。离心后,使用0.1 mol/L磷酸缓冲液(PBS,pH 7.0)洗涤2次,再加入适量PBS重悬浮得到菌悬液。
1.2.2 DES致死率曲线制作 取菌悬液1 mL,加入25% Na2S2O3溶液0.5 mL,作为处理0 min对照组。剩余菌悬液中加入DES使其终浓度为1%,28 ℃、180 r/min振荡培养。分别在培养第15,30,45,60,80 min时取样1 mL,立即加入25% Na2S2O3溶液0.5 mL终止诱变。离心后,菌泥加入1 mL 0.1 mol/L PBS (pH 7.0)重悬浮。
稀释重悬后菌泥至10-4CFU/mL,涂布高氏一号培养基,28 ℃倒置培养4 d。计数各诱变处理时间对应的生长菌落数。以对照组致死率为0%制作DES致死率曲线。致死率的计算公式如下:
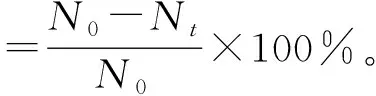
式中:N0为10-4CFU/mL时对照组菌落数,Nt为10-4CFU/mL时诱变剂处理tmin后菌落数。
1.2.3 DES正式诱变 依据DES致死率曲线,选择在1% DES诱变处理时致死率90%所对应的处理时间进行正式诱变。操作步骤同1.2.2节的方法,得到正式诱变完毕的突变株菌悬液。
1.2.4 解除氮代谢分解调节菌株的获得 鸡羽毛降解时会在降解体系中产生大量的色氨酸[23]。当环境中存在基础氮源(如氨基酸)时,菌株的代谢调控会阻遏蛋白酶产生[24]。因此,将突变株菌悬液涂布在解除氮代谢分解调节筛选培养基上,28 ℃倒置培养,以期获得解除氮源分解调节的突变株。10 d后,长出可供挑取单菌落。将单菌落挑取到24孔板(每孔1 mL TSB培养基)中,28 ℃、180 r/min振荡培养4 d。收取菌液,离心后弃上清,得到突变株库。加入50%甘油,于-80 ℃冰箱中长期保存。
1.3 突变株的筛选
1.3.1 牛奶培养基初筛 将1.2.4节突变株库及野生型BJA-103菌株于3 000 r/min离心10 min。用移液枪头伸入突变株或野生型BJA-103菌株菌泥中吸取20 μL菌泥,点植法接种在牛奶培养基上。风干30 min后,28 ℃倒置培养5 d。记录突变株及野生型BJA-103菌株菌落大小与对应牛奶水解圈宽度,选择水解圈尽量宽的突变株进行复筛。
1.3.2 羽毛降解复筛 选择水解圈尽量宽的突变株,在TSB摇瓶培养基中活化,36 h后继续转接到下一个TSB摇瓶培养基中传代培养。重复该传代培养步骤5次。将突变株转接到高氏一号培养基中,取相同面积菌落接种到TSB摇瓶培养基中培养28 h为种子液。再将种子液按照2%接种量转接到羽毛降解培养基中,置于28 ℃、180 r/min条件下培养以降解羽毛。每24 h取样测定羽毛降解率,共取样6次,每次3个重复。取出样品后,10 000 r/min离心保存上清液,在沉淀中加入TE 25S buffer(0.3 mol/L蔗糖,25 mmol/L Tris-HCl,25 mmol/L EDTA,pH 8.0) 6 mL重新悬浮沉淀,并在重悬沉淀中加入100 mg/mL溶菌酶1.4 mL,37 ℃水浴2 h彻底酶解破碎菌丝体。最后将保存的上清液与酶解后重悬沉淀使用Whatman No.1滤纸抽滤。
采用减质量法[23]测定羽毛降解率,选择羽毛降解速率最快、最终降解程度最大的菌株作为复筛得到的突变株。羽毛降解率计算公式如下:
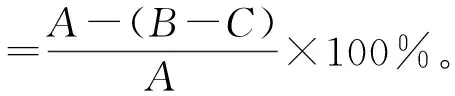
式中:A为培养基中羽毛总质量,B为发酵完毕后滤纸和未降解羽毛质量,C为滤纸质量。
1.4 突变株角蛋白酶的酶学性质
1.4.1 角蛋白酶活性测定 使用福林酚法[25]测定角蛋白酶活性。取羽毛降解摇瓶,4 ℃、8 000 r/min 离心10 min,取上清液为角蛋白酶粗酶液(以下简称为粗酶液)。使用0.45 μm的水系滤头过滤粗酶液,除去悬浮菌体与未沉淀的羽毛碎片。40 ℃水浴锅中预热2 min。每1 mL粗酶液加入2%角蛋白1 mL立即精确反应10 min,对照组中加入0.1 mol/L PBS(pH 7.2,角蛋白溶剂)1 mL。反应完毕后,加入0.4 mol/L 三氯乙酸溶液终止反应,继续孵育20 min。孵育完毕后10 000 r/min离心10 min,取上清液1 mL,加入5 mL 0.4 mol/L Na2CO3溶液与1 mL福林酚试剂,在40 ℃水浴中发色20 min。最后冲凉,测定660 nm下吸光度。每1 mL体系精确反应10 min产生1 μg氨基酸为一个突变株角蛋白酶活性单位,即1 U。
1.4.2 降解时间对角蛋白酶活性的影响 将突变株在高氏一号培养基上活化,取固定面积菌落接种到TSB摇瓶培养基中,28 ℃、180 r/min振荡培养28~36 h为种子液。按2%接种量将种子液转接到羽毛降解培养基中,28 ℃、180 r/min培养。每24 h取样1次,共取样6次,测定角蛋白酶活性,每次设置1个对照组与3个试验组。确定在羽毛降解过程中突变株角蛋白酶活性最大的时刻。
1.4.3 温度对角蛋白酶活性的影响 按照平板活化、种子液活化、羽毛降解培养方法,将突变株培养至角蛋白酶活性最大的时刻。反应pH恒定为7,设置温度梯度20,30,40,50,60,70,80 ℃进行角蛋白酶活性测定。每个温度梯度设置1个对照组与3个试验组。
1.4.4 pH对角蛋白酶活性的影响 按照平板活化、种子液活化、羽毛降解培养方法,将突变株培养至角蛋白酶活性最大的时刻。反应温度恒定为40 ℃,设置pH梯度4,5,6,7,8,9,10,11,12进行角蛋白酶活性测定。测定时采用对应pH缓冲液悬浮角蛋白,对照组中加入对应pH缓冲液。每个pH梯度设置1个对照组与3个试验组。
2 结果与分析
2.1 BJA-103诱变菌株的获得
由图1可知,1% DES处理BJA-103菌株菌悬液,当处理时间为80 min时,致死率为99%。由于在诱变育种中,高致死率通常会产生大规模的负突变[20],增加筛选难度。故依据图1,在正式诱变中选择1% DES处理65 min(致死率90%)。通过解除氮代谢分解调节筛选培养基培养后,挑取生长速率快、可稳定遗传的单菌落突变株共1 253株。菌株编号以72个为一组,每组首字母分别为A,B,C,…,R。则第1组前26株突变株编号为AA,AB,AC,…,AZ;随后26株突变株编号为AA′,AB′,AC′,…,AZ′;最后20株突变株编号为A1,A2,A3,…,A20,以此类推。
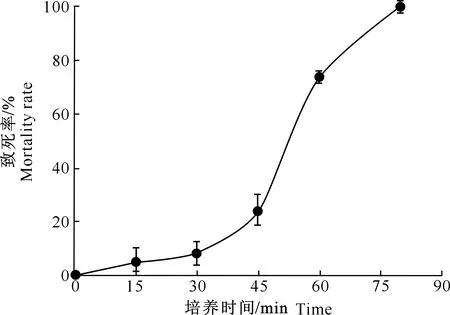
图1 DES处理BJA-103诱变菌株的致死率曲线Fig.1 Mortality rate of DES treatment of BJA-103
2.2 BJA-103诱变菌株的筛选
2.2.1 牛奶培养基初筛 图2显示,BJA-103诱变菌株牛奶水解圈宽度占比分布整体偏向大于其所拟合正态分布曲线期望值的一侧。这说明在获得解除氮代谢分解调节突变株库时,培养基中过量的色氨酸产生了筛选压力,且起到了明显作用。因此,挑取的突变株单菌落具有更高的蛋白酶生产基础值,能产生更大的水解圈。初筛去掉大量水解圈较小的突变株,仅对水解圈宽度在8.5~12 mm的5株突变株(RT、BM′、CV′、FX′、NK′)进行羽毛降解复筛。
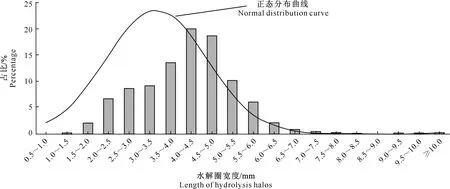
图2 BJA-103诱变菌株牛奶水解圈宽度占比的分布Fig.2 Distribution of ratio of hydrolysis halos length of mutants from BJA-103
2.2.2 羽毛降解复筛 对5株突变株(RT、BM′、CV′、FX′、NK′)以及野生型菌株BJA-103进行羽毛降解试验,结果如表1所示。由表1可知,羽毛降解48 h时,野生型BJA-103的羽毛降解率为12.82%,FX′和NK′的羽毛降解率分别为64.04%和65.29%。因此,淘汰掉在同一羽毛降解时间下降解速率明显偏低的突变株RT、BM′和CV′。随着羽毛降解试验的继续进行,FX′在降解72 h时降解作用基本结束,在降解144 h时最终降解率为87.52%。NK′在降解72~144 h期间仍能保持较强羽毛降解能力,在降解144 h时最终降解率为90.74%。故选择降解速率较快,且最终降解率较高的突变株NK′作为复筛得到的突变株。
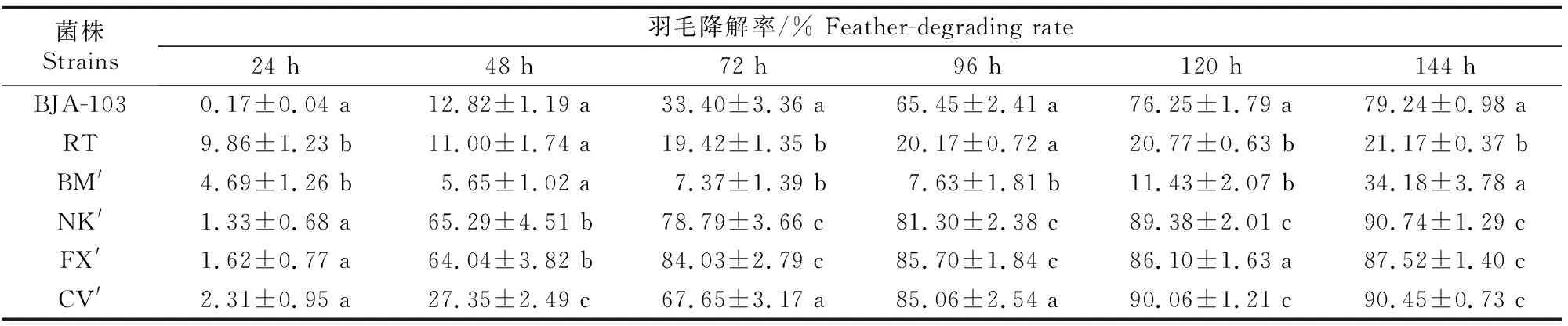
表1 不同降解时间下野生型BJA-103菌株及其突变株的羽毛降解率Table 1 Feather-degrading rate of wild-type and mutants of BJA-103 under different degrading times
2.3 突变株NK′角蛋白酶的初步酶学探究
2.3.1 降解时间 由图3可知,突变株NK′角蛋白酶活性在羽毛降解24~72 h内快速上升,并在72 h处有最大值(41.6 U),之后随着羽毛降解时间的延长,角蛋白酶活性逐步下降。因此,选择72 h为最适产酶发酵时间,以指导温度与pH对突变株NK′角蛋白酶活性影响试验。
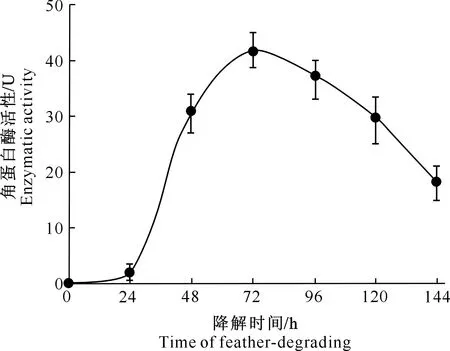
图3 降解时间对突变株NK′角蛋白酶活性的影响Fig.3 Effect of feather-degrading time on keratinase activity of mutant NK′
2.3.2 温 度 由图4可知,突变株NK′角蛋白酶活性随着反应温度由20~70 ℃的上升而快速增加,并在70 ℃处有最大值(114.2 U),之后随着反应温度的进一步上升,角蛋白酶活性快速下降。因此,70 ℃为该酶最适反应温度,说明该角蛋白酶具有一定程度的耐高温能力。
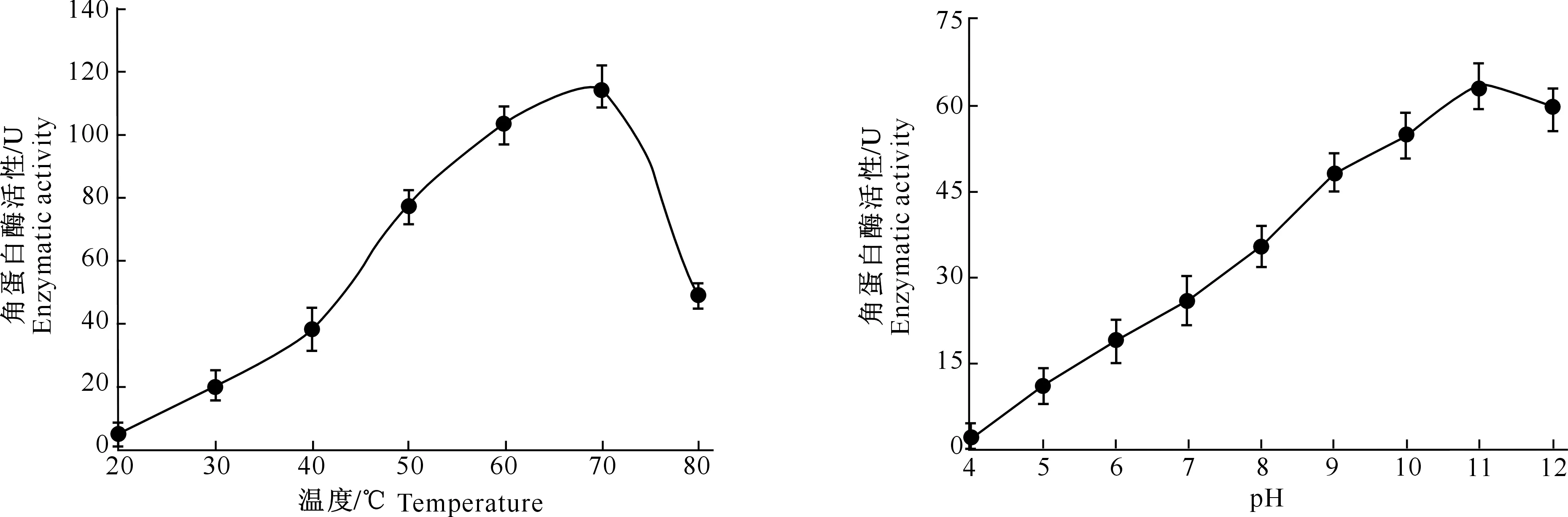
图4 温度对突变株NK′角蛋白酶活性的影响Fig.4 Effect of temperature on keratinase activity of mutant NK′
2.3.3 pH 由图5可知,突变株NK′角蛋白酶活性随着反应pH由4~11的升高而快速增加,并在pH 11处有最大值(63.1 U),之后随着反应pH进一步升高为12,角蛋白酶活性略微下降(59.8 U)。
因此,pH 11为该酶的最适反应pH,说明该角蛋白酶具有较强耐碱性环境的能力。
3 讨论与结论
本诱变育种试验中引入了“解除氮代谢分解调节”这一筛选步骤,有效抑制了无解除氮源分解调节突变株的生长[26-27]。1 253株突变株对应的牛奶水解圈宽度占比整体偏向于其所拟合正态分布曲线期望值大的一侧,表明获得的单菌落突变体库有着“具有更高的蛋白酶生产基础值”的特征。羽毛降解复筛前,对突变株RT、BM′、CV′、FX′和NK′连续传代培养5次,保证遗传稳定性,防止复筛过程中因为遗传不稳定造成的菌株退化。本研究最终筛选获得突变株NK′,该突变株的羽毛降解能力强,在发酵48 h时羽毛降解效率为野生型BJA-103菌株的5倍。突变株NK′在发酵72 h时角蛋白酶活性最高(41.6 U);该角蛋白酶最适反应温度为70 ℃时,对应角蛋白酶活性为114.2 U;最适反应pH为11时,对应角蛋白酶活性为63.1 U。
目前,耐高温酶及耐碱酶是工业应用明星酶,也是研究的热点之一[28]。在进一步降解/发酵试验后,突变株NK′有希望作为工业羽毛降解菌/酶投入应用。后续试验中,可对突变株NK′的角蛋白酶编码基因进行进一步研究,对比野生型BJA-103菌株角蛋白酶编码基因,可以为相关代谢通路的构建提供理论依据。

