大别山牛PAX3基因多态性及其与生长性状的关联分析
赵拴平,金 海,徐 磊,李 默,贾玉堂
(安徽省农业科学院 畜牧兽医研究所,畜禽产品安全工程安徽省重点实验室,安徽 合肥230031)
中国黄牛是世界牛品种资源宝库的重要组成部分,按照地理分布区域的不同,分为北方黄牛、中原黄牛和南方黄牛3大类[1]。大别山牛是中原黄牛的典型代表,主要分布于安徽省的太湖、岳西、桐城、潜山、金寨、宿松等县和湖北省大别山西部的黄陂、大悟、麻城等部分地市。长期以来,大别山牛作为农业生产的主要畜力,形成了耐粗饲、抗病力强、肉质细腻、善爬坡的优良特点,但同时也具有个体小、生长慢等不足。近年来,随着分子生物学技术的发展,利用分子标记辅助选择技术对大别山牛进行选育具有重要的现实意义。
PAX基因家族普遍存在于各种生物中,编码128个氨基酸成对结构域,在胚胎细胞的发育和分化过程中发挥着重要作用[2]。PAX3是PAX基因家族成员之一,是肌祖细胞生存、迁移和分化的必需因子[3-4]。在成熟的体细胞中,PAX3基因通过与cis活性因子结合调节Myf5基因的表达,从而参与骨骼肌发育[4]。此外,PAX3基因可以通过多种途径促进细胞自我更新,诱导前体细胞发生定向迁移,促进特定细胞系进行定向分化[5]。在人和小鼠胚胎发育过程中,PAX3基因在细胞迁移、分化和器官形成中发挥着重要作用,其变异会引起神经嵴细胞功能障碍,进而导致胚胎发育畸形[6-8]。在禽脊柱发育过程中,PAX3基因转录因子对胚胎形态发生和细胞分化具有调节作用[9]。在哺乳动物中,PAX3基因可以促进羊肌卫星细胞的增殖,抑制其分化[10]。近年来有研究发现,PAX3基因单核苷酸多态性(SNPs)与中国牛早期生长性状显著相关[11],说明其对牛早期生长发育具有重要作用,但是否会影响其成年后经济性状有待进一步研究。为此,本研究采用PCR和测序技术,探究PAX3基因SNPs位点与成年大别山牛群体生长性状的相关性,旨在为大别山牛的遗传选育提供依据。
1 材料与方法
1.1 试验动物
292头体况健康、无亲缘关系、24~48月龄的成年大别山母牛,由国家肉牛牦牛产业技术体系合肥综合试验站试验基地安徽省阜阳市颍上县牛哥牧业科技有限公司和国家肉牛核心育种场安庆市太湖县久鸿农业综合开发有限责任公司提供。
1.2 样品采集及体尺指标测定
采集试验牛黄豆大小的耳组织,放入加有体积分数75%乙醇的离心管中,冷藏于冰盒中带回实验室备用。采样同时测量试验牛的体斜长、体高、十字部高、胸围、腹围、管围、腰角宽、坐骨端宽等生长性状数据。
1.3 引物设计与合成
经前期试验初步筛查,牛PAX3基因在试验群体中仅第4和第6内含子存在SNPs位点。以NCBI数据库中牛PAX3基因(GenBank登录号:NC_007300.6)为模板,利用Primer 5.0软件设计针对第4和第6内含子的引物,交由生工生物工程(上海)股份有限公司合成,引物序列信息见表1。
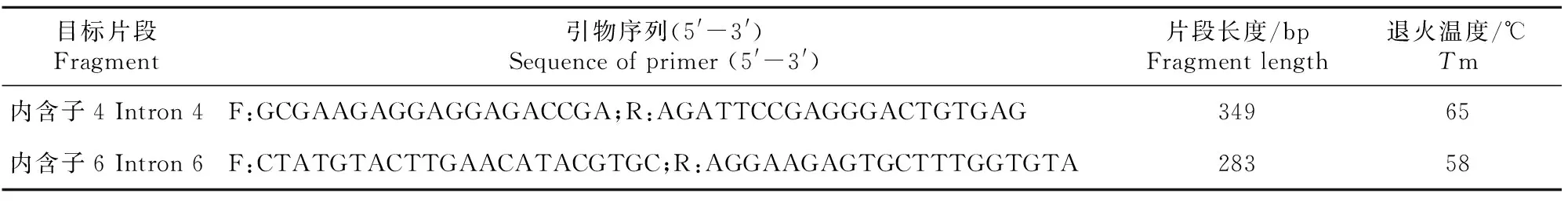
表1 牛PAX3基因的引物信息Table 1 Primer information for bovine PAX3 gene
1.4 PAX3基因第4内含子和第6内含子多态性位点检测
利用天根生化科技(北京)有限公司的血液/细胞/组织基因组DNA提取试剂盒(DP304)进行牛组织样基因组提取,将提取好的DNA统一稀释至100 ng/μL,冷藏备用。
利用设计的引物进行PCR扩增,扩增体系为:2×TaqMix 12.5 μL,上、下游引物(10 μmol/L)各1 μL,DNA模板1 μL,用ddH2O补充至25.0 μL。PCR扩增条件为:95 ℃预变性5 min;95 ℃变性30 s,58或65 ℃(具体温度依引物而定)退火30 s,72 ℃延伸30 s,32个循环;72 ℃总延伸5 min。扩增产物用3.0%琼脂糖凝胶电泳检测,阳性样品送生工生物工程(上海)股份有限公司进行测序,测序结果利用DNAStar和Mutation Surveyor V4.0.8软件进行分析。
1.5 数据统计与分析
根据基因型分析结果,计算基因型频率和等位基因频率,利用POPGENE软件进行哈代-温伯格平衡检验[12]及多态信息含量(PIC)、遗传纯合度(Ho)、遗传杂合度(He)和有效等位基因数(Ne)分析[13-14];利用Haploview软件进行多态位点的连锁不平衡分析[15],SHEsis在线软件进行单倍型分析[16];采用SPSS 23.0软件中的GLM模型[17]分析SNPs位点的基因型/单倍型组合与大别山牛群体生长性状的相关性,结果用“平均值±标准误”表示,以P<0.05或P<0.01为差异显著水平进行差异显著性分析。
2 结果与分析
2.1 大别山牛PAX3基因的SNPs位点
对大别山牛PAX3基因第4内含子和第6内含子区进行PCR扩增,琼脂糖凝胶检测结果(图1)显示,目标片段大小与预期结果一致。利用Mutation Surveyor V4.0.8软件对测序结果进行分型,结果(图2)显示,第4内含子区存在3个SNPs位点,分别为g.4718G>C、 g.4744T>C和g.4757C>A;第6内含子区只存在1个SNPs位点,为g.78920C>T。
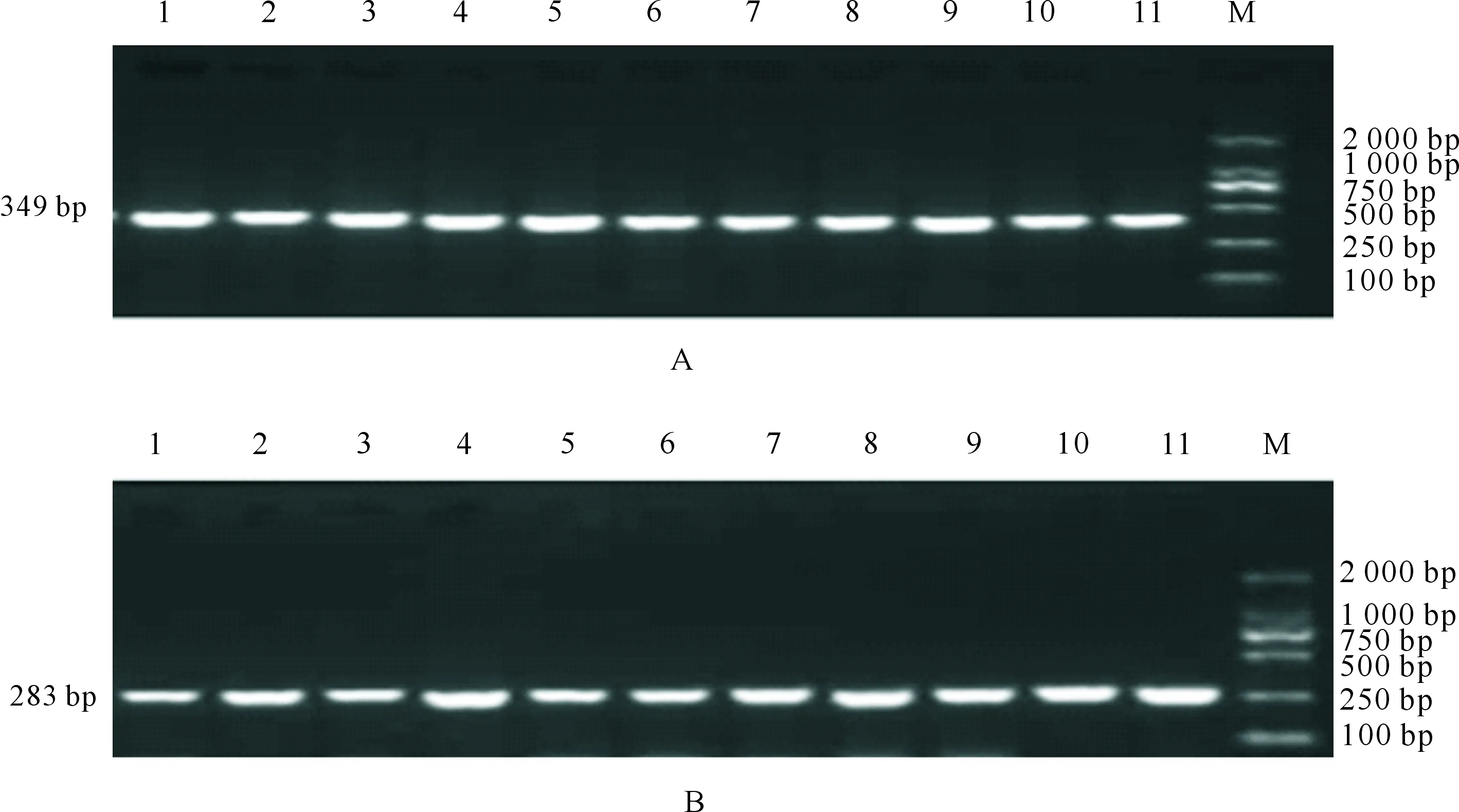
1~11.PCR的扩增片段;M.D2000 Marker1-11.Amplification products;M.Marker D2000
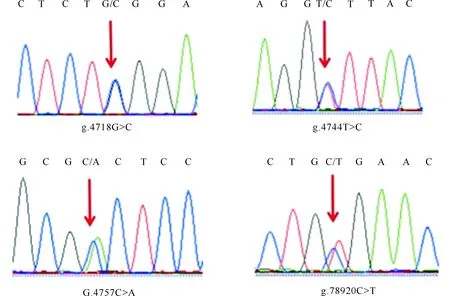
图2 大别山牛PAX3基因4个SNPs位点图谱Fig.2 Maps of four SNPs sites of PAX3 gene of DBS cattle
2.2 大别山牛PAX3基因SNPs位点的遗传参数
PAX3基因各SNPs位点的基因频率和基因型频率分布如表2所示。在随机挑选的292头大别山牛群体中,PAX3基因第4内含子区g.4718G>C位点属于低度多态(PIC≤0.25),且处于哈代-温伯格平衡状态(P>0.05),等位基因C的频率远高于等位基因G,CC基因型为优势基因型;g.4744T>C位点属于中度多态(0.25
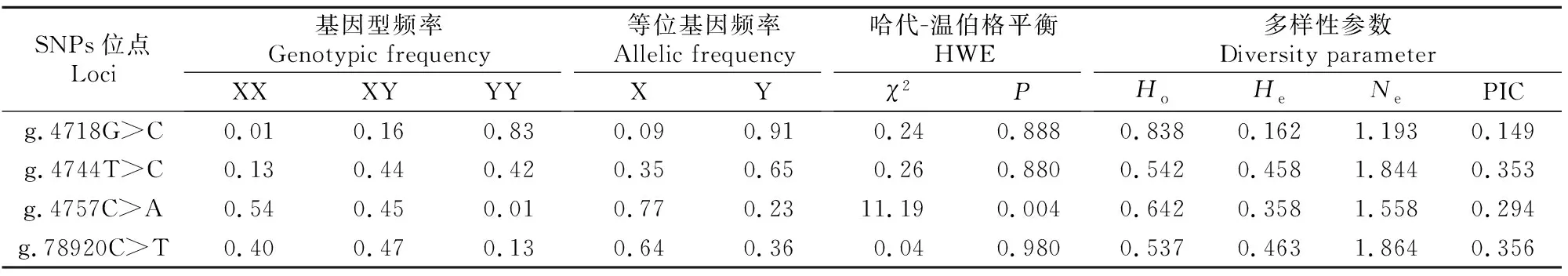
表2 大别山牛群体PAX3基因SNPs的遗传参数Table 2 Genetic parameters of SNPs in PAX3 gene of DBS cattle
2.3 大别山牛PAX3基因SNPs位点的连锁不平衡和单倍型分析
连锁不平衡和单倍型分析结果(表3和表4)显示,4个SNPs位点间无强连锁相关(r2<0.33),形成13种单倍型,其中频率大于0.03的单倍型有6个,Hap1和Hap2频率最高,分别为0.242和0.227。相关性分析结果显示,6种单倍型形成的单倍型组合均与大别山牛群体的生长性状无显著相关性(P>0.05)。
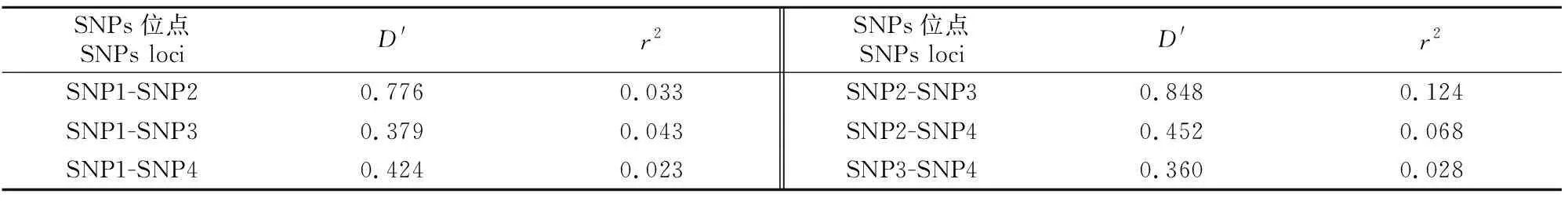
表3 大别山牛PAX3基因SNPs位点的连锁不平衡分析Table 3 Estimated values of linkage disequilibrium (LD) analysis between mutation sites in bovine PAX3 gene
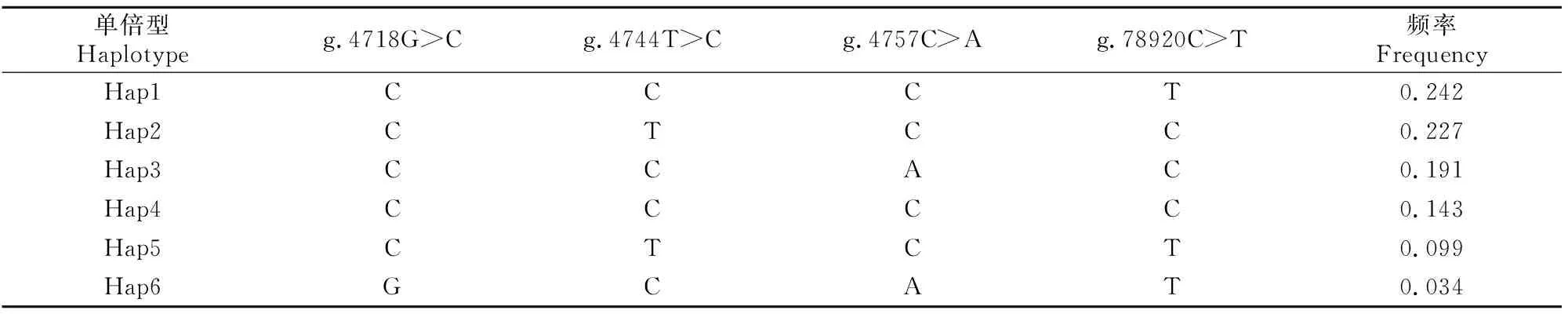
表4 大别山牛PAX3基因SNPs位点的单倍型分析Table 4 Haplotypes of PAX3 gene and their frequencies in DBS cattle
2.4 大别山牛PAX3基因SNPs位点多态性与生长性状的相关性
PAX3基因SNPs位点多态性与大别山牛群体生长性状的相关性分析结果(表5)显示,4个SNPs位点均与大别山牛群体部分生长性状显著(P<0.05)或极显著相关(P<0.01)。其中,g.4718G>C位点与大别山牛的十字部高显著相关(P<0.05),GG基因型个体的十字部高显著优于GC和CC基因型个体(P<0.05)。g.4744T>C位点与大别山牛的十字部高、腹围和腰角宽极显著相关(P<0.01),TT基因型个体的十字部高、腹围和腰角宽极显著优于TC和CC基因型个体(P<0.01)。
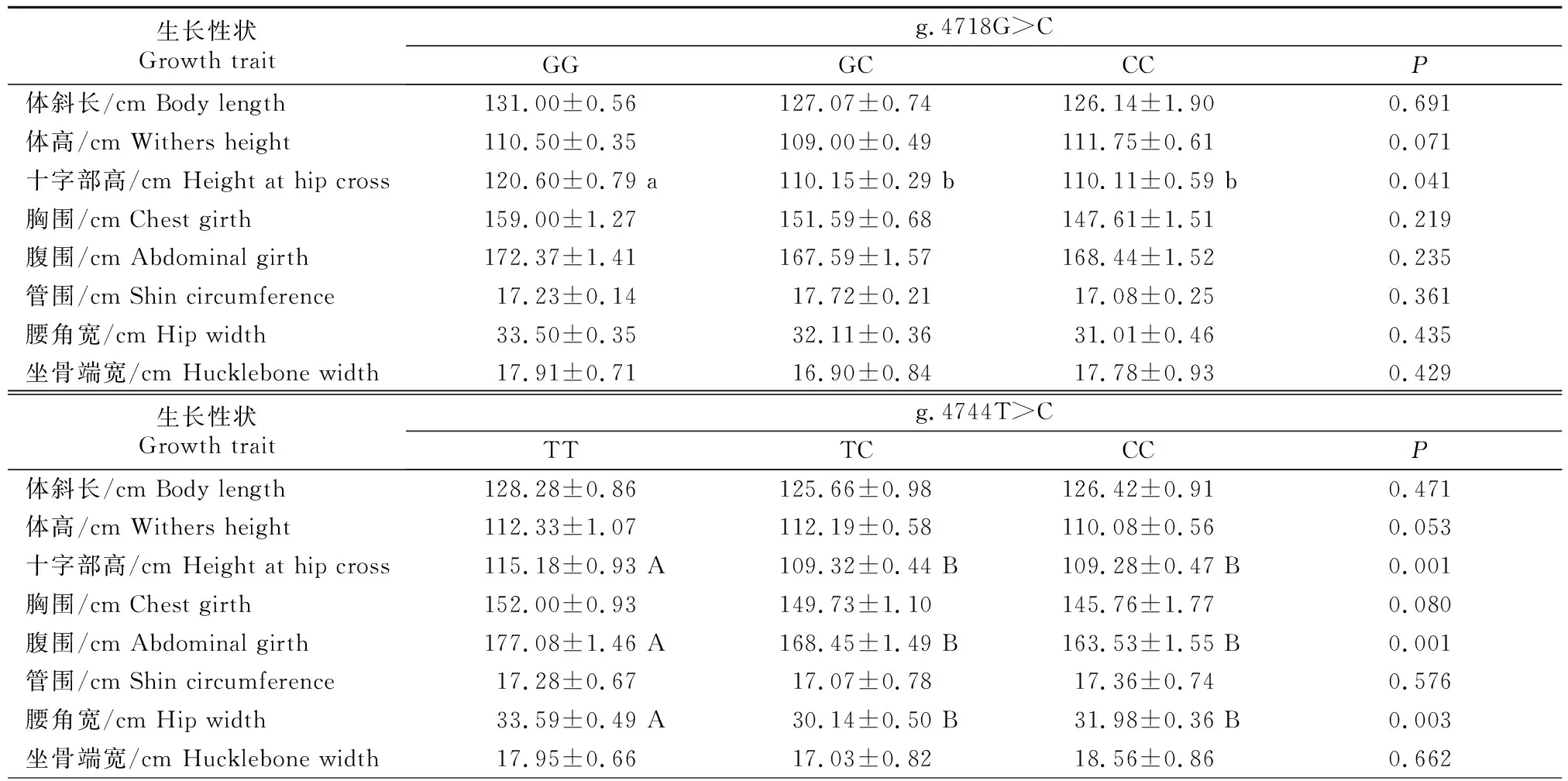
表5 大别山牛PAX3基因SNPs位点多态性与体尺性状的相关性分析Table 5 Association of SNPs polymorphism of PAX3 gene with growth traits of DBS cattle
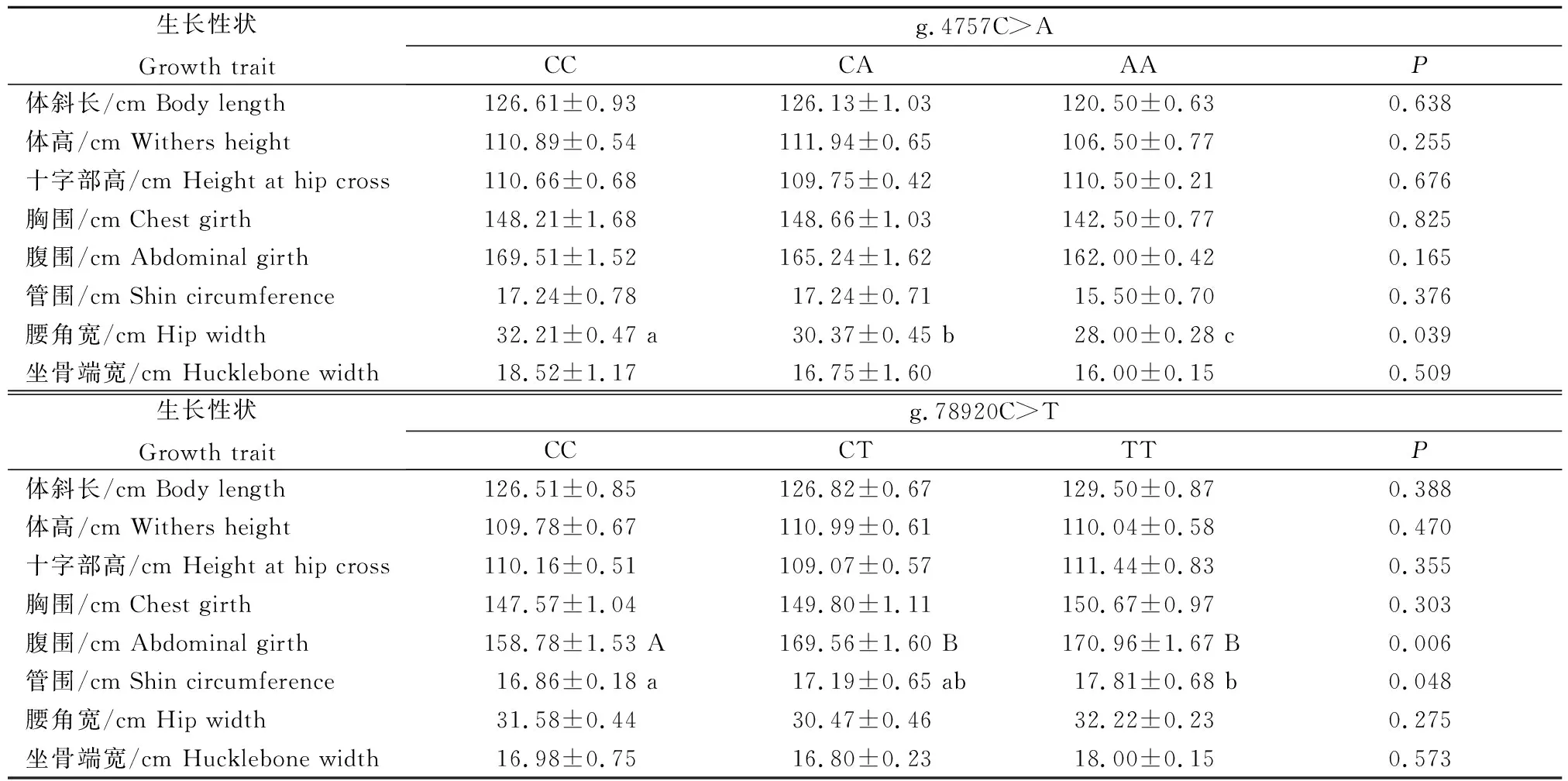
表5(续) Continued Table 5
g.4757C>A位点与大别山牛的腰角宽显著相关(P<0.05),CC、CA和AA基因型个体的腰角宽两两均差异显著(P<0.05),且CC基因型个体优于CA和AA基因型个体(P<0.05)。g.78920C>T位点与腹围极显著相关(P<0.01),与管围显著相关(P<0.05),TT和CT基因型个体的腹围均值极显著优于CC基因型个体(P<0.01),TT基因型个体的管围均值显著优于CC基因型个体(P<0.05)。
3 讨论与结论
近年来,随着分子生物学技术的发展,分子标记辅助育种技术(MAS)在生物育种中发挥着极其重要的作用,鉴定出一系列与生物表型性状相关的DNA分子标记[18-19]。PAX基因家族普遍存在于各种生物中,在肌肉生长发育过程中发挥重要的调控作用。PAX3基因突变可造成黑素细胞合成和神经嵴发育异常,从而造成毛发皮肤低色素、虹膜异色以及颅面骨骼、牙齿及四肢等异常,最终表现为瓦登伯革氏综合症[20-21]。在癌症研究中发现,PAX3基因参与调控癌细胞的增值、分化和迁移,沉默PAX3基因能显著抑制肿瘤生长,降低肿瘤微血管密度,已经成为研究肿瘤发生发展的重要标记基因之一[22]。在小鼠发育过程中,PAX3基因通过与Aryl碳氢化合物(AHR)互作抑制环境对小鼠颅面发育的影响[23],通过mTORC1通路作用于肌卫星细胞而使其对外界环境刺激产生防御[24],通过调控肌细胞的增殖、分化、迁移等影响小鼠的体质量等表型性状[25]。此外,有研究发现,PAX3基因g.580T>G、g.4617A>C和 g.79018Ins/del G位点与南阳牛、秦川牛、鲁西牛和郏县红牛部分体尺性状显著相关[11]。因此研究PAX3基因遗传变异对我国地方品种大别山牛生长发育的影响至关重要。
牛PAX3基因定位于2号染色体体质量相关QTL区域[26],其编码蛋白质分布于细胞核中,对细胞迁移、组织器官的分化和形成起着重要的调控作用。本研究采用PCR和测序技术首次对292头大别山牛PAX3基因进行多态性分析,结果发现4个SNPs位点:g.4718G>C、g.4744T>C、g.4757C>A和g.78920C>T。在g.4718G>C、g.4744T>C和g.78920C>T位点,大别山牛群体均处于哈代-温伯格平衡状态(P>0.05),说明群体遗传未受到人工干预或未发生遗传突变,选择压力较小。在g.4757C>A位点,大别山牛群体处于哈代-温伯格不平衡状态(P<0.05),可能是试验所选大别山牛群体数量较少或人工选育对此位点的选择压力较大[27-28]。遗传多样性分析发现,g.4744T>C、g.4757C>A和g.78920C>T位点属于中度多态(0.25
本研究发现PAX3基因SNPs位点与大别山牛群体部分体尺性状具有显著或极显著相关性,这与Xu等[11]的研究结果一致,进一步证实PAX3基因对我国地方品种牛的生长发育具有重要影响。然而,本研究中的SNPs位点与Xu等[11]研究中的SNPs(g.580T>G和g.79018Ins/del G)均位于PAX3基因内含子区,不参与转录过程,遗传变异不会引起氨基酸改变,这可能与基因内含子区可以作为转录调控的增强子或抑制子影响转录效率,通过调节核小体位置控制DNA结合而调节转录过程有关[29-30],从而发挥其生物学功能。因此,本研究结果可以作为PAX3基因影响大别山牛生长发育的重要证据之一。

